Az alacsony fehérjetartalmú étrend jótékony hatással van a cukorbetegség állapotára és megakadályozza a diabéteszes nephropathiát a Wistar zsíros patkányokban, a 2-es típusú cukorbetegség és az elhízás állatmodelljében.
Absztrakt
Háttér
A tanulmány célja egy fiatal korától kezdődő alacsony fehérjetartalmú étrend (LPD) cukorbetegségre és vesekárosodásra gyakorolt hatásainak vizsgálata 2-es típusú cukorbetegség és elhízás patkány modelljében.
Mód
Cukorbeteg férfi Wistar zsíros (fa/fa) patkányokat (WFR) standard táplálékkal (23,84% fehérje) vagy LPD-vel (5,77% fehérje) tápláltak 24 héten át, 6 hetes kortól kezdve. Vizsgáltuk az LPD teljes testtömegre (BW) gyakorolt hatását; zsírtömeg (FW); alsó végtag izomtömege (MW); számos diabéteszes állapotmérés, beleértve az éhomi/véletlenszerű glükózszinteket, a HOMA-IR és az IPITT; vesekárosodás, beleértve a vese hipertrófiáját, albuminuriát és szövettani változásokat. Ezenkívül az mTORC1 autofágia és aktivációját értékeltük a diabéteszes vesekéregben. Kiértékelték továbbá a plazma FGF21 és a nagy molekulatömegű (HMW) adiponektin szinteket, valamint az UCP1 expressziós szinteket a barna zsírszövetben (BAT).
Eredmények
A WFR-ekben a BW és FW növekedését az LPD jelentősen csökkentette, és az LPD az alsó végtag MW jelentős csökkenését eredményezte a WFR-ekben. Az LPD az inzulinrezisztencia javításával elnyomta a glükózszint emelkedését a WFR-ekben. Az LPD emelte a WFR-ek plazma FGF21 és HMW adiponektinjét, valamint az állatok BAT-jában az UCP1 expressziót is. Vese hipertrófiát, albuminuriát, vese szövettani változásokat, valamint a p62 és a foszfo-S6 riboszomális fehérje (p-S6RP) fokozott expresszióját figyelték meg WFR-ekben, összehasonlítva a WLR-ek értékével. Az LPD egyértelműen megakadályozta, hogy a diabéteszes vesék károsodást szenvedjenek.
Következtetések
Az LPD megakadályozta a diabéteszes állapot progresszióját; ez a hatás összefüggésbe hozható az FW csökkenésével és a plazma FGF21 és HMW adiponectin emelkedésével, valamint az UCP1 expressziójával BAT-ban, ami a diabéteszes nephropathia szuppresszióját eredményezi. Patkányokban azonban az MW-t fiatal korától kezdve csökkentette az LPD fogyasztása; ezért további kutatásokra van szükség az LPD táplálkozási kérdésének megoldásához az MW csökkenésével.
Háttér
A 2-es típusú cukorbetegségben szenvedő betegek száma világszerte növekszik. A 2-es típusú cukorbetegség szorosan összefügg az elhízással, és a 2-es típusú cukorbetegség közelmúltbeli növekedése világszerte nagyrészt az elhízás növekedését tükrözi. A diabéteszes érrendszeri szövődmények közé tartozik a mikroangiopathia, például a retinopathia, a neuropathia és a nephropathia, valamint az érelmeszesedésen alapuló makroangiopathia. Ezen diabéteszes érrendszeri szövődmények között a cukorbetegek 40% -ában alakul ki diabéteszes nephropathia, és továbbra is a végstádiumú vesebetegség (ESRD) vezető oka [1]. Ezenkívül a szív- és érrendszeri betegségek (CVD) morbiditási aránya magas a diabéteszes nephropathiás betegeknél, ami hozzájárul a halálozási arányhoz. Van egy ördögi kör a krónikus vesebetegség (CKD) között, beleértve a diabéteszes nephropathiát és a CVD-t [2], mivel az ilyen betegek nemcsak cukorbetegségben szenvednek, hanem elhízásban, diszlipidémiában, magas vérnyomásban és más olyan állapotokban is, amelyeket a a CKD és a CVD progressziója. Ezért mind a diabéteszes nephropathia, mind a CVD megelőzésére ajánlott multifaktoriális kezelés a többszörös rizikófaktorok ellenőrzése és a kardiorenalis metabolikus egészség fenntartása érdekében [3,4,5].
Mód
Kísérleti állatok
Biokémiai mérések
A HbA1c szintet DCA 2000 analizátorral (Siemens Medical Solutions Diagnostics, Tokió, Japán) mértük a kísérlet végén. A vizeletalbumint, a plazma inzulint, az FGF21-et és a nagy molekulatömegű (HMW) adiponektint ELISA-készletek segítségével mértük (vizeletalbumin: NEPHRAT II, Exocell, Inc., Philadelphia, PA, USA; plazmainzulin: Morinaga Institute of Biological Science, Inc. ., Kanagawa, Japán; plazma-adiponektin: SHIBAYAGI Co., Ltd., Gunma, Japán). A plazma teljes koleszterinszintet (T-CHO) és a triglicerideket (TG) egy Pureauto S TG-N kit (Sekisui Medical, Tokió, Japán) és egy L-típusú koleszterin H-tesztkészlet (Wako Pure Chemical Industries, Osaka, Japán) alkalmazásával mértük. ). A vizelet kreatinint (Cr) enzimatikus módszerekkel mértük. A HOMA-IR homeosztázis-modell értékelésének képlete a következő volt (éhomi plazma glükóz × éhomi plazma inzulin)/405.
IPGTT és IPITT
IPGTT-t és IPITT-t 24 hetes beavatkozás után végeztünk, a korábban leírtak szerint [16]. Röviden, a glükóz tolerancia tesztek céljából a patkányokat egy éjszakán át 16 órán át éheztettük, majd intraperitoneális glükóz injekciót (1 g/testtömeg-kg). A vércukorszintet az injekció után 0, 15, 30, 60 és 120 perccel összegyűjtött farokvérrel mértük. Az inzulin tolerancia tesztek céljából a patkányokat intraperitoneálisan injektálták normál humán inzulinnal (Novolin R; Novo Nordisk, Clayton, NC) 0,75 U/testtömeg-kilogrammonként 6 órás böjt után, és a vércukorszintet 0, 15, 30 és 60 perc múlva.
Morfológiai elemzés
A vese szakaszokat Masson-féle trichrommal (MT) festették. A vesefibrózis szemikvantitatív értékeléséhez MT festéssel 10 patkányonként véletlenszerűen kiválasztott glomerulusban vagy tubulo-interstitialis területen a fibrózisra festett területek százalékos arányát a következőképpen osztályoztuk: 0, 0-5% festés; 1, 5-25%; 2, 25-50%; 3, 50-75%; és 4,> 75% [16].
Valós idejű PCR
A teljes RNS izolálását a vesekéregből vagy a barna zsírszövetből (BAT), a cDNS szintézist és a kvantitatív valós idejű PCR-t a korábban leírtak szerint hajtottuk végre [16]. TaqMan szondák 3-as típusú kollagénhez (Col3) (Termék azonosító: Rn01437681), Cd68 (Rn01495634), interleukin-6 (Il6) (Rn01410330), CC motívum kemokin-ligandum 2 (Ccl2) (Rn00580555), Toll-szerű 4-es receptorhoz (Tlr4) ) (Rn00569848), az 1-es vesekárosodású molekulát (Kim-1) (RN00597703) és a szétkapcsoló fehérjét1 (Ucp1) (Rn00562126) a Thermo Fisher Scientific-től (Waltham, MA, USA) vásároltuk [16]. Az analitikai adatokat a 18 s (Rn03928990) mRNS expresszió szintjére normalizáltuk belső kontrollként.
Western blottolás
Western-blotot a p62 (1: 1000), a β-aktin (1: 1000), a foszfo-S6 riboszomális fehérje (S6RP) (1: 1000) és az S6RP (1: 1000) elleni antitestek alkalmazásával végeztük, az előzőekben leírtak szerint [16 ]. Az anti-p62 antitestet az Medical & Biological Laboratories-tól (Nagoya, Japán) szereztük be. Anti-β-aktint, anti-foszfo-S6RP és anti-S6RP antitesteket a Cell Signaling Technology-tól (Danvers, MA, USA) szereztünk be. Az UCP1 elleni antitestet az Abcam-tól (Cambridge, MA, USA) szereztük be.
Statisztikai analízis
Az adatokat átlag ± szórásként (SD) fejezzük ki. ANOVA-t, majd Tukey többszörös összehasonlító tesztjét alkalmazták a három vagy több csoport közötti különbségek jelentőségének meghatározásához, és a Student's t-tesztet alkalmaztunk páratlan összehasonlításokhoz. A o értéke
Eredmények
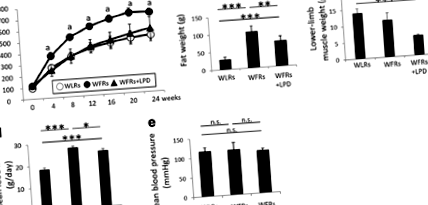
Az LPD csökkenti az anyagcsere-zavarokat cukorbeteg és elhízott patkányokban
Az LPG-vel táplált WFR-ekben megemelkedik az FGF21 és a HMW plazma adiponektin szintje és az UCP1 mRNS expressziója BAT-ban
Az FGF21 és a HMW plazma adiponektin-koncentrációit 16 órás gyors és tetszőlegesen kiválasztott étkezés utáni időpontokban (10 órától kezdődően) mértük a 24 hetes étrendi beavatkozás után. A három patkánycsoport között nem figyeltünk meg különbségeket az éhomi FGF21 szintekben (3a. Ábra). Habár a plazma FGF21 szintje jelentősen csökkent az étkezés után a WLR-ekben és az STD-vel táplált WFR-ekben, ezek az FGF21-ben bekövetkezett változások az étkezés után nem voltak megfigyelhetők az LPD-vel táplált WFR-ekben (3a. Ábra). Ezenkívül a plazma HMW adiponectin szintje a 16 órás böjt után szignifikánsan alacsonyabb volt a WFR-ekben, mint a WLR-ekben. Az LPD-vel táplált WFR-ekben a plazma HMW adiponektin szintje szignifikánsan nagyobb növekedést mutatott, mint a WLR-ek vagy az STD-vel táplált WFR-ek (3b. Ábra). Ezzel szemben a 3 patkánycsoport között az önkényesen kiválasztott időpontokban nem tapasztaltunk különbséget a plazma HMW adiponektin szintjeiben (3b. Ábra). Ezek az adatok arra utalnak, hogy az LPD hozzájárul a plazma FGF21 és HMW adiponektin emelkedéséhez. Ezenkívül mind az Ucp1 mRNS-expressziója, mind az UCP1 fehérje-expressziója szignifikánsan megnőtt az LPD-vel kezelt WFR-ek BAT-jában, összehasonlítva az STD-vel táplált WFR-ekével (3c-e ábra).
Változások a vesemorfológiában, a vizelet albumin kiválasztásában és a vesekárosodásban
Vita
Ebben a tanulmányban bebizonyítottuk, hogy egy fiatal kortól érvényes LPD megakadályozta a glükózszint emelkedését és enyhítette az inzulinrezisztenciát és a dyslipidaemiát egy 2-es típusú cukorbetegség és elhízás állatmodelljében, a Wistar zsíros patkányokban. A diabétesz státusának ezek a javulásai összefüggésben lehetnek a megnövekedett plazma FGF21, HMW adiponektin és UCP1 expresszióval a WFR-ek BAT-jában. Ezenkívül az LPD végrehajtása fiatal kortól megakadályozta a diabéteszes vese sérülések, köztük a glomeruláris és tubulo-interstitialis károsodások progresszióját. Ezenkívül az LPD mind a zsír-, mind az izomtömeg csökkenését eredményezte a WFR-ekben.
A szisztémás metabolikus változások, köztük a glükóz metabolizmus javulásán túl, korábbi jelentések azt mutatták, hogy az FGF21 db/db egerekben és diétás egerekben anti-fibrotikus, gyulladáscsökkentő és antioxidáns stressz hatásokkal védett a cukorbetegség által kiváltott vesekárosodás ellen. indukált elhízás és 2-es típusú cukorbetegség [43, 44]. Ezért adatunk azt is jelezte, hogy az LPD közvetetten és közvetlenül is védhet a diabéteszes nephropathia ellen az FGF21 indukció révén.
Következtetések
A fiatal kortól érvényes LPD megakadályozta a cukorbetegség állapotának előrehaladását és a zsírtömeg növekedését, amely összefüggésbe hozható a plazma FGF21 és HMW adiponektin emelkedésével, valamint az UCP1 túlzott expressziójával BAT-ban, ami a diabéteszes vesekárosodások elnyomását eredményezte. WFR-ekben. Azt a mechanizmust, amellyel az LPD elnyomja a cukorbetegség előfordulását, még nem sikerült teljesen tisztázni. Ezenkívül a hosszú távú LPD-vel is kapcsolatban lehetnek bizonyos problémák, beleértve az alultápláltságot vagy a szarkopéniát. Ezért további vizsgálatokra van szükség ezeknek a pontoknak a feloldásához és az LPD metabolikus egészségének és renoprotekciójának hasznosabb étrendi protokollok vagy pótlások kidolgozásához.
- Az alacsony zsírtartalmú elemi diétaterápia jótékony hatása a krónikus hasnyálmirigy-gyulladás fájdalmára
- A mexikói férfiak és nők társadalmi-gazdasági állapota és az étrend minősége közötti kapcsolat
- A diabéteszes étrend elkészítésének 12 alapja a mindennapi egészség
- Hasznos baktériumok Hogyan adjunk savanyú káposztát étrendjéhez
- Az anális gáz ürítése és a vastagbél mikrobiota a diétás bél puffadással járó betegeknél