Az alacsony szénhidráttartalmú étrend és a testmozgás anyagcsere szempontjai
Sandra J Peters
1 Alkalmazott Egészségtudományi Kar, Brock Egyetem, St. Catharines, ON, Kanada L2S 3A1
Paul J LeBlanc
1 Alkalmazott Egészségtudományi Kar, Brock Egyetem, St. Catharines, ON, Kanada L2S 3A1
Ez egy nyílt hozzáférésű cikk, amelyet a Creative Commons Nevezési Licenc (http://creativecommons.org/licenses/by/2.0) feltételei szerint terjesztenek, és amely korlátlan felhasználást, terjesztést és sokszorosítást tesz lehetővé bármely médiumban, feltéve, hogy az eredeti mű megfelelően idézik.
Absztrakt
Alacsony szénhidráttartalmú étrendet követve elmozdulás a több zsír és kevesebb szénhidrát oxidáció felé mozog, hogy energiát nyújtson a vázizmoknak, mind nyugalmi állapotban, mind edzés közben. Ez az áttekintés összefoglalja az emberi vázizom szénhidrátok és zsírok metabolikus adaptációinak legutóbbi munkáját az alacsony szénhidráttartalmú étrend mellett, elsősorban a piruvát-dehidrogenázra és a piruvát-dehidrogenáz-kinázra összpontosítva, valamint arra, hogy ezek a változások hogyan kapcsolódnak az edzés közbeni szénhidrát-oxidáció képességéhez.
Felülvizsgálat
A vázizomzatokat tápláló kémiai energiaforrások endogén depókon (intramuszkuláris glikogén és trigliceridek) vagy exogén forrásokon (plazma glükóz és szabad zsírsavak) keresztül állnak rendelkezésre. Viszont ezeket az exogén és endogén üzemanyag-forrásokat az étrendi bevitel révén pótolják. Ennek eredményeként fontos kapcsolat van az étrend és az üzemanyagcsere között a vázizomzatban.
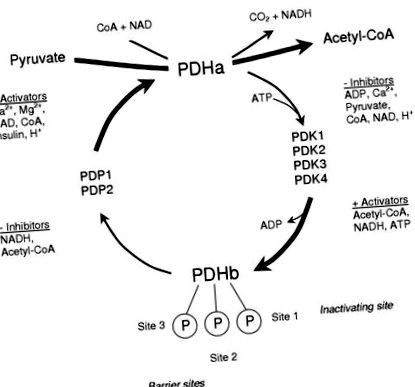
Az alacsony szénhidráttartalmú étrendek egyre népszerűbbek a fogyás módszereként. Ezeket az étrendeket, amelyek korlátozzák a napi étrendi szénhidrátbevitelt, alacsony szénhidráttartalmú étrendnek (LCD) nevezik. Az LCD hatásainak értékelésekor néhány tényezőt figyelembe kell venni, mivel ezek befolyásolhatják a mért eredményt. Ezek magukban foglalják az étrend összetételét (mivel az LCD pótolhatja a hiányzó CHO-kat fehérjével vagy zsírral), valamint az étrendi időszak időtartamát. Jelen áttekintés céljából az LCD elsősorban az alacsony zsírtartalmú, alacsony szénhidráttartalmú izokalórikus étrendekre vonatkozik. 1. ábra) szénhidrátforrásokból, ezáltal szabályozva a fluxust a szénhidrát oxidációval, és közvetetten meghatározva a zsír oxidációjának sebességét. Az aktív formájában lévő PDH mennyisége (PDHa) meghatározza aktivitását, és a szabályozást reverzibilis foszforilezéssel érik el, amelyet egy belső PDH-foszfatáz (PDP) katalizál, amely defoszforilálja és aktiválja a PDH-t, valamint a PDH-kinázt (PDK), amely foszforilálja és gátolja a PDH-t. [5]. A PDH E1 alegységének három ismert foszforilációs helye van, az első hely a komplex inaktiválásához szükséges, a másik két hely pedig gáthelyként működik a foszfatáz aktivációjának gátlásához [6].
A piruvát-dehidrogenáz enzim komplex szabályozásának aktiválása foszforilációs és defoszforilezési ciklussal.
A PDH kovalens szabályozó enzimjeinek mindegyike alloszterikus szabályozás alá esik. A komplex foszforilezését egy négy PDK izoformából álló család katalizálja (PDK1-4), amelyek különböznek a piruvát által okozott alloszterikus gátlás vagy az energia töltéssel történő aktiválás (ATP/ADP arány), a redox (NADH/NAD + arány) és acetil-CoA-szabad CoA arány (lásd a [7] áttekintést). Ezenkívül a kinázok különböznek a különböző foszforilációs helyek specifitásától [7]. Így a PDK izoform populáció relatív aktivitása határozza meg a PDH komplex válaszát akut helyzetekben. A foszfatázok belső párja (PDP1 és 2) katalizálja a PDH defoszforilezését és aktiválódását [8]. A PDP1 az izoform, amely növekvő koncentrációjú Ca 2+ ionok jelenlétében aktiválódik (amire az edzés során számítani lehet), míg a PDP2 akkor aktiválódik, ha az étrendi manipulációk során megemelkedik az inzulinszint [8].
Nyugalmi állapotban a PDH főként foszforilálódik és inaktív a magas energia töltés, a redox és az acetil-CoA-szabad CoA arány és az alacsony piruvát-koncentráció miatt, amelyek fenntartják a magas PDK-aktivitást. A foszfatáz aktivitás nyugalmi állapotban alacsony, az alacsony intramuszkuláris Ca 2+ szint miatt. A testmozgás során a szarkoplazmatikus retikulumból származó Ca 2+ felszabadulás az elsődleges inger, amely durván aktiválja a PDH-t, míg a piruvátkoncentrációban, az energia töltésében bekövetkező változások és esetleg a redox finomhangolja ezt az aktiválást (áttekintés céljából lásd [9]), annak érdekében, hogy megfeleljen a PDH-nak. aktiválás a CHO oxidáció iránti igényhez [10].
Az intramitokondriális effektorok fontossága mellett a PDH-aktiváció akut szabályozásában az első néhány másodpercben vagy percben a PDH aktivációs állapotának hosszú távú vagy krónikus megváltoztatása valósítható meg a PDK abszolút szintjének stabil változásával és/vagy PDP. A PDH aktiválásának sebessége a PDK és a PDP aktivitási arányától függ, és bármelyik kovalens módosító kifejeződésének megváltozása megváltoztatja a PDH aktiválásának vagy inaktiválásának sebességét. Ezek a krónikus változások órák vagy napok alatt jelentkeznek, és függetlenek az intramitochondriális effektor koncentrációinak akut változásaitól.
Az alacsony szénhidráttartalmú étrend hatása
Csontvázizom piruvát dehidrogenáz aktív formájában (PDHa) nyugalmi állapotban és testmozgás közben alacsony szénhidráttartalmú (LCD) és magas szénhidráttartalmú étrendben. * jelzi az LCD jelentőségét. Putman és mtsai. [11].
A későbbi vizsgálatok adaptív változásokat mutattak ki a PDK szintjén, a PDH aktiválásának következményes változásaival. A PDK-aktivitás adaptívan növekedett az emberi vázizomzatban az LCD 6 napos kezelését követően [12] (3. ábra. 3. ábra). A PDK aktivitása mindössze 24 óra alatt növekedett, és lineáris módon tovább növekedett a 6 napos diéta során [13]. Az emberi vázizomzatban megnövekedett PDK-aktivitás a megnövekedett PDK4 mRNS-hez és a fehérje expresszióhoz társult, amely 24 óra után maximálisan megnövekedett [13]. Ezek a vizsgálatok a PDK4 expresszió szelektív növekedését javasolják LCD-vel. A PDK aktivitás növekedése az LCD során összefüggésbe hozható a vérből származó glükóz clearance csökkenésével, az egészséges fiatal férfiak orális glükózterhelésére reagálva [14]. Alig 56 óra elteltével az LCD-n a vércukorszint és a plazma inzulinkoncentráció/idő görbe alatti 90 perces terület kétszeresére, illetve 1,25-szeresére nőtt az orális glükóz tolerancia teszt során [14].
A piruvát-dehidrogenáz kináz (PDK) aktivitása az LCD hat napja alatt. a Jelentősen eltér a 0. naptól. b Jelentősen eltér az 1. naptól. Adaptálva Peters et al. [12,13].
Ez a megnövekedett PDK4 fehérje és PDK aktivitás várhatóan a komplexet rezisztenssé teszi az edzés közbeni aktiválódással szemben, amint azt Putman és mtsai. [11] két okból: 1) a PDH komplex fokozott többhelyi foszforilációja és/vagy 2) a komplex csökkent érzékenysége a piruváttal történő szabályozásra. A megnövekedett PDK-aktivitás várhatóan fokozza az E1 alegység több helyen történő foszforilációját, és ellenállóbbá teszi a komplexet a foszfatáz általi defoszforilezéssel és aktiválódással szemben [6]. Normális táplálkozási körülmények között az emberi vázizomzatban az uralkodó izoform a PDK2, amelynek nagyobb az affinitása az E1 alegység 1. helyének (az inaktiváló hely) foszforilációjához [15-17]. Azonban a PDK4 izoform populációjának növekedésével fokozódik a 2. (gát) hely foszforilációja, mivel ennek az izoformának nagyobb az affinitása az 1. és a 2. helyhez egyaránt [15-17]. Valamint a PDK2 nagyobb érzékenységet mutat a piruváttal történő inaktiválódásra, mint a PDK4 [18]. Így a megnövekedett glikolitikus fluxussal járó testmozgás kezdetén a megnövekedett PDK4 fehérje szint a komplexet ellenállóbbá tenné az aktivációval szemben a megnövekedett PDK4 kináz aktivitás miatt, még az izom piruvát koncentrációjának megemelkedése esetén is [19].
A Putman-vizsgálat zavaró tényezője volt, hogy az alanyok mindkét diétás beavatkozás előtt intenzív glikogéncsökkentő testmozgási protokollokon mentek keresztül, így a vázizom-glikogén és a glikogén-felhasználás kezdeti szintje az LCD-t követően jelentősen alacsonyabb volt [11]. Egy későbbi vizsgálat során az alanyokat arra kérték, hogy tartózkodjanak az intenzív testmozgástól a vizsgálat során, és egy LCD-t (
3% szénhidrátot) kevert étrendhez (
55–60% szénhidrát) magas szénhidráttartalmú étrend helyett [20]. Az alanyok minden 6 napos diétás beavatkozást 30 perces gyakorlással követtek, kissé alacsonyabb terhelés mellett (65% VO2max). A vizsgálat célja az volt, hogy a két vizsgálat között a lehető legszorosabban illeszkedjen a glikogén felhasználáshoz az edzés során. Bár a vázizomzat kezdeti glikogén koncentrációja még mindig nem volt
Az LCD-ben 50% -kal alacsonyabb volt a vegyes étrendhez képest, a vázizom glikogén-felhasználása és a piruvát-felhalmozódás mindkét vizsgálatban hasonló volt a 30 perces testmozgás során. A Putman-tanulmányban [11] megfigyelt, a testmozgás kezdetén tapasztalt csillapított PDHa-aktivációval ellentétben ezek a szerzők megfigyelték, hogy a testmozgás során történő aktiválás azonos volt a két feltétel között. Így annak ellenére, hogy a PDK-aktivitás és a PDK4 izoform várhatóan hasonló mértékben növekedni fog, mint a korábbi vizsgálatok [13], ezeket a hatásokat felülbírálták, ha a kezdeti izom-glikogénszint magasabb volt, és a glikolitikus piruvát-fluxus fennmaradt [20]. . Ezekből a tanulmányokból egyértelműen kiderül, hogy a testmozgás intenzitása és időtartama szerepet játszik az LCD-t követő testmozgás során megfigyelt szabályozási változásokban. Az edzés intenzitásának növekedésével növekszik az izom- és májglikogenolízis, valamint az izom szénhidrát-oxidáció iránti igény. Ezeket a raktárakat nem lehet teljesen feltölteni nagyon alacsony szénhidráttartalmú étrendet követően, ezért intenzív testmozgás során a glikogenolitikus fluxus és a PDH aktiválása csökken az LCD-t követően.
Az alacsony szénhidráttartalmú étrend zsírsavösszetételének hatása
A jelen áttekintésben bemutatott tanulmányok azt mutatják, hogy az LCD-k csökkentik a PDH aktiválódását a vázizomban nyugalmi állapotban és edzés közben, fokozott PDK-aktivitás és izoform-expresszió révén. Azonban nem minden LCD jön létre egyformán, és egyre nagyobb az érdeklődés az elfogyasztott zsírsavak összetétele iránt. Nemrégiben bebizonyosodott, hogy csak a helyettesítés
Az LCD-ben lévő zsír 12% -a (
A piruvat-dehidrogenáz kináz (PDK) aktivitása három napos LCD előtt és után n3 zsírsavval és anélkül. a Lényegesen különbözik az étrend-előkészítéstől b Jelentősen eltér az LCD utáni étrendtől. Adaptálva Turvey et al. [21].
A szénhidrát újratáplálásának hatása alacsony szénhidráttartalmú étrend után
Emberben kevés információ áll rendelkezésre arról, hogy a PDK-aktivitás és a PDK4 fehérje LCD-adaptált növekedése milyen gyorsan fordulhat vissza szénhidrát-újratáplálással. A legtöbb újratáplálási vizsgálat zavargásként használta az elhúzódó böjtöt, és nagyon kevés munkát végeztek az emberi vázizmokon. Rágcsálóknál a szívizom korai tanulmányai azt mutatták, hogy a 6 órás éhezést követő újratáplálás helyreállította a PDHa aktivitását
A normál szint 75% -a 1-2 óra alatt. Az éhezési periódus időtartamának növekedésével azonban az újratáplálásra adott válasz időtartama hosszabb volt, oly módon, hogy 48 órás éhezés után a PDHa aktivitás csak
A kontrollértékek 25% -a 4 óra elteltével [24]. Későbbi rágcsáló vizsgálatokban a PDH komplex aktiválódásával szembeni növekvő rezisztencia megnövekedett PDK aktivitással járt, amely korrelált a gyors vagy magas zsírtartalmú diéta időtartamával [25,26]. 48 órás éhezést és újratáplálást követően a PDK aktivitás és a PDK4 fehérje csökkent a vázizomzatban
50–60% az újratáplálás körülbelül 4 órájában [27]. Keveset tudunk azonban a PDK aktivitás időbeli változásáról és a PDK izoform expresszióról az LCD vázát követően az emberi vázizomban.
A zsír oxidációjának szabályozása alacsony szénhidráttartalmú étrenddel
Kevés információ van a vázizom adaptációjáról a "kövér oldalon" az LCD-hez. Az emberi vázizomzatban a legtöbb tanulmány a zsír oxidációjában szerepet játszó releváns enzimek génexpressziójára vagy mRNS-koncentrációjára korlátozza a mérését, és nagyon kevesen mérik az enzimaktivitás vagy a fehérjekoncentráció fiziológiailag relevánsabb koncentrációit. Mégis vannak bizonyítékok az emberi vázizomzatban számos szabályozó enzim és fehérje fokozott aktivitására a vázizom zsírsavfelvételében és oxidációjában a magas zsírtartalmú étrend vagy az LCD után. A legfontosabb lépések magukban foglalják a zsírsavak izomba juttatását az izom lipoprotein lipáz (LPL), a szarkolemmális zsírsav transzporterek és a plazma membrán zsírsavat kötő fehérjék (FAT/CD26 és FABPpm), mitokondriális felvétel és oxidáció karnitin-palmitoil-transzferáz I (CPT I) révén ), zsírsav-béta-oxidáció (marker enzim β-hidroxi-acil-CoA dehidrogenáz (β-HAD)) és általános oxidációs képesség (marker enzim-citrát-szintáz (CS)).
A magas zsírtartalmú négyhetes alkalmazkodásra (
62% zsírtartalmú) mérsékelt LCD (
20% CHO), a vázizomzat LPL-aktivitása csaknem kétszeresére nőtt, növelve az izom zsírsav-hozzáférhetőségét és jelentősen növelve az intramuszkuláris triglicerid-tartalmat [30]. Az izomzsírsavfelvételt tekintve bizonyíték van arra, hogy a FAT/CD36 fehérje és az mRNS mérsékelten (1,25-szeresére) növekedett csak 5 nap után mérsékelt LCD-n (20% CHO), miközben a FABPpm génexpresszió és fehérjetartalom a diéta által [31]. Általánosságban elmondható, hogy a zsírsavak és a nagyon kis sűrűségű lipoprotein trigliceridek izomfelvétele, valamint a plazma zsírsav oxidációja nagyobb volt a testmozgás során a zsírban gazdag LCD-t (21% CHO) követően, amikor a testedzést az étrend zavarával kombinálták [32].
Humán vizsgálatokban az LCD nem befolyásolja a vázizom CPT I-t. Ezt a maximális enzimaktivitás szintjén bizonyították egy 6 napos LCD után (
- A nagyon alacsony szénhidráttartalmú étrend anyagcsere hatása az emberi anyagcsere rosszul megértett gazembereinek
- Metabolikus üzemanyagok és elhízás Szénhidrát és lipid anyagcsere a csontváz izom- és zsírszövetében
- Tudomány a Dukan-diéta mögött Ketózis, szénhidrát-korlátozás és anyagcsere-hatások; Dukan diéta
- 2. rész Az alacsony szénhidráttartalmú ketogén étrend gátolhatja-e a rákot Kísérlet
- Különböző magas zsírtartalmú étrendek hosszú távú alkalmazásának anyagcsere- és herehatásai