Az alkoholmentes zsírmájbetegség a túlzott kalóriabevitelhez kapcsolódik, nem pedig jellegzetes étrendhez
Malte H. Wehmeyer
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Birgit-Christiane Zyriax
b Prevenciós Orvostudomány, Általános és Intervencionális Kardiológiai Osztály, Hamburg University University Heart Center, Hamburg, Németország.
Bettina Jagemann
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Ewgenia Roth
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Eberhard Windler
b Prevenciós Orvostudomány, Általános és Intervencionális Kardiológiai Osztály, Hamburg University University Heart Center, Hamburg, Németország.
Julian Schulze zur Wiesch
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Ansgar W. Lohse
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Johannes Kluwe
a I. Orvostudományi Intézet, University-Medical Center Hamburg-Eppendorf, Hamburg, Németország
Társított adatok
Absztrakt
Célul tűztük ki az alkoholmentes zsírmájbetegséghez (NAFLD) kapcsolódó étrendi szokások és az étrendi beavatkozások hatékonyságának értékelését valós körülmények között egy észak-németországi felsőoktatási központban.
A klinikai és laboratóriumi adatokat, valamint a NAFLD-vel diagnosztizált 55 egymást követő beteg szemikvantitatív táplálék-gyakorisági kérdőívével nyert adatokat egyváltozós elemzéssel hasonlítottuk össze 88 egészséges egyén életkorával és nemével egyező csoporttal. Az étrendi beavatkozás hatékonyságát 24 NAFLD betegből álló alcsoportban értékelték 6 hónappal az étkezési tanácsadás után. Az étrend makrotáplálkozási összetevőit normalizálták az abszolút napi energiafogyasztáshoz.
A NAFLD betegek naponta több kalóriát fogyasztottak az egészséges kontrollokhoz képest (P Kulcsszavak: etiológia, NAFLD, NASH, kockázat, terápia
1. Bemutatkozás
Vizsgálatunk elsődleges célja annak a hipotézisnek a tesztelése volt, miszerint a NAFLD-ben szenvedő betegek az egészséges alanyokhoz képest megkülönböztető, betegségspecifikus tápanyag-összetételű étrendet fogyasztanak. A betegek egy alcsoportjában elemeztük, hogy az étrendi tanácsadás a tápanyag-összetétel megváltozásához vezet-e, és hogy ez súlycsökkenéssel és a májfunkciós tesztek javulásával jár-e.
2. Betegek és módszerek
2.1. Vizsgálati populáció
Vizsgálatunkba bekerültek mindazok a betegek, akiknél a Hamburgi Egyetem Orvosi Központ hepatológiai ambulanciáján a NAFLD gyanúja merült fel és akik 2012 januárjától 2014 januárjáig diétás tanácsadást kaptak (N = 61). A NAFLD-t a következőképpen határozták meg: emelkedett alanin-transzamináz-szint (ALT; a normál felső határa, ULN: 50 U/L a férfiaknál, 35 U/L a nőknél), máj steatosis az ultrahangvizsgálat során, és a kísérő májbetegségek kizárása (részletek az egyidejű májbetegségek kizárásáról a kiegészítő anyagban találhatunk) vagy a túlzott alkoholfogyasztás (férfiaknál> 40 g/nap, nőknél> 20 g/nap).
A kontrollokhoz a nem és az életkornak megfelelő egészséges kontrollcsoport névtelen adatait a „Stressz, ateroszklerózis és EKG-vizsgálat” (STRATEGY) keresztmetszet német kohorszából nyertük, amely már egészséges férfiakat és nőket toborzott. [16] Hat NAFLD 25 évnél fiatalabb beteget kizártak az elemzés előtt, mivel a STRATEGY vizsgálatban nem volt elég sok összehasonlítható fiatal kontroll. Összesen 55 NAFLD beteget és 88 kontrollt vontak be a végső elemzésbe.
2.2. A vizsgálati populáció táplálkozási, klinikai, laboratóriumi és technikai értékelése
Valamennyi NAFLD beteg alapos klinikai vizsgálatot, rutin laboratóriumi vizsgálatokat, a has felső részének ultrahangvizsgálatát, a máj átmeneti elasztográfiáját (Fibroscan; Echosense, Párizs, Franciaország) és bioelektromos impedancia elemzést (BIA; BIA 101 Anniversary; SMT medical) kapta., Würzburg, Németország), mielőtt mélyreható étkezési tanácsadást kapna. [17,18] A fibrózist Kleiner szerint F0-tól F4-ig osztályoztuk [19], és a tranziens elasztográfia eredményeit a fibrózis fokozataihoz rendeltük, Wong és mtsai. [20] Ezért F2 fibrózist feltételeztek 7,0-8,6 kPa-os betegeknél, F3-ot 8,7-10,2 kPa-os betegeknél, és F4 fibrózist ≥10,3 kPa-os betegeknél. Valamennyi beteg egy validált szemikvantitatív táplálék-gyakorisági kérdőívet (FFQ) töltött ki, amelyet az „Európai rákkutatásra vonatkozó jövőbeli kutatás” (EPIC) vizsgálatában használtak. [21] Az FFQ által kapott adatokat ezt követően egy táplálkozási szakember hitelesítette. Az étrendi tanácsadással és az FFQ érvényesítésével kapcsolatos részletek a Kiegészítő anyagban találhatók. Az Egyesült Államok Egészségügyi és Humánügyi Minisztériuma és az Egyesült Államok Mezőgazdasági Minisztériuma szerint az összes NAFLD-beteg életmódbeli viselkedését mozgásszegény, alacsony aktivitású vagy aktív életmód szerint osztályozták. [22]
2.3. Statisztikai analízis
A NAFLD betegek táplálkozási, klinikai, antropometriai, laboratóriumi és BIA adatait egyváltozós analízissel hasonlítottuk össze az egészséges kontrollok adataival. A kategorikus változókat Fisher-pontos teszttel, a folytonos változókat pedig t-próbával (feltételezett Gauss-eloszlású változók esetén, pl. Életkor) vagy Mann – Whitney U-próbával (nem normálisan elosztott változók) elemeztük. Az FFQ által kapott táplálkozási adatokat 1000 kcal kalóriabevitelre normalizálták. A statisztikai elemzéseket az SPSS 22. verziójával (IBM Corporation, New York, NY) végeztük, a grafikonokat pedig a GraphPadPrism 4 (GraphPad Software Inc., La Jolla, CA) segítségével készítettük. A tanulmányt a helyi etikai bizottság hagyta jóvá (Ethikkommission der Ärztekammer Hamburg, PV4357).
3. Eredmények
3.1. A klinikai, laboratóriumi és táplálkozási adatok összehasonlítása a NAFLD betegek és a kontrollok között
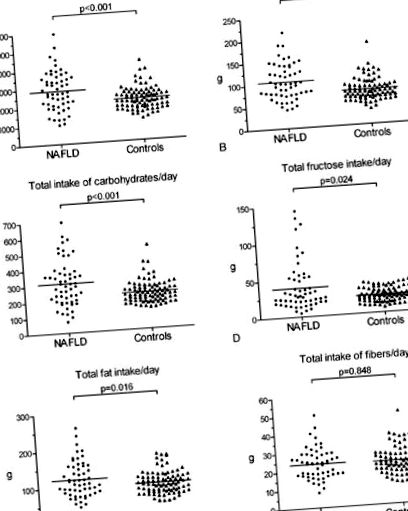
A 143 NAFLD beteg és kontroll részleteit az 1. táblázatban mutatjuk be. 1. Az átlagos testtömeg, a testtömeg-index (BMI), a derék kerülete, a zsírtömeg, az alanin-aminotranszferáz (ALT), az aszpartát-transzamináz (AST) és a gamma-glutamil-transzpeptidáz (γGT) szintje szignifikánsan magasabb volt a NAFLD betegeknél a kontrollokhoz képest ( P 1A, 1 A ábra, 2. kiegészítő táblázat). A napi teljes zsírfogyasztás mediánja 109 g (46–260) volt a NAFLD csoportban és 97 g (50–180) a kontroll csoportban (P = 0,016). Az elfogyasztott szénhidrátok és fehérjék napi mennyisége a NAFLD csoportban 293 g (68–697) és 100 g (41–216) volt, szemben a kontroll 222 g (137–529) és 74 g (36–185) értékével. csoport (P 1., 1. ábra, 2. kiegészítő táblázat).
Diétás szokások a NAFLD betegeknél és az egészséges kontrollok. A függőleges sávok a mediánt jelentik. NAFLD, alkoholmentes zsírmájbetegség.
3.2. A NAFLD betegek étrendjének összetétele és a kontrollok összehasonlítása
A NAFLD csoportban a kontroll csoporthoz viszonyítva 1000 kcal/8,6 (3,6–14,4) vs. 10,4 (6,9–15,2); P 2E) 2 E rostbevitel és 1000 kcal/7,3 ásványi tápanyagmennyiség (4,2–10,7) vs. 7,7 (6,0–10,5); P ábra 2D) 2 D) szignifikánsan alacsonyabb volt. A NAFLD-betegeknél azonban magasabb volt a fehérjebevitel 1000 kcal-ra (36,1 (27,6–56,2) vs. 34,8 (24,8–56,0); P = 0,009; 2B ábra) 2 B) és a glükóz 1000 kcal-ra az egészséges kontrollokkal (8,8 (2,9–41,1) vs. 7,7 (3,1–17,4); P = 0,041; 2. táblázat). 2). Meglepő módon nem észleltünk szignifikáns különbséget az NAFLD betegek és az egészséges kontrollok közötti relatív fruktóz bevitelben 1000 kcal/1000 kcal között (10,5 (2,9–37,4) vs. 10,3 (3,6–28,4); P = 0,353; 2. táblázat). 2). A NALFD betegek és a kontrollok nem különböztek szignifikánsan az egyéb étrendi komponensek bevitelét tekintve, ha az energiafogyasztásra normalizálták; például 1000 kcal szénhidrát (P = 0,359; 2.A ábra), 2 A), 1000 kcal zsír (P = 0,416; 2C ábra), 2 C) és szerves sav (P = 0,104; 2. ábra F). 2 F). A további étrendi komponensek eredményeit a 2. táblázat mutatja 2 .
Makrotáplálkozási étrend-összetevők NAFLD-ben szenvedő betegeknél és kontrollok. Minden pont az egyes betegek napi 1000 kcal-ra normalizált specifikus táplálék-összetevőjét jelenti. A függőleges sávok a mediánt jelentik. NAFLD, alkoholmentes zsírmájbetegség.
2. táblázat
A (makro) táplálkozási összetevők normalizálódtak a napi energiafogyasztásra (1000 kcal-ra) a NAFLD betegeknél az egészséges kontrollokhoz képest.
Néhány NAFLD-páciensünkről és kontrollcsoportunkról megállapították, hogy jellegzetes étrend-mintájuk van, egy vagy több táplálékkomponens feleslegével (2. ábra. 2. ábra). Részletesen 5 NAFLD páciens 140 g/1000 kcal/nap szénhidrátfogyasztást mutatott túlzottan, míg a kontrollcsoportból senki sem haladta meg ezt a szintet. A fehérje esetében 2 NAFLD-betegnél és 1 egészséges kontrollnál napi 50 g/1000 kcal-nál nagyobb bevitelt figyeltek meg, míg 5 NAFLD-betegnél túlzott zsírfogyasztást (> 55 g/1000 kcal/nap) és csak 1 a kezelőszervekből. A túlzott zsír- és fehérjefogyasztással talált NAFLD-betegek közül csak egy esett egyszerre mindkét kategóriába.
3.3. Az étrendi beavatkozás hatékonyságának értékelése a NAFLD betegeknél
Összesen 24 beteg (16 férfi és 8 nő, átlagéletkor 46,2 év, SD = 11,7) teljesítette a második FFQ-t 6 hónappal az első diétás tanácsadás után. Ezen betegek egyike sem szenvedett diabetes mellitusban, 8 beteg magas vérnyomásban szenvedett, 20 beteg pedig hyperlipoproteinémiában szenvedett. A kiindulási étrendi összetétel a következő volt: 43% szénhidrát (32–62% tartomány), 42% zsír (20–53%) és 15% fehérje (12–21%).
Az átlagos testsúlycsökkenés 3,4% (−2% és 11%; 3A ábra) 3 A) a teljes csoport kiindulási testtömegéből, míg 9 beteg (37,5%) ≥5 % és 2 beteg (8,3%) ≥7% -os súlycsökkenést ért el.
A medián testtömeg és az alanin-transzamináz szintek az étrend-tanácsadás előtt és után. Huszonnégy beteg vett részt utólátogatáson. Minden sor 1 beteg menetét jelöli.
Az egyváltozós elemzések nem mutattak statisztikailag szignifikáns különbséget a legalább 5% -os testsúlycsökkenést elért NAFLD-betegek és a fogyást szenvedő betegek között, 4A ábra 4A) és alacsonyabb szénhidrátfogyasztás felé irányultak (medián 104,3 g/1000 kcal (77,8–151,8) vs. 99,2 g/1000 kcal (73,9–119,3); P = 0,059; 4B ábra) 4 B) összehasonlítva a kiindulási étrenddel. Nem volt különbség az 1000 kcal/nap fehérjefogyasztásban (medián 36,8 g (28,8–50,4) vs. 36,9 g (25,6–46,0); P = 0,862; 4C. Ábra), 4 C), de lényegesen nagyobb rostfogyasztás 1000 kcal-onként (medián 9,2 g (4,6–14,4) vs. 10,7 g (7,2–15,8); P = 0,002; 4D ábra) 4 D) és 1000 kcal zsír (medián 44,6 g) (21,1–57,0) vs. 47,2 g (36,5–58,8); P = 0,024; 4. ábra E) 4 E) a nyomon követés során találtunk. Fontos, hogy 1000 kcal glükóz fogyasztása (medián 8,7 g (3,9–41,1) vs. 7,7 g (3,2–11,4); P = 0,341) és fruktóz/1000 kcal (medián 9,6 g (4,9–36,9) és 10,1 g) fogyasztása (3,9–16,3); P = 0,846) nem különbözött a kiindulási értéktől és a követéstől. A napi 2 szénhidrátfogyasztással (151,8 g szénhidrát/1000 kcal/nap) vagy fehérjékkel (50,4 g fehérje/1000 kcal/nap) elfogyasztott 2 betegnél kiegyensúlyozottabb étrendet sikerült elérni a nyomon követés során (ábra. Az étrendi összetétel 6 hónap után a következő volt: 41% szénhidrát (30–49% tartományban), 44% zsír (34–55%) és 15% fehérje (10–19%) ).
A teljes energiafelvétel és a táplálkozási szokások a diéta előtti és utáni tanácsadás során. Huszonnégy beteg vett részt utólátogatáson. A tápanyag-összetevőket minden beteg napi 1000 kcal-ra normalizálták. Minden sor 1 beteg menetét jelöli.
Az ALT szintek a követés során szignifikánsan alacsonyabbak voltak a kiindulási értékekhez képest (medián 75 U/L (36–263) vs. 45,5 U/L (24–237); P 3B ábra) 3 B) és egy normalizációval az ALT-értéket 16 férfiből 9 és 8 nőből 6 érte el. Azonban a nyomon követésre rendelkezésre álló betegek kis száma miatt nem találtunk összefüggést a testsúlycsökkenés vagy a specifikus táplálkozási összetevők csökkentése és az ALT javulása között (az adatokat nem mutatjuk be).
4. Megbeszélés
A specifikus étrendi szokásokat a NAFLD kialakulásának kiváltó okának tekintik. Így a „NAFLD kockázati étrend” dekódolása fokozottabb táplálkozási tanácsadáshoz vezethet, és ezáltal fokozhatja a terápiás beavatkozások hatását. Itt bemutatjuk a NAFLD-ben szenvedő betegek átfogó étrendi és klinikai értékelését, összehasonlítva a korábban publikált STRATEGY-tanulmány egészséges emberek jól leírt csoportjával. [16]
Míg a bevitt összes rostmennyiség összehasonlítható volt a NAFLD-ben és a kontrollban szenvedő betegek között, a NAFLD-betegeknél lényegesen alacsonyabb volt a rostfogyasztás 1000 kcal-onként a kontrollokhoz képest. Ez összhangban áll azzal a megfigyeléssel, hogy a rostokban gazdag mediterrán étrend nemcsak a cukorbetegséget, a szív- és érrendszeri betegségeket, az elhízást, hanem a NAFLD-t is megelőzheti. [14] Erre és arra a tényre tekintettel, hogy az alacsony rostbevitel hozzájárulhat a vastagbél neoplazmák megnövekedett kockázatához a NAFLD-betegeknél [24,25], az étrendi tanácsadás másik független célja a rostfogyasztás növelése lehet.
Érdekes, hogy míg a 24 betegből csak 9-nél fogyott el ≥5% súlycsökkenés az étkezési tanácsadás után 6 hónappal, mind a betegnél javult a májfunkciós tesztje, és 24 betegből 15-ben normális volt az ALT-érték a nyomon követés során. Így, még akkor is, ha a NASH szövettani javulásához szükségesnek ítélt 7–10% -os súlyvesztést [12,13] nem sikerült elérni a 6. hónapban, a betegek jelentős előnyöket élveznek az étrendi tanácsadásban. Nyilvánvaló, hogy a májfunkciós tesztek javulása megelőzi a jelentős fogyást és a szövettani javulást. [13] A betegek kicsi száma miatt azonban nem azonosítottak prediktív tényezőket a májfunkciós tesztek javítására az étrendi tanácsadás után a „valós életben” élő kohorszunkban. Adataink összhangban vannak egy korábbi tanulmánysal, amely bizonyítja, hogy az alacsony szénhidráttartalmú és a csökkentett lipidtartalmú étrend egyaránt hatékonyan csökkentette a májzsírt. [26] Míg megfigyelési tanulmányunk a szérum ALT-dinamikára összpontosított, mint a máj necroinflammation helyettesítő paraméterére, a különböző étrendi beavatkozásokat szövettani végpontok vagy a jövőben egy fejlettebb noninvazív betegség-súlyossági értékelés segítségével kell értékelni.
Összegzésképpen elmondható, hogy a NAFLD-ben szenvedő betegeknél a napi összes kalóriabevitel lényegesen magasabb, míg az általános étrendi összetétel csak mérsékelt eltéréseket mutat az egészséges kontrolloktól. A jövőbeni prospektív multicentrikus vizsgálatoknak ki kell értékelniük, hogy az étrendi tanácsadás a NAFLD-betegek egyszerű tanulási céljára („kevesebbet fogyasszon”) összpontosítson, nem pedig a relatív tápanyag-fogyasztás specifikus változásaira.
- Az alkoholmentes zsírmájbetegség a túlzott kalóriabevitelhez kapcsolódik, nem pedig a
- Az Opisthorchis viverrini fertőzés növeli az alkoholmentes zsírmáj betegség súlyosságát
- A testmozgás szerepe a gyermek alkoholmentes zsírmájbetegségének cukorbetegségének enyhítésében
- A nem alkoholos zsírmájbetegség és a májrák-kúra gyógyulásának visszafordítása ma
- Alkoholmentes zsírmáj betegség