A fókuszos zsírtartalom dinamikus változása alkoholmentes zsírmájbetegségben a szitagliptinnel végzett kezelés után
Bevezetés
Az alkoholmentes zsírmájbetegséget (NAFLD) a metabolikus szindróma májmegnyilvánulásának tekintik, és inzulinrezisztenciával, 2-es típusú cukorbetegséggel, elhízással, magas vérnyomással és diszlipidémiával társul (T. Fukuhara et al. Hepatogastroenterology 2014; 61: 323 –328).
A máj steatosisának diagnosztizálására vonatkozó jelenlegi aranystandard a máj biopsziája, hisztopatológiai értékeléssel. A zsírmáj kimutatására azonban jelenleg kevésbé invazív és nagyon pontos diagnosztikai módszereket javasolnak, beleértve a hasi ultrahangot, a CT-t és az MRI-t. A hasi ultrahang lehet a legjobb és elérhető diagnosztikai módszer a zsírmáj kezdeti diagnózisához (O.W. Hamer et al. Radiographics 2006; 26: 1637–1653).
A diagnosztikus képek alapján 3 megállapított zsírmájminta létezik (OW Hamer és mtsai. Radiographics 2006; 26: 1637–1653): i/diffúz homogén zsírmáj, ii/diffúz zsírmáj fokális zsírmegtakarítással (azaz olyan területekkel, ahol nincs zsíros máj) steatosis), és iii/gócos zsíros elváltozások egy egyébként normális májban.
Beszámoltak arról, hogy a dipeptidil-peptidáz-4 (DPP-4) inhibitor, a szitagliptin javítja vagy akár visszafordítja a máj steatosisát 2-es típusú cukorbetegségben szenvedő betegeknél (T. Fukuhara és mtsai. Hepatogastroenterology 2014; 61: 323–328).
Eset leírása
A cukorbetegség ambuláns klinikáján egy 49 éves nőt elhízással, 2 éves metforminnal kezelt 2-es típusú cukorbetegség mellitusával és hiperlipoproteinémiával, valamint artériás hipertónia 7 éves kórtörténetével értékeltek. Gyógyszerként napi 3000 mg metformint (antidiabetikus gyógyszer), 200 mg celiprololt (béta-blokkoló), 5 mg ramiprilt (angiotenzin-konvertáló enzim gátlót), 5 mg amiloridot (vizelethajtó) és 50 mg hidroklorotiazidot (vizelethajtó) tartalmazott. A páciensnek anamnézisében nem volt alkoholfogyasztása és dohányzása.
A 2-es típusú diabetes mellitus kezdeti diagnózisával kezdve rendszeres éves hasi ultrahangvizsgálata, amelyet ugyanaz a szonológus végzett, súlyos diffúz homogén máj steatózist tárt fel (A. J. Sanyal. Gastroenterology 2002; 123: 1705–1725). A páciensnek korábban nem volt vagy volt más májbetegsége, például alkoholos zsírmájbetegség, gyógyszer által kiváltott májbetegség, krónikus vírusos hepatitis B vagy C, autoimmun hepatitis, primer biliaris cirrhosis, szklerotizáló cholangitis, Wilson-kór, hemochromatosis, α-1 -antitripszin-hiány. A máj vérvizsgálata ismételten a normális tartományba esett. Ezzel a klinikai kerettel nagyon valószínű volt az alkoholmentes zsírmájbetegség diagnózisa.
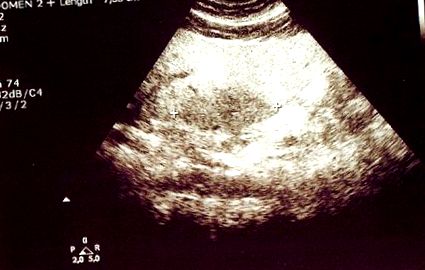
2012 májusában, a rossz cukorbetegség kompenzáció miatt, napi 100 mg szitagliptint (DPP-4 gátló) adtak a fent említett gyógyszerekhez. 2013 áprilisában (tizenegy hónappal a szitagliptin megkezdése után) egy rutinszerű éves hasi ultrahangvizsgálat a 2. májszegmensben egy hipoechoikus, földrajzilag konfigurált 7,55 cm nagyságú elváltozást mutatott rosszul körülhatárolt peremekkel és B-módban nem foglalt helyet (1. ábra). ). A normál vaszkularizációt színes Doppler ultrahangvizsgálattal detektáltuk. Ez a megállapítás nagyon gyanús volt a fokális zsírmegtakarítás (FFS) szempontjából, azaz e. csökkent zsírtartalom meghatározott májterületeken. Az FFS diagnózisát mágneses rezonancia képalkotással erősítették meg, mivel a beteg elutasította a májbiopsziát.
A B-módú vizsgálatban a transzabdominális USA a máj 2-es szegmensében hipoechoikus, földrajzilag konfigurált elváltozást (keresztek között) mutat, rosszul körülhatárolt margókkal, és nem foglal helyet. Az elváltozás maximális átmérője 7,55 cm.
15 hónappal a szitagliptin-kezelés megkezdése után a beteg elutasította a szitagliptin-kezelés folytatását. Meglepő módon 16 hónappal a szitagliptin abbahagyása után az FFS maximális átmérőjének csökkenését (7,55 cm-ről 3,51 cm-re) észlelték (2. ábra). Az összes szonográfiai értékelést ugyanaz a nagyon tapasztalt szonológus végezte el, Phillips HD XE 11 ultrahangrendszerrel, 2–5 MHz konvex átalakítóval.
A B-módú vizsgálatban a transzabdominális US a 2. májszegmensben ugyanazt a sérülést (keresztek között) mutatja, a maximális átmérő 3,51 cm-re csökkenésével.
A beteg étrend-megfelelősége továbbra is nagyon rossz volt, életmódja hipokinetikus volt. A leírt időszakban (2012. május és 2015. január között) súlygyarapodást szenvedett 82-ről 84,9 kg-ra, BMI-je 34,1-ről 35,3 kg/m 2 -re, HbA1c-értéke 46-ról 59 mmol/mol-ra emelkedett, homeosztatikus modellértékelés - inzulinrezisztencia (HOMA-IR) pontszám 1,24-ről 6,39 mU · mmol/l 2-re emelkedett. A májvizsgálatok a normális tartományban voltak a szitagliptinnel végzett kezelés alatt, valamint később.
Vita
Az FFS gyakran előforduló állapot, amely tipikusan a 2., 4. és 5. májszegmensben helyezkedik el (azaz a ligamentum falciforme vagy ligamentum venosum szomszédságában, az epehólyag fossa és a porta hepatis területén). A fókuszos zsírmegtakarítás kialakulásának mechanizmusai a steatotikus májban beszámoltak aberrált vénás keringésről (különösen a bal gyomor- vagy epehólyag-vénák rendellenes lefolyásáról), arterioportális shunt-okról és a portális perfúzió csökkenéséről a fent említett májban szegmensek, ami a tápanyagszint lokalizált hígításához vezet az FFS-be áramló vérben (L. Liu et al. J Ultrasound Med 2008; 27: 387–394).
Betegünknél új FFS-t találtunk a korábban diffúz homogén zsírmájban a szitagliptin beadása után. Feltételezzük, hogy ez a megállapítás az FFS „demasking” -jéből származik diffúz homogén máj steatosisban olyan egyénnél, akinek valószínűleg rendellenes vénás májkeringése van. Mivel a szitagliptinnel végzett kezelésről ismert, hogy csökkenti a májsejtek zsírtartalmát, és hogy a hatás gyorsan felléphet olyan területeken, ahol a portális perfúzió csökken, azaz például csökkent belekből származó tápanyagellátással.
Wu és mtsai. (S. Wu és mtsai. J Ultrasound Med 2013; 32: 1695–1702) dokumentálták, hogy az alkoholmentes máj steatosisban gyakran találkoznak FFS-sel (kb. 19,2% -ban), és hogy az FFS zsíros májváltozásokkal változhat az idők során. Ugyanezek a szerzők (S. Wu és mtsai. J Ultrasound Med 2014; 33: 1447–1452) hasi ultrahang vizsgálatokkal 301 diffúz homogén NAFLD-s beteget követtek 3 év alatt, és nem találtak új FFS-t. Ennek a tanulmánynak azonban olyan megfigyelési tervezése volt, amelyben diétát, testmozgást, súlycsökkentést vagy farmakológiai beavatkozást nem hajtottak végre.
Betegünknél tett megfigyeléseket farmakológiai beavatkozás után találtuk meg. Mint ilyen, a szitagliptinnel végzett kezelés az egyetlen ésszerű magyarázat a páciensünk steatosisának fokális csökkenésére. A máj steatosis fokális regressziójára gyakorolt egyéb hatások, mint a súlycsökkentés, a testmozgás, a jobb cukorbetegség kompenzáció vagy az inzulinrezisztencia javulása, teljes mértékben kizárhatók pácienseinknél. Sőt, a szitagliptin abbahagyása után 16 hónappal az FFS maximális átmérőjének csökkenését figyeltük meg. Ez a megfigyelés tovább támasztja alá hipotézisünket.
Egyre növekvő bizonyítékok utalnak az inkretin-alapú terápiák, különösen a (DPP-4) inhibitorok lehetséges hatékonyságára a máj steatosisának csökkentésében. Tudomásunk szerint ez az első jelentés arról, hogy FFS megjelenhet a NAFLD klinikai lefolyásában, különösen a szitagliptinnel végzett kezelés után. Ezek a megállapítások kihívást jelenthetnek az ultrahangvizsgálatok számára. A DPP-4 inhibitorok széles körű alkalmazásával azonban ennek a kihívásnak meg kell felelnie.
I. Hoffmanová, P. Škrha, A. Šedo, M. Anděl; Cseh Köztársaság
Elismerés
A cikket a Cseh Köztársaság Egészségügyi Minisztériumának belső támogatási ügynökségének NT12407-4/2011 projektje támogatta.
- Határok kockázat-előrejelzése alkoholmentes zsírmájbetegségre biokémiai és étrendi alapján
- A kolin anyagcseréje új betekintést nyújt az alkoholmentes zsírmáj betegségbe és annak
- A glutation hatékonysága a nem alkoholos zsírmájbetegségek kezelésében nyílt,
- A fizikai aktivitás hatása a májfunkcióra alkoholmentes zsírmájbetegségben szenvedő betegeknél
- Az étrendi kapszaicin és az antibiotikumok szinergikusan hatnak az alkoholmentes zsírmájbetegségek csökkentésére