A kolin anyagcseréje új betekintést nyújt az alkoholmentes zsírmáj betegségbe és annak előrehaladásába
Absztrakt
A felülvizsgálat célja
A kolin nélkülözhetetlen tápanyag, a máj pedig a kolin anyagcseréjéért felelős központi szerv. Hepatosteatosis és májsejtek pusztulása akkor fordul elő, ha az embereket megfosztják a kolintól. Az elmúlt években jelentős előrelépés történt az emberi kolinigényt befolyásoló mechanizmusok megértésében és a kolin májfunkcióra gyakorolt hatásának megértésében. Ezek az előrelépések hasznosak annak tisztázásában, hogy miért nem alkoholos zsírmájbetegség (NAFLD) fordul elő, és néha hepatocarcinogenezissé fejlődik-e.
Legfrissebb megállapítások
Az alacsony kolintartalmú étrendet fogyasztó embereknél zsírmáj és májkárosodás alakul ki,. A kolin ezen étrendi igényét az ösztrogén és az egyes nukleotid polimorfizmusok (SNP) modulálják a kolin és a folát metabolizmusának specifikus génjeiben. A kolin májra gyakorolt hatásainak spektruma a steatosistól a hepatocarcinomák kialakulásáig terjed, és ezeknek a hatásoknak számos mechanizmusát azonosították. Ezek közé tartozik a rendellenes foszfolipid szintézis, a lipoprotein szekréció hibái, a mitokondriális diszfunkció által okozott oxidatív károsodás és az endoplazmatikus retikulum (ER) stressz. Ezen túlmenően, a máj steatosis fenotípusa, metabolomikus aláírásokkal teljesebben jellemezhető, és a bél mikrobiomja befolyásolja. Fontos, hogy a májműködés, az egy szén-dioxid-anyagcsere és az energia-anyagcsere közötti bonyolult kapcsolat még csak most derül ki.
Összegzés
A kolin befolyásolja a máj működését, és ennek a tápanyagnak az étrendigénye az egyén genotípusától és az ösztrogén állapotától függően változik. Ezeknek az egyéni különbségeknek a megértése fontos a gasztroenterológusok számára, akik meg akarják érteni, miért alakul ki egyes személyeknél a NAFLD, másoknál nem, és miért tolerálják egyes betegek a teljes parenterális táplálkozást, másoknál májműködési zavarok.
Bevezetés
A cikk elsődleges célja a kolin metabolizmusnak a normális májműködés fenntartásában, az alkoholmentes zsírmájbetegség (NAFLD) kialakulásában és a hepatocarcinogenezisben betöltött szerepének új megismerése lesz. A közelmúltbeli felfedezések, amelyek szerint a kolin táplálékigénye jelentősen eltér az egyéneknél a genetika [1, 2], a nem [3] és a mikrobiom összetétel [4] miatt, megkönnyíti a kolin klinikai következményeinek mérlegelését a gasztroenterológusok által kezelt betegségekben. Ez az áttekintés a kolin májban játszott jelentőségének legújabb fejleményeire összpontosít.
Kolinbiológia
A kolin a sejt- és mitokondriális membránok, valamint az acetilkolin neurotranszmitter alkotóeleme. Tekintettel a sejtkomponensekbe és útvonalakba való lényegében mindenütt bekerülésre, nem meglepő, hogy ez a tápanyag különféle folyamatokat befolyásol, például a lipid-anyagcserét [5], a lipid másodlagos hírvivőkön keresztül [6], a molekulák metilációtól függő bioszintézisét (beleértve a gén epigenetikus szabályozását is). expresszió) [7–9], a nukleáris receptorok aktiválása [10, 11], az epe és a koleszterin enterohepatikus keringése [12], a plazmamembrán fluiditása [13] és a mitokondriális bioenergetikumok [14].
A kolin két fő sorsát foszforilezni kell, és foszfolipidek előállítására kell felhasználni, vagy oxidálni kell, és metilcsoportok donorként kell felhasználni. Különösen fontos kolinmetabolit a májban a foszfatidilkolin, amely szükséges a trigliceridek csomagolásához és exportálásához nagyon kis sűrűségű lipoproteinben (VLDL) [15], valamint az epesók sóinak szekrécióhoz való szolubilizációjához [16]. A trigliceridek Aberrant VLDL által közvetített szekréciója a máj steatosisának központi mechanizmusa [17]. Az epe homeosztázisának szerepe a máj fiziológiájában szintén elég nyilvánvaló, és többnyire az epekövek, a fibrózis és a hepatocarcinoma okaira vonatkozik [18]. Az epesóknak tulajdonított új funkciók, köztük az energia és a glükóz metabolizmus szabályozása [19–21], valószínűsíti, hogy a foszfatidilkolin szerepet játszik ezeknek a funkcióknak a modulálásában is.
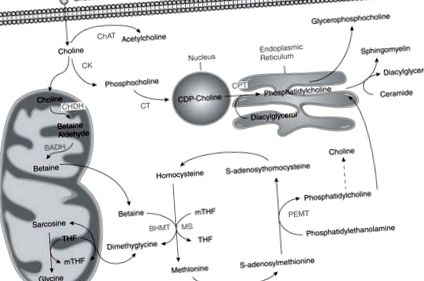
A kolin, a folát és a metionin metabolizmusa összefügg egymással, mivel ezek mindegyike befolyásolja az S-adenozil-metionin, a metilcsoportok univerzális donora biológiai reakciókban történő termelését [5] (1. ábra). Az egyik tápanyag hiánya összefüggésben áll a többi tápanyag fluxusának növekedésével a metiladományozás felé [5].
E három tápanyag metabolizmusának útja keresztezi a metionin homociszteinből történő képződését.
BADH = betain-aldehid-dehidrogenáz; BHMT = betain-homocisztein-metil-transzferáz; ChAT = kolin-acetil-transzferáz; CHDH = kolin-dehidrogenáz; CK = kolin-kináz; CPT = kolin-foszfotranszferáz; CT = CTP: foszfolin-citidil-transzferáz; MS = metionin-szintáz; mTHF = metil-tetrahidrofolát; PEMT = foszfatidil-etanol-amin-N-metil-transzferáz; THF = tetrahidrofolát
Feladó: Jelenlegi ismeretek a táplálkozás 10. kötetében, engedéllyel.
Egyéni kolin követelmények
A NAFLD progresszióját az egyszerű steatosisból a hepatocarcinomába többszörös kolinmediált mechanizmusok befolyásolják.
A kolinhoz kapcsolódó gének deléciójával számos egérmodell betekintést engedett a NAFLD mechanizmusaiba. Számos egérmodellben a kolin metildonorként történő felhasználásához szükséges gének törlése (Bhmt [33], Chdh [34]), a kolin-rész endogén formálásához szükséges gének törlése (Pemt [35]) vagy az ahhoz szükséges gének törlése hogy az S-adenozil-metionin (Mat1 [36]) zsírmájat eredményezzen. Emberben a PEMT-ben előforduló polimorfizmusok [37, 38] összefüggenek a NAFLD-vel. Ezek a megfigyelések arra utalnak, hogy a kolin metiladományozási funkciója fontos a NAFLD mechanizmusában. Korábban megvitattuk azt a hipotézist, miszerint foszfatidilkolinra van szükség a máj normális VLDL-szekréciójához. A genetikai adatok arra utalnak, hogy a PEMT metilációs útjából származó foszfatidilkolin a fontos (nem pedig az előformázott kolinból származó foszfatidilkolin); egér vizsgálatok alátámasztják ezt a következtetést [39].
Bár sok minden megállapítható a betegség genetikai mechanizmusainak tanulmányozásával, a zsírmáj kontrolljának számos más fontos szintje egyidejűleg fontos lehet. A metabolizmus, különösen, ha más módszerekkel együtt alkalmazzák a fenotípus meghatározásához, továbbfejlesztette a kolin zsírmájban betöltött szerepének megértését. Azoknál az embereknél, akiknek kolinhiányos étrenden zsírmájuk alakul ki, a kiindulási anyagcsere-metabolikus profil mutatkozik meg: megváltozott kolin metabolitok, lipidek (beleértve az acilkarnitint) és aminosavak. Ez a metabolomikus profilalkotás (akkor történik, amikor az emberek normális étrendet fogyasztanak) pontosan megjósolta, hogy az alacsony kolintartalmú étrend táplálásakor melyik embernél alakul ki zsírmáj [40]. Érdekes, hogy a NAFLD betegek plazma metabolom profilja (függetlenül a NAFLD okától) azt mutatta, hogy a karnitin, a kolin metabolitok és az epesavak meg tudják különböztetni az egészséges kontrollokat a NAFLD vagy az alkoholmentes steatohepatitis eseteitől [41], ami arra utal, hogy hasonló utakról van szó. a NAFLD-ben és kolinhiányban.
A kolin fontos része a mitokondriális membránnak, a mitokondriális diszfunkció pedig központi mechanizmus a NAFLD patogenezisében [32]. Az alacsony kolinszint azért lehet fontos a NAFLD patofiziológiájában, mert zavarja a mitokondriális bioenergetikát [14] és a zsírsav-béta-oxidációt [42]. A kolinhiány megváltoztatja a mitokondriális membránok összetételét; A kardiolipin ezekben a membránokban oxidálódik, és a foszfatidil-etanol-amin és a foszfatidil-kolin membránkoncentrációja csökken [43, 44]. Ezek a membránváltozások a mitokondriális csökkent membránpotenciált eredményezik [14, 45] és a légzési lánc I komplexének csökkent aktivitását [44, 46]. A mitokondrium csökkent ATP-termelése patkányokban fordul elő kolinhiányos étrenddel [47] vagy kolin-metioninhiányos étrenddel [48]. A kolin metabolizmusában és transzportjában szerepet játszó fehérjék szintén befolyásolják a mitokondriális funkciót. A CHDH egy mitokondriális mátrixfehérje, amely katalizálja a kolin betainzá történő átalakulását. A törölt Chdh-t mutató egereknek kóros mitokondriális működése van több szövetben [34]. Érdekes módon a CHDH-t az alkohol indukálta zsírmájú patkányok mitokondriális proteomjában szabályozzák [49]. Ez kompenzációs válasz lehet, mivel a betainnak feltételezhetően májvédő hatása van [50].
Az endoplazmatikus retikulum (ER) stressz egy olyan állapot, amikor a felesleges kibontakozott fehérjék a stressz válaszainak kaszkádjához vezetnek. Ha a stressz krónikus, akkor sejthalál fordulhat elő. Úgy gondolják, hogy az ER stressz szerepet játszik a NAFLD patogenezisében [51]. A metionin-kolinhiányos étrenddel legfeljebb 21 napig táplált egerekben a máj steatosisához társult specifikus ER stressz kaszkádok indukálása a kibontakozott fehérje válasz előtt. Az integrált ER stresszválasz steatosis hiányában nem tudott májkárosodást okozni, ami arra utal, hogy összehangolt mechanizmusra van szükség a májbetegség progressziójához [52]. Egy másik összefüggést találtak a kolin, a NAFLD és az ER stressz között, amikor az elhízott, leptinhiányos egerekben végzett metabolomikus és proteomikai vizsgálatok során kiderült, hogy az elhízott fenotípust ER stressz, a lipogenezisben szerepet játszó fehérjék fokozottabb expressziója és a foszfolipid metabolizmus (beleértve a PEMT-t), és külön lipidprofil, amelyet megnövekedett egyszeresen telítetlen zsírsavak és megnövekedett foszfatidil-kolin/foszfatidil-etanol-amin koncentráció arány jellemez. Ez a megváltozott arány rontja a kalcium jelátvitelt és az ER homeosztázisát [53].
A kolin a gének epigenetikus nyomainak erős módosítója [7, 8]. Valószínűleg vannak olyan specifikus epigenetikai eredmények, amelyek a kolin nélkülözés alatt befolyásolják a NAFLD-t. A metabolikus betegség patofiziológiájában központi szerepet játszó számos gén, mint például a leptin [54] és a PPAR gamma [55], epigenetikailag szabályozott. A kolint, az epigenetikát és a NAFLD-t összekapcsoló specifikus mechanizmusok az aktív vizsgálatok területei.
A bélmikrobiom emberi egészségre gyakorolt hatásának vizsgálata óriási előrehaladást ért el. A bél mikrobiom számos fontos utat integrál, beleértve az epe, a koleszterin és a foszfolipidek enterohepatikus keringésével kapcsolatosakat is [56]. A bélflóra modulálja a gazda immunitását [57], a glükóz-, lipid- és energia-anyagcserét [58], valamint a kolin rendelkezésre állását [59], amelyek mind szerepet játszanak a NAFLD-ben [60]. A bél mikrobiom összetételét számos tényező befolyásolja, mint például az anyai étrend, az egész életen át tartó étrend, a környezeti expozíció és a genetika [61]. A bél mikrobiomjában található gammaproteobaktériumok és Erysipelotrichi közvetlenül összefüggenek a máj zsírtartalmának változásával a kolin kimerülése során. Ezeknek a baktériumoknak a szintjét, a májzsír mennyiségének változását és az egyetlen nukleotid polimorfizmust (PEMT rs12325817), amely befolyásolja a kolint, olyan modellbe egyesítettük, amely pontosan megjósolta, hogy az egyének holinhiányos étrenden milyen mértékben fejlesztették ki a zsírmájat [4]. Ez arra utal, hogy a mikrobiom hatásainak megértése fokozhatja a NAFLD kockázatát és progresszióját meghatározó jelenlegi paradigmákat.
Kolin és a zsíros májbetegség progressziója
Többet kell megértenünk azokról a tényezőkről, amelyek befolyásolják a zsíros májbetegség súlyosabb májkárosodássá és rákká válását. A kolin- és metioninhiány hasznos modell volt a lehetséges mechanizmusok azonosításában. Rágcsálóknál a kolinhiányos étrend progresszív májbetegséget okozott, hasonlóan ahhoz, mint néhány zsírmájú embernél: steatosis → fibrózis → cirrhosis → hepatocelluláris carcinoma [6, 62]. Ez a zsírmájtól hepatocarcinomáig terjedő progresszió akkor is megfigyelhető, amikor az egerekben a kolin metabolizmusában lévő gén kiütésre kerül. A korábban tárgyalt Bhmt -/- egér zsíros máj- és májkárosodást (emelkedett ALT- és gamma-glutamiltranszferáz 1) fejleszt ki 5 hetes korban, és ez 52 hetes korban hepatocarcinomává fejlődik [33]. Összességében a Bhmt -/- egér májfenotípusa azt sugallja, hogy ez a modell értékes eszköz lesz a zsírmáj előrehaladásának jellemzésére, amely kifejezetten a kolinhiányhoz, a megváltozott metilációs potenciálhoz és esetleg más olyan stresszválaszokhoz kapcsolódik, amelyek mitokondriális diszfunkcióban és ER stresszben nyilvánulhatnak meg. [33].
Számos mechanizmust azonosítottak, amelyek megmagyarázhatják, miért fejlődik a kolinhiány hepatocarcinomává. Az elsődleges mechanizmus a DNS károsodását foglalja magában, a 8-oxodeoxiguanozin [63, 64], az apurinin/apyrimidin helyek [65] és az Ogg1-érzékeny helyek [65] képződésével értékelve a DNS-ben, amelyek felhalmozódnak, ha a patkányok kolintól mentesek. A kolinhiányos májsejtek túltermelik a szabad gyököket, mert mitokondriumuk szivárgássá válik [43, 45, 66–68]. Ezen túlmenően, a hepatociták halála, amely kolinhiányban fordul elő [69], gyulladásos választ okoz a kapcsolódó neutrofil/makrofág által közvetített reaktív oxigén és nitrogén fajok képződésével [70].
Kolin, NAFLD és metabolikus szindróma
A NAFLD szorosan kapcsolódik az elhízáshoz és az inzulinrezisztenciához [32]. Jó okkal feltételezhető, hogy a kolin és az 1-szén anyagcsere befolyásolja az elhízást és az inzulinrezisztenciát. Azoknál az egereknél, akik obesogén étrendet fogyasztottak, amely súlygyarapodást és máj steatosist okoz, a plazma és a máj metabolomikus megközelítése foszfatidilkolint, lizofoszfatidilkolint és betaint nevezett metabolitként azonosította az elhízott és a sovány fenotípust [71]. Az egyik széngén szerepe kiemelkedő volt egy olyan tanulmányban is, amely egyesítette a genomi és metabolomikus adatsorokat az étrend okozta elhízás jellemzésére egerekben [72]. Az inzulinérzékenység és a cukorbetegség jellemzésére irányuló humán vizsgálatok során a kolin metabolitokat szintén többször azonosították a metabolikus állapotok megkülönböztetésénél [73–75]. Ezzel szemben a kolin metabolizmusában a gének megváltoztatása módosítja az elhízásra adott reakciókat. A magas kalóriatartalmú/magas zsírtartalmú étrend miatt a Pemt knockout egerek védettek az elhízástól [76]. Érdekes, hogy elhízott, leptinreceptor-hiányos egerekben a foszfatidilkolin, köztük a Pemt termelésében szerepet játszó gének szabályozása feljavult [53]. Ebben az egérben a máj steatosis csökkent, ha Pemt elhallgattatták [53]. Ezek az adatok arra utalnak, hogy vannak olyan foszfatidilkolin által közvetített mechanizmusok, amelyek befolyásolják az elhízásra adott reakciókat.
A PPARα, a nukleáris receptorok peroxiszóma-proliferátor családjának része, magas mértékben expresszálódik a májban, és részt vesz a zsírsav anyagcserében, a lipoprotein összeállításában [77] és a glükoneogenezisben [78]. A PPARa receptor endogén liganduma a foszfatidilkolin (1-palmitoil-2-oleoil-sn-glicerin-3-foszfokolin) specifikus formája. Ennek a foszfatidilkolinnak az infúziója összefoglalja a zsírmáj elleni védelmet, amelyet a PPAR agonisták mutatnak [10]. Egy másik nukleáris receptornak, a máj receptor homológ 1-nek (LRH-1) addig nem volt ismert endogén liganduma, amíg egy specifikus foszfatidil-kolint (dilauroil-foszfatidil-kolin-DLPC) nem azonosítottak agonistaként [11]. Ez a receptor részt vesz az epesav bioszintézisében, és az aktiváció elősegíti az epesav szintézist, csökkenti a máj trigliceridjeit és csökkenti a szérum glükózkoncentrációját [11].
Következtetés
Gyorsan halad a megértésünk a kolin és a kapcsolódó metabolitok hatásának a máj fiziológiájára gyakorolt hatásáról, valamint ezen tápanyagok egyedi követelményeiről. Különösen izgalmas a fejlett módszerek, például a metabolomika, és a feltörekvő tudomány, például a bél mikrobiom-gazda kölcsönhatások területe alkalmazásának előrehaladása annak felismerése érdekében, hogy szélesebben értékeljük azokat a mechanizmusokat, amelyek révén a kolin többféle funkciója konvergál bizonyos májfenotípusokban. Egyes gének viszonylag feltáratlan, nem kanonikus funkciói a kolin anyagcsere útvonalában, valamint a legutóbbi megfigyelések, amelyek összekapcsolják az egyik szén és energia anyagcserét, sokat ígérnek a komplex anyagcserebetegség néhány rejtelme feltárására, miközben felderítik a NAFLD megelőzési és kezelési célkitűzéseit.
Főbb pontok
A kolin elengedhetetlen tápanyag, amely több mechanisztikus szerepet játszik a NAFLD-ben, és annak progressziója magában foglalja a VLDL-exportot, az epe enterohepatikus metabolizmusát, a mitokondriális funkciót, az epigenetikát, az ER-stresszt és a VLDL-exportot.
Az emberi kolinhiány májműködési zavarokkal társul, az érzékenység pedig olyan tényezőktől függ, beleértve a genetikát, a nemet és a bél mikrobiómáját, amelyek befolyásolják a kolinigényt.
A legújabb bizonyítékok kiemelt szerepet játszottak a kolin és az egyik szén-anyagcsere szerepében a metabolikus szindrómában.
Az egyes kolinigények ismeretének alkalmazása a gasztroenterológiai klinikai gyakorlatban javíthatja az eredményeket.
Köszönetnyilvánítás
A megfelelő szerző laboratóriumában végzett munkát az Országos Egészségügyi Intézet (R01 DK55865 és P30DK056350) támogatja.
- A fizikai aktivitás hatása a májfunkcióra alkoholmentes zsírmájbetegségben szenvedő betegeknél
- Az alkoholmentes zsírmájbetegség fókuszos zsírtartalmának dinamikus változása a kezelés után
- Határok kockázat-előrejelzése alkoholmentes zsírmájbetegségre biokémiai és étrendi alapján
- Az étrendi kapszaicin és az antibiotikumok szinergikusan hatnak az alkoholmentes zsírmájbetegségek csökkentésére
- Étrendi összetétel és alkoholmentes zsírmájbetegség SpringerLink