Az alultápláltság hatása a norovírusfertőzésre
Danielle Hickman
Orvostudományi Főiskola, Molekuláris Genetikai és Mikrobiológiai Tanszék, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
Melissa K. Jones
Orvostudományi Főiskola, Molekuláris Genetikai és Mikrobiológiai Tanszék, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
Shu Zhu
Orvostudományi Főiskola, Molekuláris Genetikai és Mikrobiológiai Tanszék, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
Ericka Kirkpatrick
Orvostudományi Főiskola, Molekuláris Genetikai és Mikrobiológiai Tanszék, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
David A. Ostrov
b Orvostudományi Főiskola, Patológiai, Immunológiai és Laboratóriumi Orvostan, Neurogenetikai Központ, Floridai Egyetem, Gainesville, Florida, USA
Xiaoyu Wang
c Mikrobiológiai és immunológiai, informatikai és mérnöki, valamint biostatisztikai tanszékek, New York-i Állami Egyetem, Buffalo, Buffalo, New York, USA
Mária Ukhanova
d Közegészségügyi és Egészségügyi Szakmai Főiskola és Orvostudományi Kar, Emeremi Pathogens Intézet Járványügyi Tanszék, Florida Egyetem, Gainesville, Florida, USA
Yijun Sun
c Mikrobiológiai és immunológiai, informatikai és mérnöki, valamint biostatisztikai tanszékek, New York-i Állami Egyetem, Buffalo, Buffalo, New York, USA
Volker Mai
d Közegészségügyi és Egészségügyi Szakmai Főiskola és Orvostudományi Kar, Epidemiológiai Tanszék, Feltörő Pathogens Intézet, Florida Egyetem, Gainesville, Florida, USA
Marco Salemi
e Orvostudományi Főiskola, Patológiai, Immunológiai és Laboratóriumi Orvostudományi Intézet, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
Stephanie M. Karst
Orvostudományi Főiskola, Molekuláris Genetikai és Mikrobiológiai Tanszék, Emerging Pathogens Institute, Florida Egyetem, Gainesville, Florida, USA
ABSZTRAKT
FONTOSSÁG
A fejlődő országok alultáplált gyermekei súlyosabb fertőzésekre hajlamosak, mint egészséges társaik, különösen a hasmenést okozó bélrendszeri fertőzésekre. Annak érdekében, hogy megvizsgáljuk az alultápláltság hatásait egy enterális fertőzésre egy jól kontrollált, egyéb környezeti és genetikai variabilitástól mentes rendszerben, egér modellben vizsgáltuk a norovírusfertőzést. Kimutattuk, hogy az alultáplált egereknél súlyosabb norovírusfertőzés alakul ki, és nem képesek másodlagos kihívássá tenni a hatékony memóriaimmunitást. Ez különös jelentőséggel bír, mert az alultáplált gyermekek általában kevésbé hatékony immunválaszt adnak az orális oltásokra, és most új modellrendszerünket használhatjuk e károsodás immunológiai alapjának vizsgálatára. Megállapítottuk azt is, hogy a norovírusok könnyebben fejlődnek az alultápláltsággal szemben. Végül mind a norovírusfertőzés, mind az alultápláltság lényegesen és egymást átfedő módon függetlenül megváltoztatja a bél mikrobiota összetételét.
BEVEZETÉS
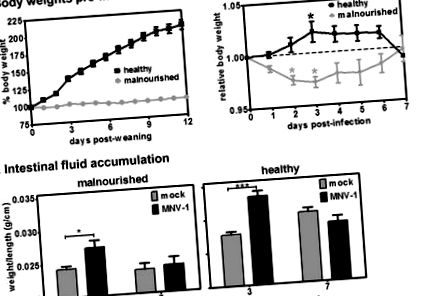
Az alultápláltság a kontroll károsodását és a norovírusfertőzés késleltetett eltávolítását eredményezi.
Az alultáplált gazdaszervezetben az MNV-1 fertőzés kontrollja károsodott, és a vírusürítés késik. A C57BL/6 egerek csoportjainak 2% -os (szürke oszlopok; alultáplált) vagy 20% -os (fekete oszlopok; egészséges) fehérjetartalmú étrendet fogyasztottak az elválasztást követő 12 napig. Ezután mindkét csoportot 106 TCID50 egység MNV-1 fertőzéssel fertőztük meg. 1 dpi-nél (n = 3), 3 dpi-nél (n = 8) és 7 dpi-nél (n = 7) minden csoportból egereket gyűjtöttünk, a jelzett szöveteket boncoltuk, és a vírustitereket plakkvizsgálattal határoztuk meg. Az adatokat PFU/g szövetben adjuk meg, és az összes egér adatait csoportonként átlagoljuk. A két étrendcsoportot statisztikai célokra összehasonlítottuk az egyes szövetek mindegyik időpontjában.
Az alultáplált gazdaszervezetben csökkentek a vírusellenes antitestválaszok, korrelálva az ablált védőimmunitással.
Az antivirális antitestválasz az alultáplált gazdaszervezeteknél elnémul. A C57BL/6 egerek csoportjait (n = 8–9 összesen, két kísérleti ismétlésben) 2% -os (szürke vonalak; alultáplált) vagy 20% -os (fekete vonalak; egészséges) fehérjetartalmú táplálékkal etettük az elválasztást követő 12 napig, majd gúnyolódtunk beoltott vagy fertőzött 106 TCID50 egység MNV-1 po A fertőzés utáni 1., 2., 4. és 6. héten minden egérből székletpelletet és szérumot gyűjtöttünk. A vírusspecifikus ellenanyagot standard ELISA módszerrel detektáltuk a székletminták (A) szekunder anti-egér IgA-jával, a szérumminták esetében pedig a B-szekunder anti-egér IgG-vel. Az adatokat állapotonként az összes egér átlagos abszorbancia-értékeként adjuk meg. Az összes oltott egérből gyűjtött minta negatívnak bizonyult (az adatokat nem mutatjuk be). A két diéta csoportot statisztikai célokból minden időpontban összehasonlítottuk.
Az MNV-1 védőimmunitást az alultápláltság megszünteti, a szövetben lévő vírustiterek alapján. Az egerek csoportjait (n = 5) 2% -os (fehér oszlopok; alultáplált) vagy 20% (szürke oszlopok; egészséges) fehérjetáplálékkal etették, vagy beoltották őket (az x tengelyen „ál” jelzéssel látták el), vagy 106 TCID50 egység MNV-vel immunizálták őket. -1 („vax” felirattal az x tengelyen a beoltottak esetében). Hat héttel később az összes egeret 10 7 TCID50 egység MNV-1 p.o. A szekunder szekció után egy nappal az egereket leöltük, és a jelzett szöveteket összegyűjtöttük a vírusterhelés meghatározása céljából, standard plakk-vizsgálattal. Az összes egér állapotonkénti adatait átlagoltuk, és a kimutatási határokat szaggatott vonallal jelöltük. A statisztikai elemzéshez összehasonlított csoportok között szerepel az étrendhez illesztett modell a vax, a 2% -kal szemben a 20% -os fehérjetartalmú étrend, és a vax 2% -kal szemben a 20% fehérje-diétával.
Az MNV-1 védelmi immunitást az alultápláltság megszünteti, a bélfolyadék felhalmozódása alapján. A 2% (A) vagy 20% (B) fehérjetartalmú táplálékkal etetett egerek csoportjait vagy beoltották (az x tengelyen „ál” jelzéssel látták el; n = 4), vagy pedig 106 TCID50 egység MNV-1-vel („vax” jelzéssel) immunizálták. az x tengelyen, oltottak esetében; n = 6). Hat héttel később az összes egeret 10 7 TCID50 egység MNV-1 p.o. Minden étrendhez egy harmadik egércsoportot vontunk be, amely mindkét fertőzésnél inokulátumot kapott (az x tengelyen „naiv” jelöléssel; n = 3). A másodlagos fertőzés után 3 nappal az egereket leöltük és a bélfolyadékot megmértük az Anyagok és módszerek szerint. Az összes egér állapotonkénti adatait átlagoltuk. A statisztikai elemzésekhez összehasonlított csoportok között szerepel az étrendhez illesztett naiv kontra gúny, naiv kontra vax és makett versus vax.
Az alultáplált egerekben fokozott a vírus divergencia.
Az alultápláltság és a norovírusfertőzés drámai változásokkal jár a mikrobiota összetételében.
A mikrobiota összetételét a fehérje alultápláltsága és az MNV-1 fertőzés megváltoztatja. Az egerek csoportjait (n = 8) 2% -os (alultáplált) vagy 20% -os (egészséges) fehérjetartalmú táplálékkal etették. Étrendenként három egeret oltottak be, míg a másik öt egeret 107 TCID50 egység MNV-1-vel fertőzték meg. Székletmintákat gyűjtöttünk egyedi egerekből 0, 1, 2, 3, 4 és 5 dpi felbontással, és a mikrobiom összetételét a baktérium 16S rRNS génjének hipervariábilis V1-V3 régiójának 454 szekvenálásával határoztuk meg. (A) Bemutatjuk az egyes diétacsoportok mikrobiológiai eloszlását 0 dpi-nél a menekültügyi szinten. (B) A fertőzött egerek menedékjogi adatait 0 és 5 dpi felbontásban mutatjuk be minden étrendcsoportra.
VITA
Az alultáplált egereknél súlyosabb és hosszan tartó MNV-1 fertőzések alakulnak ki.
Az alultáplált egerek károsítják az MNV-1 elleni védőimmunitást.
Alultáplált egerekben nagyobb az MNV-1 változatosság, mint egészséges egerekben.
Noha az adaptív mutációk többségét csak egy étrendcsoportban detektálták, a VP1 296. pozícióban a lizin-glutamát változás az idő múlásával mindkét étrendcsoportban dominánssá vált. Pontosabban, a vírus inokulum klónok 7% -a tartalmazott glutamát maradékot ebben a helyzetben, míg egerek kollektív csoportjának székletpelleteiből nyert klónok 59% -a és 75% -a glutamátot tartalmazott 35, illetve 50 dpi felbontásban. Ez a specifikus változás az MNV-1 sejttenyészet passzálása során következik be (29, 63), és a STAT1 -/- egerekben fellépő csillapítással jár (28, 29). A legtöbb, az MNV-1-től napjainkig azonosított törzs glutamáttal rendelkezik ebben a helyzetben (29), ami fitnesz előnyre utal a vírus számára, mivel az interferonhiányos egerekben alkalmazott csillapító fenotípusa ellenére rutinszerűen in vitro és in vivo szelektálják . A 296-os aminosav a VP1 hipervariábilis P2 régiójában fordul elő, így a lizin-glutamát változás megváltoztathatja a receptor elköteleződésének hatékonyságát.
Az alultápláltság és az MNV-1 fertőzés függetlenül befolyásolja a mikrobiota összetételét.
Összességében bemutatjuk az alultáplált gazdákban az MNV fertőzés átfogó jellemzését, megalapozva a táplálkozási állapot, a nyálkahártya immunitás és a mikrobiota összetett összefüggéseinek vizsgálatát, amelyek az enterális kórokozókra adott általános gazdaszervezet reakcióját alakítják ki.
ANYAGOK ÉS METÓDUSOK
Egerek és diéták.
A vemhes vad típusú C57BL/6 egereket a Charles River Laboratories-tól (Wilmington, MA) szereztük be, és a Floridai Egyetemen állattartó létesítményekben helyeztük el, specifikus kórokozóktól mentes körülmények között. Az összes kísérlethez a nemhez illesztett 3 hetes C57BL/6 egereket elválasztáskor véletlenszerűen 2% (TD.92203) vagy 20% (TD.91352) fehérjét tartalmazó izokalórikus étrendhez (Harlan Laboratory, Maine) osztottuk.; az étrendeket izokalorikusvá tették úgy, hogy a fehérjét cukorral és keményítővel helyettesítették. Az egereket a kísérletek során a megfelelő étrenden tartották. A jelen vizsgálatban végzett összes állatkísérletet a Floridai Egyetem Intézményi Állattenyésztési és Felhasználási Bizottsága hagyta jóvá (tanulmányszám: 201107166 vagy 201107538).
Vírus és fertőzések.
A 7. passzusban lévő MNV-1 CW3 (16) izolátumot (a továbbiakban MNV-1 néven említjük) minden kísérletben felhasználtuk. Vírusállományt úgy állítottunk elő, hogy a fertőzött RAW 264.7 sejtlizátumokat szacharózpárnán keresztül centrifugáltuk, és cézium-klorid gradiensen frakcionáltuk, az előzőekben leírtak szerint (16, 63), és titráltuk standard TCID50 vizsgálattal (53). Párhuzamosan készítettünk egy oltóanyag-állományt, fertőtlen tenyészetekből származó RAW 264.7 sejtlizátum felhasználásával. Az összes kísérlethez az egereket perorálisan (p.o.) oltottuk be 25 µl MNV-1 vagy ál inokulummal. Amikor meghatároztuk a vírusterhelést, az egereket perfundáltuk, a szöveteket boncoltuk, lemértük és homogenizáltuk táptalajban gyöngyveréssel 1,0 mm-es cirkónium-dioxid/szilícium-dioxid-gyöngyök alkalmazásával (BioSpec Products, Inc.). A szövetminták plakkvizsgálatait a korábban leírtak szerint hajtottuk végre (17, 63), és az adatokat PFU-ként adtuk meg szöveti grammenként.
Gastroenteritis assay.
A bélfolyadék felhalmozódását standard vizsgálattal értékeltük (16, 17). Röviden, a vékonybelet a pylorus és a vakbél csomópontjainál ligáltuk, boncoltuk, lemértük és megmértük a hosszát. A bélfolyadék felhalmozódását egy súly/hosszúság arány jelezte, amelyet megnöveltek a fertőzött egereknél a kontrolléhoz képest.
Vírusspecifikus ELISA.
Submandibularis szúrást alkalmaztunk a szérum összegyűjtésére az egerekből a fertőzés utáni megadott időpontokban. A székletpelleteket (0,05 g) összegyűjtöttük 0,5 ml foszfáttal pufferolt sóoldatba (PBS), amely proteáz inhibitor koktélt (Sigma) tartalmazott, homogenizáltuk és 20 000 x g-vel 4 ° C-on 20 percig centrifugáltuk. Korábban leírtak egy MNV-1-specifikus ELISA-t (25). Röviden, a 96 üregű lemezeket 250 ng MNV-1 rekombináns VP1/VP2 (rVP1/2) fehérjével vonjuk be, és egy éjszakán át 4 ° C-on inkubáljuk. 1:20 hígított szérummintákat vagy 1:10 arányban hígított széklet-lizátumokat alkalmaztunk, majd szekunder antitestként torma-peroxidázhoz (HRP) konjugált anti-egér IgG vagy anti-egér IgA-t. Az ABTS [2,2'-azinobisz (3-etilbenzthiazolinesulfonsav) szubsztrát hozzáadása után az abszorbancia értékeket 410 nm-en olvastuk fel Spectramax M2 lemezolvasó alkalmazásával. Minden lemezre standard görbét hoztunk létre pozitív-kontroll soros hígításokkal MNV-1 szérumminta a lemez-lemez konzisztencia biztosítása érdekében. A kísérleti mintákkal párhuzamosan egyenértékű számú beoltott kontrollegérből származó szérum- és székletmintákat teszteltünk. A kontrollok átlagos értékét használtuk a kiindulási kimutatási szintek jelzésére.
Vírusos sokféleség.
Mikrobiota elemzés.
Statisztikai analízis.
Az 1–6. Ábrákon bemutatott összes adatelemzést GraphPad Prism szoftverrel végeztük. Valamennyi grafikonon az átlagok standard hibáit használtuk a hibasávok meghatározásához, és a P értékeket párosítatlan kétfarkú t tesztekkel határoztuk meg. Az egyik csillag P értéke 0,01-0,05, két csillag P értéke 0,001-0,01, három csillag pedig P 0,001 alatti érték. Egyfarkú Mann-Whitney U tesztet alkalmaztak annak értékelésére, hogy az alultáplált csoportban az átlagos vírus divergencia szignifikánsan magasabb volt-e (P Koo HL, Neill FH, Estes MK, Munoz FM, Cameron A, DuPont HL, Atmer RL. 2013. Noroviruses: a rotavírus elleni oltás bevezetését követően a leggyakoribb gyermekkori vírusos enterális kórokozó egy nagy egyetemi kórházban J. Pediatr. Infect. Dis. 2: 57–60. 10.1093/jpids/pis070 [PMC free article] [PubMed] [CrossRef] [ Google ösztöndíjas]
- A húgyúti fertőzés (UTI) tünetei, okai, kezelése
- Húgyúti fertőzés férfiaknál - Harvard Health
- Mi a vastagbélfertőzés Irrfan Khan vastagbélfertőzésben szenved, és itt minden szükséges
- Mi az elhízás; s hatása az érrendszerre; ED Affirm Klinika
- A dzsungel hatása Az orvos felfedezi a legegészségesebb étrendeket a világ minden tájáról - miért működnek és