Az antiszensz oligonukleotid terápiák lehetőségei örökletes gyermekkori tüdőbetegségek esetén
Absztrakt
Bevezetés
Az antiszensz oligonukleotidok (AO) képesek módosítani a génexpressziót azáltal, hogy kölcsönhatásba lépnek specifikus génátiratokkal, különféle mechanizmusok révén. Évtizedekkel ezelőtt ambiciózus állításokat fogalmaztak meg az AO technológia azon lehetőségével kapcsolatban, hogy az emberi betegség kezelésében modulálja a génexpressziót, de a legtöbb új gyógyszerfelfedezési platform mellett különféle tényezők, köztük következetlen szintézisprotokollok, a mechanizmusok nem megfelelő megértése és korlátozott kísérleti kontrollok akadályozták a technológia fejlődése. Eddig csak néhány AO-t engedélyeztek klinikai használatra, az évek óta tartó klinikai fejlődés ellenére, és visszatekintve figyelemre méltó, hogy minden jóváhagyott kezelés más-más hatásmechanizmust hív elő [1].
A közelmúltban két új gyógyszert hagytak jóvá két „gyakori” ritka és súlyos genetikai betegség kezelésére: a Duchenne-féle izomdisztrófiát (DMD) [2] és a gerinc izom atrófiáját (SMA) [3]. Mindkét esetben a beavatkozás célja az pre-mRNS feldolgozásának irányítása, DMD esetében, célzott exon-kihagyás indukciója révén, míg az SMA-ban az exon-retenció elősegítése a funkcionális átirat előállítása céljából. Valamennyi emberi gén az expresszió során valamilyen pre-mRNS-feldolgozáson megy keresztül, és az elsődleges génátiratok többsége konstitutív vagy alternatív splicingen megy keresztül, ahol a nem kódoló intronikus szekvenciákat eltávolítják az érett mRNS-ből, és az exonokat pontosan összekapcsolják. A rendellenes splicinget, teljes vagy részleges exonvesztést vagy az intronikus szekvenciák megtartását okozó mutációkat ma már felismerték, mint az emberi betegség viszonylag gyakori okai [4]. Ennélfogva a génexpresszió terápiás stratégiaként történő AO-módosításának lehetőségét jelenleg más betegségekben vizsgálják.
Az erőteljes kutatás az AO kémia finomítására és a biológiai hozzáférhetőség, a biztonság, a hatékonyság és a célon kívüli hatások csökkentésének javítására összpontosít [5,6,7]. Ennek a technológiának a klinikai transzlációjával azonban még mindig vannak kihívások, különösen az AO hatékony szállítása és nukleáris felvétele tekintetében a célszövetekben, és a célszövettől és a betegségtől függően változhatnak. Ezenkívül az új terápiák klinikai vizsgálatának megtervezése és értékelése olyan körülmények között, ahol a betegpopuláció kicsi, és a betegség progressziója lassú, nagy valószínűséggel innovatív és adaptív vizsgálatokat igényel [8,9,10,11]. Ebben az áttekintésben bemutatjuk az AO kémiainak mechanizmusait és előnyeit, különös tekintettel a genetikai eredetű légzőszervi betegségek kezelésére.
Felülvizsgálat
Antiszensz oligonukleotid kémia
Az antiszensz oligonukleotidok rövid, egyszálú nukleinsavak, amelyeket általában 13-50 nukleotid hosszúságúnak neveznek, de a gyakorlatban jellemzően 20-25 bázis hosszúak. A megfelelően megtervezett vegyületek nagy affinitással és specifitással kötődhetnek az adott nukleinsav-célpontokhoz Watson és Crick bázispárosítás révén [12]. Mivel az RNS és a DNS természetes foszfodiészter gerince különösen érzékeny a nukleáz lebontására, az AO-t használó korai tanulmányokban az egyes nukleotidok esetében alkalmazott kémia instabil és általában hatástalan volt. Ezt a korlátot gyorsan felismerték, és kémiai módosításokat hajtottak végre az oligonukleotid gerincén, a cél affinitás, a nukleázrezisztencia, a toxikológiai profil, a biostabilitás és a farmakokinetika javítása céljából [13,14,15,16,17,18,19,20,21] . A mai napig sokféle AO-analóg keletkezett, amelyek farmakológiai tulajdonságaikban különböznek, és ezek tovább hozzájárulnak a hatásmechanizmusokhoz [5]. Az egyes AO-analógok kémiait másutt alaposan áttekintették [15,16,17], és ebben a felülvizsgálatban nem fogjuk részletesen tárgyalni. Az AO formulálásához használt, általánosan használt nukleotidkémia tulajdonságait az 1. táblázat foglalja össze.
Az antiszensz terápia alkalmazása betegségekben
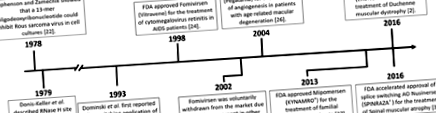
Az antiszensz oligonukleotidok kifejlesztésének és klinikai alkalmazásának mérföldkő
A fenti példák az AO-kat használják a génexpresszió megváltoztatására, közvetlenül vagy a receptorokhoz való kompetitív kötődés útján, a betegség progressziójának megváltoztatására. A betegség progressziójának megváltoztatásának másik pontos módszere az exonok splicingjeinek manipulálása egy gén transzkriptumon belül, splice-switching AOs alkalmazásával. Az AO által közvetített splice-váltás első példájáról Dominski és Kole számolt be 1993-ban, akik AO-kat használtak a béta-thalassemiaért felelős β-globin transzkriptum rendellenes splicingjének kijavítására. Ezt eredetileg in vitro vektorkonstrukciókkal és sejtmentes kivonatokkal [28], később pedig perifériás vérsejtekben [29] végezték, de még nem folytatták a klinikai vizsgálatokat. Az alternatív splicinget kihasználó terápiás beavatkozásokat olyan betegségekben is vizsgálják, mint az angioplasztika restenosis [30], a rák [31, 32], az amiotróf laterális szklerózis [7, 33] és a Huntington-kór [34].
A DMD egy X-hez kötődő, recesszív izomsorvadási betegség, amelyet a DMD gén, amely a transzláció idő előtti leállításához vezet [35]. A betegség enyhébb formáját, a Becker-féle izomdisztrófiát (BMD) általában a dystrophin-gén kereten belüli deléciói okozzák, amelyek részlegesen megőrző belső csonkított dystrophin fehérjéhez vezetnek. A DMD splice-switching terápiájának hátterében az áll, hogy átirányítsa a dystrophin pre-mRNS feldolgozását, és olyan BMD-szerű dystrophin mRNS-t indukál, amely olyan fehérjévé alakulna át, amely megtart bizonyos szintű funkciót, és ezáltal csökkenti a betegség súlyosságát. Az Exondys 51 kifejezetten a DMD-mutációk leggyakoribb alcsoportjának, az 51-es exont kísérő kiválasztott genomiális delécióknak a kezelésére szolgál, és a DMD-delécióval rendelkező betegek körülbelül 13% -ára lesz releváns (2. ábra). Azok a fiúk, akik Exondys 51-et kaptak, továbbra is ambulánsak és csökkentek a légzőizmok csökkenése a korábbi adatokhoz képest [36]. A közelmúlt 1/2. Fázisú klinikai vizsgálatok golodirsennel, amelyet a DMD-ben az 53 exon kihagyására fejlesztettek ki, a disztrofin fehérje expressziójának tízszeres növekedését mutatták az izommintákban 48 hetes kezelés után [37], a 3. fázisú vizsgálatok folyamatban voltak (NCT02500381).
Az Exondys 51 ™ kizárja az dystrophin 51 exont és korrigálja az DMD olvasási keret, ezért csökkenti a betegség súlyosságát a DMD-mutáció leggyakoribb típusában. a Normál illesztése DMD exonok 49–52. b Az 51. exont törlik a DMD transzkripció a mutáció eredményeként a DMD-betegek körülbelül 13% -át érinti. Az Exondys 51 megváltoztatja az 51 exon splicingjét, eltávolítja azt az DMD átírás, az olvasási keret helyreállítása és a betegség súlyosságának csökkentése, tükrözve a Becker MD fenotípust
A különböző DMD-t okozó mutációk más splice-switching stratégiákat igényelnek a dystrophin mRNS átkeretezéséhez, és legalább öt további vegyület, amely az 51., 53., 46., 50. és 43. exont célozza meg, a DMD mutációk akár 43% -át is megoldaná [38]. A megcélozható mutációk spektrumának további növelése érdekében több AO-t kombinálhatunk koktélként a szekvenciális exonok blokkjainak megcélzásához [39]. A megcélozható mutációk megnövekedett skálája mellett a sikeres több exon átugrási kombináció alkalmazható a betegek szélesebb körében. Ezt a stratégiát a DMD számos mutációjára fejlesztették ki, de még nem kell lefordítani [39,40,41]. Azt is felvetették, hogy az exonok 45–55 exonjának átugrása DMD gén funkcionális fehérje izoformot eredményezhet, és a DMD-ben szenvedő betegek akár 63% -át is megmentheti [42].
Az SMA halálos kimenetelű autoszomális recesszív neuromuszkuláris betegség, amely az élet első éveiben progresszív bénulást és izomsorvadást eredményez [43]. Túlélő motoros neuron (SMN) 1 és SMN2 gének kódolják az SMN fehérjét, és bár mindkét gén potenciálisan azonos fehérjéket kódol, a 7. exonban lévő glicin kodon harmadik bázisában lévő C> T polimorfizmus megzavarja a SMN2, oly módon, hogy a 7. exon kihagyásra kerül az átiratok többségéből. Az SMA-t a SMN1 gén és a két példány képtelensége SMN2 kompenzálni a fehérjetermelést a 7. exon nem hatékony splicingje miatt [44]. Összekötő kapcsoló AO-t fejlesztettek ki a célzás érdekében SMN2 az ISS-N1 intronikus összekötő hangtompító elem, és elősegíti a 7. exon befogadását, ezáltal lehetővé téve SMN2 a teljes hosszúságú és funkcionális SMA fehérje előállításához [45] (3. ábra). 2016-ban az FDA jóváhagyta a kötést váltó AO terápiát, a nusinersent (SPINRAZA®) [46]. A Nusinersent intratekálisan injektálják a betegeknél, amint megerősítik az SMA diagnózist. A Nusinersen növeli a teljes hosszúságú SMN fehérje szintjét a gerincvelőben, ezáltal javítja a motoros funkciókat az SMA betegeknél és feltehetően meghosszabbítja a várható élettartamot [47].
A SPINRAZA® erősíti az exon 7 felismerését és megtartását a SMN2 mRNS transzkriptum, csökkentve az SMA betegség súlyosságát. a Az uralkodó splicing SMN2 exonok 6–9. b Az exonikus polimorfizmus gyengíti a 7 SMN2 mRNS. A SPINRAZA® erősíti az exon 7 szelekcióját a SMN2 transzkriptumot, funkcionális fehérjét termel és csökkenti az SMA-betegség súlyosságát
Az antiszensz oligonukleotid terápia lehetőségei CF-ben
A CF betegség terheinek csökkentésére potenciális terápiás stratégia az, hogy melyik
Az exon átugrási stratégiák mellett a szekvencia variációk és a szinonim változások egy része gyengítheti a splicinget, veszélyeztetve az exon kiválasztását és az érett mRNS retencióját, és ezáltal hozzájárulhat a betegség súlyosságához. A káros alternatív splicing CFTR Az intronikus polimorfizmusok által közvetített 10. exonról számoltak be, hogy a CF egyik oka a betegek egy részében [57,58,59]. Az AO-k felhasználhatók a megőrzés megerősítésére CFTR a 10. exon az érett mRNS-ben, és befolyásolhatja a betegség megnyilvánulását különböző mutációkkal rendelkező betegeknél, vagy alternatív stratégiák kiegészítésére alkalmazható az mRNS-szint növelésével (4. ábra). In vitro példa a CFTR splicing mutáció 2657 + 5G> olyan mutáció, amely a 16 exon kizárását okozza a splicing során; az átiratot azonban egy AO javította, amelynek célja a 16. exon befogadásának erősítése [60]. Az Ashkenazi zsidó betegek 5% -ában talált mutáció, 3849 + 10 kb C → T új donorhelyet hoz létre a 19. intronban, aminek következtében egy 84 bázispár pszeudo-exon bekerül az mRNS-be és egy korai stop kodon keletkezik. [61,62,63]. A kötődési hiba in vitro korrekcióját AO alkalmazásával Friedman és munkatársai 1999-ben érték el; azonban még nem áll rendelkezésre klinikai alkalmazás [62].
A káros alternatív splicing CFTR a 10. exont meg lehet oldani összekapcsoló kapcsoló AO-k segítségével. a A 9–11. Exonok normál splicingje CFTR. b Az intronikus polimorfizmus gyengíti az exon 10 szelekcióját CFTR mRNS. AO által közvetített retenció CFTR 10. exon az érett mRNS-ben
Antiszensz oligonukleotid terápia a felületaktív fehérje anyagcsere rendellenességeinek kezelésére
Splice mutáció ABCA3 részleges intron 25 beépülést okoz az mRNS-ben, ami DSPM-et eredményez. a Az ABCA3 exonok normális splicingje a 24–26. b A pontmutáció, az IVS-98T által okozott aberráns splicing a 25-es intronból, a 25 exon után 77 további aminosav után egy stopkodont vezet be, ami csonka fehérjét eredményez. Az AO által közvetített splice korrekció potenciálisan csökkentheti a betegség súlyosságát
A betegséget okozó mutációk többsége SFTPC az SP-C pro-peptid BRICHOS doménjében (4. és 5. exon) találhatók, beleértve az első SFTPC mutáció, c.460 + 1 G, amely a 4. exon átugrását eredményezi a kanonikus donor splice-hely elvesztése miatt [76]. Az SP-C BRICHOS doménjének mutációi fehérje hibás hajtogatást és az aberrált fehérje citoszolos felhalmozódását eredményezik, domináns negatív hatással [77]. Bizonyos betegségekkel kapcsolatos toxikus funkciógyarapodás SFTPC mutációk [78], az AO-k potenciálisan felhasználhatók a kóros SP-C fehérjék szintjének csökkentésére, ha allélspecifikus csendesítés lehetséges.
Antiszensz oligonukleotid terápia
Az AO-alapú terápiák kifejlesztésének egyik fő kihívása az, hogy hatékonyan eljusson a betegség szempontjából releváns szövetekbe in vivo, és emellett legyőzze azokat a sejtgátakat, amelyek megakadályozzák, hogy az AO-k elérjék az intracelluláris molekuláris célpontokat abban a magban, ahol a splicing történik. Ezenkívül az AO beavatkozás csak az aberrált génexpresszió vagy splicing átmeneti korrekcióját teszi lehetővé, a megfelelő adagolási és gyógyszeradagolási rend kidolgozását fontossá téve.
Az AO szállításának fokozására alkalmazható különböző stratégiák szintén befolyásolják az AO szöveteloszlását és biológiai hatásait, összehasonlítva a „szabad” oligonukleotidok bejuttatásával. Ezek a módszerek magukban foglalhatják a hordozómolekulák alkalmazását, konjugálást és/vagy más tényezőkkel való együttadást. Az egyik ilyen stratégia az AO beépítése lipid [88, 89] vagy polimer [90] nanohordozóba a sejtfelvétel elősegítése és az endoszómális felszabadulás megkönnyítése érdekében. Az in vivo felhasználásra szánt lipid nanohordozók felületi bevonattal (például polietilénglikollal) rendelkeznek, amely csökkenti a nanohordozó makrofágok általi felismerését és felvételét [91], míg a részecskében lévő kationos lipidek lehetővé teszik az AO számára, hogy az endocitózis után az endoszómából a célba menekülhessen. sejt. A kationos lipidek sejtmembránra gyakorolt hatásának tulajdonított toxicitás azonban kétségeket vet fel a lipid nanohordozók klinikai alkalmazásával kapcsolatban [92]. Jellemzően a lipid és a polimer nanorészecskék biológiai eloszlása korlátozott, viszonylag nagy méretük miatt (
100 nm), ami további aggályokat vet fel a toxicitással kapcsolatban [92].
Egy másik stratégia az AO módosítása konjugációval bizonyos ligandumokhoz, például lipidekhez [93], szénhidrátokhoz, peptidekhez [94] vagy aptamerekhez [95]. A konjugált oligonukleotidok biológiai eloszlása kevésbé korlátozott, mint a nanohordozókra komplexek, és a konjugátumok könnyen áthaladhatnak a kapilláris endoteliális gáton. Hasonlóképpen, a toxicitás lehetősége alacsonyabbnak tűnik, mint a nanohordozók esetében [90]. A konjugált oligonukleotidok szintén képesek specifikus szöveti receptorok, például integrinek, toll-szerű receptorok vagy receptor-tirozin-kinázok széles körére történő szelektív célzásra [92]. Konjugáció a N-Az acetil-galaktozamint széles körben alkalmazták az oligonukleotidok hepatocitákba juttatásának fokozására [15]. A nanohordozóktól eltérően azonban a konjugátumok kis méretük miatt gyors vese clearance-nek vannak kitéve, korlátozva biológiai hozzáférhetőségüket.
A szállítási hatékonyság javítható azáltal is, hogy bizonyos tényezőket együtt adnak az AO-val. Egy egereken végzett vizsgálatban az AO által indukált transzgén expresszió javult, amikor egy specifikus 2 ′-O-a metil-RNS-t intramuszkulárisan injektálták egy nemionos blokk-kopolimerrel, az F127-gyel [96]. Ezenkívül tanulmányok a DMD-ben mdx egérmodell bizonyítja, hogy a PMO sejtfelvételét fokozza egy glükóz-fruktóz készítmény együttes adagolása, ami a vázizomzatban a magasabb dystrophin fehérje szint helyreállítását eredményezi [97].
Az AO terápiás hatása nem csak a célsejt elérésétől függ, hanem az intracelluláris molekuláris célpontoktól is. Az AO-k internalizálása a sejtfelszínen több útvonalon keresztül történhet, és függhet a sejttípustól és a sejt fiziológiai állapotától [98]. Az AO endocitózisa azonban nem garantálja az intracelluláris célpontokba történő bejuttatást, mivel először el kell menekülniük a membránhoz kötött intracelluláris rekeszekből [92]. Az endoszóma tartalom, beleértve az internalizált AO-kat, nagyrészt a lizoszómákra irányul lebomlás céljából, vagy a plazmamembránra a sejtek külsejébe történő kiutasítás céljából, ahol nem képesek ellátni terápiás funkciójukat. Széles körben elterjedt vélemény, hogy az endoszomális menekülési gát az egyik legjelentősebb akadály az AO-k terápiában való hatékony alkalmazásában [92].
Következtetések
- Az élelmiszer-környezet, az étrendi fogyasztásra gyakorolt hatása és a benne történő mérés lehetősége
- Miért csak néhány elhízott embernél alakulnak ki krónikus betegségek?
- A hasnyálmirigy-betegségek tünetei
- Ez az új dokumentumfilm arra világít rá, hogy mi is valójában a gyermekkori elhízás elleni küzdelem
- Valós adatok felhasználásával értékelni az inkretin alapú terápiák és az akut kockázat kockázatát