Az atrogin-1/MAFbx mRNS expresszióját a hiszton deacetiláz 1 szabályozza a patkány egyedüli izomzatában a hátsó lábszár tehermentesítése alatt.
Tárgyak
Absztrakt
Ismert, hogy a MuRF-1 és az atrogin-1/MAFbx mRNS expressziója a patkány egyedüli izomzatában megterhelő körülmények között fokozódik. Célul tűztük ki a hiszton-deacetiláz 1 (HDAC1) szerepének meghatározását a MuRF-1 és MAFbx expressziójának aktiválásában patkány talpizomzatában a hátsó lábszuszpenzió (HS) korai stádiumában. Ennek érdekében hím Wistar patkányokat (195–215 g) 3 csoportra osztottunk (n = 8/csoport): kontroll (C), 3 napos HS (HS) és 3 napos HS + HDAC1 inhibitor CI-994 ( 1 mg/kg/nap) (HS + CI). A szabályozó molekulák fehérjetartalmát és mRNS expressziós szintjét Western-blottolással és RT-PCR-rel határoztuk meg. A CI-994 kezelés megakadályozta a HDAC1 magtartalom HS-indukálta növekedését. A várakozásoknak megfelelően a 3 napos HS szignifikáns upregulációt váltott ki a MAFbx-ben, a MuRF-1-ben és az ubiquitinben. A CI-994 beadása a HS által közvetített MAFbx és ubiquitin expresszió szintjének növekedését gyengítette, de nem befolyásolta a MuRF-1 expressziót. A hiszton-acetil-transzferáz p300 magtartalmának csökkenését a HS csoportban CI-994 adagolással megakadályoztuk. A foszforilezett anabolikus szignálmolekulák tartalmában nem volt szignifikáns különbség a HS csoport és a HS + CI csoport között. Így a HDAC1 gátlása megakadályozta a MAFbx és az ubiquitin expressziójának HS által közvetített növekedését, de nem befolyásolta a MuRF-1 génexpressziót.
Bevezetés
Feltételeztük, hogy a HDAC1 aktivitás képes szabályozni az E3 ubiquitin ligázok (MuRF-1 és atrogin-1/MAFbx) mRNS expresszióját patkány talpizomzatában a kirakodás korai szakaszában. A HDAC1 aktivitásának CI-994-gyel történő gátlásával arra törekedtünk, hogy meghatározzuk, hogy a HDAC1 aktivitás befolyásolja-e az izomsorvadás program indukcióját a hátsó lábak kirakodásának korai szakaszában. Ha a hipotézisünk helytálló, a HDAC1 gátlása a MuRF-1 és az atrogin-1/MAFbx expressziójának visszaszorításához és a soleus izom atrófiájának ezt követő gyengüléséhez vezetne. Amint azt korábban bemutattuk, az E3 ubiquitin ligázok egyedüli izomzatában az mRNS expressziójának szignifikáns növekedése figyelhető meg a kirakodás első napján, és a kirakodás harmadik napjáig éri el az expresszió csúcsszintjét 14. Ez az oka annak, hogy a jelen tanulmányban 3 napos kirakodási időszakot választottak.
A mechanikai kirakodás során az izomfehérjék lebomlását szabályozó molekuláris mechanizmusok azonosítása segít olyan farmakológiai beavatkozások rendszerének kialakításában, amelyek megakadályozhatják vagy csillapíthatják a vázizom atrófiáját.
Anyagok és metódusok
Etikai jóváhagyás
Az állatokkal végzett összes eljárást az Orosz Tudományos Akadémia Biomedicinális Problémák Intézetének Biomedicina Etikai Bizottsága jóváhagyta/az Orosz Bioetikai Bizottság élettani szekciója (481. protokoll, 2018. június 12.). Valamennyi kísérletet szigorúan az Országos Egészségügyi Intézet laboratóriumi állatok gondozásának és felhasználásának útmutatójában szereplő útmutatásoknak és ajánlásoknak megfelelően végeztük. Minden erőfeszítést megtettünk az állatok fájdalmainak és szenvedéseinek minimalizálása érdekében. Az összes sebészeti beavatkozás előtt az állatokat tribromoetanol (240 mg kg-1) intraperitoneális injekcióval altattuk. Az érzéstelenítés mélységét a pedál visszahúzási reflexjének (lábujj és lábpárna csipet) tesztelésével értékeltük.
Állati eljárások
Valamennyi állatot 22 ° C-on tartottuk; víz és táplálék állt rendelkezésre rágcsálók számára ad libitum. Huszonnégy 2,5 hónapos Wistar hím patkányt nyertünk az Orosz Tudományos Akadémia Bioorganikus Kémiai Intézetének (Pushchino, Moszkva régió) laboratóriumi állatainak minősített Óvodájából. A patkányokat véletlenszerűen a ketrec kontroll (C) csoportba (n = 8), a hátsó lábszuszpenzió (HS) csoportba (n = 8) és a HS + HDAC1 inhibitor CI-994-et (Selleckchem, USA) (1 mg/kg naponta) soroltuk. 3 napos HS ip-ban 2,5% dimetil-szulfoxidban (DMSO; Sigma, St Louis, MO, USA) 0,9% -os sóoldatban (HS + CI csoport, n = 8). Korábban kimutatták, hogy a CI-994 ezen adagja HDAC1 gátláshoz vezet 15. A kontroll és a HS állatok azonos térfogatú 2,5% DMSO vivőanyagot kaptak. A HS kísérlet 3 napig tartott. A kontroll állatokat hármas csoportokban helyezték el hőmérséklet és fény által szabályozott környezetben (azaz 12 óra A kísérlet végén a patkányokat tribromoetanollal (10 mg/kg) eutanizáltuk, és a talpizomokat gyorsan eltávolítottuk, lemértük és folyékony nitrogénben lefagyasztottuk a későbbi elemzésig. HS és HS + CI állatok.
Hindlimb felfüggesztési protokoll
Az állatokat kirakodási körülményeknek tettük ki a HS 16,17 alkalmazásával. A HS protokoll részletes leírása megtalálható korábbi jelentéseinkben 9,10 .
Fehérje extrakció és Western blot elemzés
RNS elemzés
RT-PCR analízist a korábban leírt módon végeztek 10. Röviden, az RNeasy Micro Kit (Qiagen, Hilden, Németország) segítségével az összes RNS-t 10 mg fagyasztott soleus izomból extraháltuk. Az RNS-koncentrációt 260 nm-en határoztuk meg. Mindegyik megcélzott mRNS-hez 1 µl cDNS-t amplifikáltunk 25 µl SYBR Green PCR reakcióban, amely 1x Quantitect SYBR Green Master Mix-et (Syntol) és 10 µM mindegyik primert tartalmazott: 5′-CTACGATGTTGCAGCCAAGA-3 ′ és 5′-GGCAGTCGAG AAGTCC ′ A MAFbx esetében; 5'-GCCAATTTGGTGCTTTTTGT-3 'és 5'-AAATTCAGT CCTCTCCCCGT-3' a MuRF-1 esetében; 5′-CACCAAGAAGGTCAAACAGGA-3 ′ és 5′-GCAAGA ACTTTATTCAAAGTGCAA-3 ′ az ubiquitin, 5′-ACGGCAAGTTCAACGG CACAGTCAA-3 ′ és 5′-GCTTTCCAGAGGGGCCATCCACA-3; 5'-TCATGAAGTGTGACGTT GACATCC-3 'és 5'-GTAAAACGCAGCTCAGTAACAGTC-3' a β-aktin esetében. Az összehasonlítandó mintákat hasonló körülmények között futtattuk (templátmennyiségek, a PCR-ciklusok időtartama). Az amplifikációt valós időben figyeltük az iQ5 többszínű valós idejű PCR detektáló rendszerrel (Bio-Rad Laboratories, USA). β-Actint és GAPDH-t használtak háztartási génekként.
Statisztikai analízis
Az összes PCR-adatot medián és interkvartilis tartományban fejezzük ki (0,25–0,75). A statisztikai elemzést a REST 2009 v.2.0.12 (Qiagen, Németország) és az Origin Pro v.8.0 (OriginLab Corp., Northampton, MA, USA) programokkal végeztük. Az összes Western blot adatot átlag ± SE értékben fejezzük ki. a csoportok közötti szignifikáns különbségeket statisztikailag elemeztük kétutas ANOVA alkalmazásával, amelyet Tukey-teszt követett. Amikor a normalitás tesztelése sikertelen volt, az adatokat nem paraméteres módszerekkel elemeztük (Kruskal-Wallis ANOVA, majd Dunnett teszt). Különbségek a P értékeivel
Eredmények
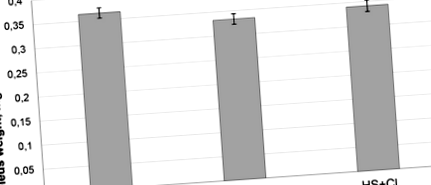
A kísérleti patkányok tömege a kísérlet végén 195–215 g volt, és nem különbözött szignifikánsan a csoportok között. Jelentős 10% -os csökkenést találtunk (p 1. ábra
A Calpain-1, HDAC1, P300, Ac-H3, GAPDH és a B-vitamin reprezentatív Western blotjai citoplazmatikus és magfrakciókban.
A foszforilált nyúlási faktor 2 (eEF2)/teljes eEF2 arány jelentős növekedését figyelték meg a HS és a HS + CI csoportokban, összehasonlítva a C csoporttal (4. ábra).
Az E3 ubiquitin ligáz MuRF1 és az atrogin-1/MAFbx tartalom expressziós szintje szignifikánsan megemelkedett mindkét tehermentes csoportban (HS és HS + CI) a C csoporthoz képest (1. táblázat). Ugyanakkor a HS + CI csoportban az Atrogin - 1/MAFbx mRNS expresszió szintje szignifikánsan alacsonyabb volt, mint a HS csoportban (1. táblázat), míg a MuRF1 mRNS expresszió szintje nem mutatott különbséget a két kirakatlan csoport között ( Asztal 1).
A FOXO3 foszforiláció szintje mindkét terheletlen csoportban egyformán csökkent a C csoporthoz képest (5B. Ábra). Ugyanezt a foszforilezési mintát figyeltük meg az Akt esetében, amelyről ismert, hogy foszforilálja a FOXO3-at (5A. Ábra).
Megállapítottuk, hogy a magfrakcióban a HDAC1 tartalma jelentősen megnőtt (p 6. ábra
A sejtmagban lévő N-terminális farokon (Ac-H3) acetilezett H3 hiszton tartalma (anti-acetil-hiszton H3 antitesttel detektálva) a HS + CI csoportban mind a C, mind a HS csoporthoz képest erősen megnőtt (3. ábra és 8). Ugyanakkor a hiszton-acetil-transzferáz p300 magtartalma csak a HS csoportban csökkent a C csoporthoz képest (3. és 9. ábra). A HDAC1 inhibitor 3 napos HS alatt történő beadása megakadályozta a p300 magtartalom csökkenését a patkány talpizomzatában (3. és 9. ábra).
Vita
Korábbi jelentés azt sugallja, hogy a vázizomzat csökkenése a kirakodás korai szakaszában (2–4 nap) történhet 19. A HDAC1-gátlás hatása az egyetlen testtömeg-arányra, amelyet ebben a vizsgálatban figyeltünk meg, a HS korai szakaszában (3 nap) jelentkezett.
A vázizomzatban az UPS felelős a szarkómikus fehérjék lebontásáért a motoros aktivitás változásával 20. A fokozott ubikvitináció hozzájárul az izomsorvadás kialakulásához. Az ubiquitin expresszió alapján (1. táblázat) úgy tűnik, hogy a HS csoportban ez a folyamat sokkal gyorsabb, mint a másik két csoportban, azonban a CI-994 beadása lelassította. A calpainok kiindulópontként szolgálhatnak, kiváltva a fehérjék további ubiquitációját a vázizmok mechanikus kirakodása során 11. Ugyanakkor a calpain és az UPS rendszerek nem mindig működnek együtt az izomsorvadás során 21. Megállapítottuk, hogy a kalpain expresszió a HS és a HS + CI csoportokban szignifikánsan magasabb volt, mint a C csoportban (2. és 3. ábra), ezért feltételezhető, hogy a HDAC1 gátlása nem befolyásolja a kalpain-1 tartalmat a HS alatt, és valószínűleg nem kapcsolódik az atrófia arányának különbségeihez a HS és a HS + CI csoportok között.
Ismeretes, hogy az eEF2 foszforilezése a 2 megnyúlási faktor kináz (eEF2K) kináz révén szabályozza a 22 transzlációs megnyúlást. Mivel az eEF2 foszforiláció szintje mindkét tehermentes csoportban szignifikánsan megemelkedett a C csoporthoz képest (4. ábra), feltételezhető, hogy a HDAC1 nem vesz részt ennek a folyamatnak a szabályozásában.
Következtetés
Először kimutattuk, hogy (i) a HDAC1 szabályozza az E3 ligáz Atrogin-1/MAFbx expresszióját a patkány egyetlen izomzatában mechanikus tehermentesítés közben, és (ii) a HDAC1 gátlása csillapíthatja a vázizom atrófiáját. Nem kizárt, hogy az Atrogin-1 mRNS expressziójának szabályozását (a FOXO3a foszforilezésével/defoszforilezésével együtt) acetilezésével/dezacetilezésével hajtják végre 3 napos hátulsó lábszár kirakodás után.
Hivatkozások
Bodine, S. C. & Baehr, L. M. Vázizom atrófiája és az E3 ubiquitin ligázok MuRF1 és MAFbx/atrogin-1. Am. J. Phys. Vége. Metab. 307, 469–484 (2014).
Glass, D. J. Jelzőutak, amelyek közvetítik a vázizom hipertrófiáját és atrófiáját. Nat. Cell Biol. 5., 87–90 (2003).
Glass, D. J. Vázizom hipertrófia és atrófia jelátviteli utak. Int. J. Biochem. Cell Biol. 37, 1974–1984 (2005).
Jackman, R. W. & Kandarian, S. C. A vázizmok atrófiájának molekuláris alapjai. Am. J. Physiol. Cell Physiol. 287, 834–43 (2004).
Cohen, S. et al. Az izomsorvadás során a vastag, de nem vékony filamentumokat a MuRF1-függő ubiquityláció lebontja. J. Cell Biol. 185, 1083–95 (2009).
Solomon, V. & Goldberg, A. L. Az ATP-ubiquitin-proteaszóma útvonal jelentősége az oldható és miofibrilláris fehérjék lebontásában nyúl izomkivonatokban. J. Biol. Chem. 271, 26690–7 (1996).
Brocca, L. et al. A FoxO-függő atroginek katabolikus állapotok szerint változnak, és kulcsszerepet játszanak a hátsó lábszuszpenzió által kiváltott izomsorvadásban. J. Physiol. 595, 1143–1158 (2017).
Khalil, R. Ubiquitin-Proteasome Pathway és izomsorvadás. Adv. Exp. Med. Biol. 1088, 235–248 (2018).
Belova, S. P., Shenkman, B. S., Kostrominova, T. Y. & Nemirovskaya, T. L. Az IKKβ gátlásának paradox hatása az E3 ubiquitin ligázok expressziójára és a kirakodás okozta vázizom atrófiára. Physiol. ismétlés. 5., 13291 (2017).
Lomonosova, Y. N., Shenkman, B. S. és Nemirovskaya, T. L. A kirakodás okozta patkánytengely atrófiájának csillapítása a hősokkfehérje-induktorral 17- (allilamino) -17-demetoxigeldanamicin. FASEB J. 26., 4295–301 (2012).
Shenkman, B. S., Belova, S. P., Lomonosova, Y. N., Kostrominova, T. Y. & Nemirovskaya, T. L. A vázizom atrófiájának kirakodást követő Calpain-függő szabályozása. Boltív. Biochem. Biophys. 584, 36–41 (2015).
Moresi, V. et al. A myogenin és a II. Osztályú HDAC-k E3 ubiquitin ligázok indukálásával szabályozzák a neurogén izomsorvadást. Sejt. 143, 35–45 (2010).
Beharry, A. W. et al. A HDAC1 aktiválja a FoxO-t, és elegendő és szükséges is a vázizmok atrófiájához. J. Cell. Sci. 127., 1441–53 (2014).
Kachaeva, E. V. & Shenkman, B. S. A proteolitikus enzimek különféle feladatai a vázizomzatban a kirakodás során: tények és spekulációk. J. Biomed. Biotechnol. 2012, 493618 (2012).
Seki, M. et al. I. osztályú hiszton-dezacetiláz-gátlás tartós pitvarfibrilláció kezelésében. J. Pharmacol. Exp. Ther. 358, 441–9 (2016).
Morey-Holton, E. R. & Globus, R. K. Hindlimb rágcsáló-kirakodási modell: technikai szempontok. J. Appl. Physiol. 92, 1367–1377 (2002).
Novikov, V. E. és Ilyin, E. A. A patkánycsontok életkorhoz kapcsolódó reakciói a kirakodásukra. Aviat. Space Environ. Med. 52, 551–553 (1981).
Vilchinskaya, N. A. et al. A MyHC I (β) mRNS expressziójának gyors csökkenése patkány soleusban a hátsó lábszár kirakodásakor összefüggésbe hozható az AMPK defoszforilációjával. J. Physiol. 595, 7123–7134 (2017).
Giger, J. M., Bodell, P. W., Zeng, M., Baldwin, K. M. és Haddad, F. Gyors izom atrófia válasz a kirakodásra: MHC-t és aktint magában foglaló pre-transzlációs folyamatok. J. Appl. Physiol. 107., 1204–1212 (2009).
Bodine, S. C. et al. A vázizom atrófiájához szükséges ubiquitin ligázok azonosítása. Tudomány. 294, 1704–1708 (2001).
Viteldíj, M. U. et al. Patkányok kalpain inhibitorokkal történő kezelése megakadályozza a szepszis által kiváltott izom proteolízist, függetlenül az atrogin-1/MAFbx és a MuRF1 expressziójától. Am. J. Physiol. Regul. Integr. Comp. Physiol. 290, 1589–97 (2006).
Redpath, N. T., Foulstone, E. J. & Proud, C. G. A transzlációs megnyúlási faktor-2 szabályozása inzulinnal rapamicinre érzékeny jelátviteli úton. EMBO J. 15, 2291–2297 (1996).
Bonaldo, P. & Sandri, M. Az izomsorvadás sejtes és molekuláris mechanizmusai. Dis. Modell. Mech. 6., 25–39 (2013).
Hanson, A. M., Harrison, B. C., Young, M. H., Stodieck, L. S. & Ferguson, V. L. Funkcionális, morfológiai és biokémiai adaptációk hosszanti jellemzése az egér vázizomában hátulsó szárú szuszpenzióval. Izomideg. 48, 393–402 (2013).
Clarke, B. A. et al. Az E3 ligáz MuRF1 lebontja a miozin nehézlánc fehérjét a dexametazonnal kezelt vázizomzatban. Sejt. Metab. 6., 376–385 (2007).
Attaix, D. & Baracos, E. V. A MAFbx/Atrogin-1 expresszió az izom proteolízisének gyenge indexe. Curr. Opin. Clin. Nutr. Metab. Gondoskodás. 13., 223–224 (2010).
Sandri, M. et al. A Foxo transzkripciós faktorok az atrófiával kapcsolatos ubiquitin ligáz atrogin-1-et indukálják, és vázizom atrófiát okoznak. Sejt. 117., 399–412 (2004).
Du Bois, P. et al. Az angiotenzin II a csontváz izom atrófiáját indukálja a TFEB által közvetített MuRF1 expresszió aktiválásával. Circ. Res. 117., 424–36 (2015).
Bertaggia, E., Coletto, L. & Sandri, M. poszttranszlációs módosítások kontrollálják a FoxO3 aktivitását denerváció során. Am. J. Physiol. Sejt. Physiol. 302, 587–96 (2012).
Senf, S. M., Sandesara, P. B., Reed, S. A. és Judge, A. R. p300 Az acetil-transzferáz aktivitás differenciálisan szabályozza a FOXO homológok lokalizációját és aktivitását a vázizomzatban. Am. J. Physiol. Sejt. Physiol. 300, 1490–501 (2011).
McKinsey, T. A., Zhang, C. L. & Olson, E. N. Az izomfejlődés ellenőrzése a HAT és HDAC párbajával. Curr. Opin. Közönséges petymeg. Dev. 11., 497–504 (2001).
Köszönetnyilvánítás
Ezt a munkát az Orosz Tudományos Alapítvány támogatta (RSF Project No. 18-15-00062). A cikk szerzői igazolják, hogy betartják a szerzőség és a folyóiratban való közzététel etikai irányelveit.
Szerzői információk
Hovatartozások
Biomedicinális Problémák Intézete, RAS, Khoroshevskoe sh. 76a, 123007, Moszkva, Oroszország
Jekatyerina P. Mochalova, Svetlana P. Belova, Timur M. Mirzoev, Boris S. Shenkman és Tatiana L. Nemirovskaya
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
Hozzájárulások
T.L.N .: tanulmányterv; adatok gyűjtése, elemzése és értelmezése; a kézirat megírása és benyújtása. B.S.S .: tanulmányterv; adatok elemzése és értelmezése; a kézirat megírása és benyújtása. T.M.M .: a kézirat megírása és elkészítése; S.P.B. és E.P.M .: kísérletek elvégzése, adatok gyűjtése, elemzése és értelmezése; adatszerzés.
Levelezési cím
Etikai nyilatkozatok
Versenyző érdekek
A szerzők kijelentik, hogy nincsenek versengő érdekeik.
További információ
A kiadó megjegyzése: A Springer Nature semleges marad a közzétett térképeken és az intézményi kapcsolatokban szereplő joghatósági igények tekintetében.
- 7 gyakorlat egy homokóra alak izomának faragására; Fitness
- Utánégés! 3 módja annak, hogy több zsírt égessen. Építsen több izmot kevesebb idő alatt
- 3 legjobb dió zsírégetésre; Fitness
- 7 szabadtéri edzés a zsír felolvasztására és az izmok felépítésére ezen a nyáron
- 3 napos egész testű labdarúgó erő edzés Izom és erő