Az elágazó láncú aminosavak feltörekvő szerepe az inzulinrezisztenciában és az anyagcserében
Absztrakt
Az inzulin szükséges a glükóz homeosztázis fenntartásához. Annak ellenére, hogy az inzulinérzékenység fontos az anyagcsere-egészség szempontjából, az inzulinrezisztenciát kiváltó mechanizmusok továbbra sem tisztázottak. Az elágazó láncú aminosavak (BCAA) az esszenciális aminosavakhoz tartoznak, amelyek mind közvetlen, mind közvetett tápanyagjelek. Annak ellenére, hogy a BCAA-król beszámoltak az anyagcsere-egészség javításáról, a megnövekedett BCAA-plazmaszint az anyagcsere-rendellenesség és a jövőbeni inzulinrezisztencia vagy a 2-es típusú diabetes mellitus (T2DM) magas kockázatával jár. A rapamicin-1 komplex (mTORC1) emlős célpontjának BCAA-val történő aktiválása feltehetően inzulinrezisztenciát okoz. Ezen túlmenően az elhízás során hibás BCAA oxidatív anyagcsere fordulhat elő, ami a BCAA-k és a toxikus köztitermékek további felhalmozódásához vezethet. Ez az áttekintés a BCAA által kiváltott mTORC1 aktiváció mechanizmusának jelenlegi megértését, valamint az mTOR aktiváció metabolikus egészségre gyakorolt hatását mutatja az inzulinérzékenység szempontjából. Ezenkívül részletesen tárgyaljuk a károsodott BCAA metabolizmus hatásait.
1. Bemutatkozás
2. A BCAA pozitív hatása az anyagcserére
Annak ellenére, hogy a magas szintű BCAA-k és az IR közötti összefüggést számos emberen végzett vizsgálat és rágcsáló-modell kimutatta, a BCAA-szintek emelése olyan pozitív hatásokhoz vezet, amelyek javítják az anyagcsere-paramétereket, például a testösszetételt, a glikémiás szintet és a jóllakottságot.
A hipotalamusz leucin egy potenciális tápanyagjel, amely csökkentheti az élelmiszer-bevételt azáltal, hogy aktiválja az emlősök által megcélzott rapamicint (mTOR) [5]. Az mTOR robusztusan és szelektíven aktiválódik az ARC-n belüli anorexigén, pro-opiomelanokortint (POMC) és orexigén neuropeptid Y/agouti-val rokon peptidneuronokat expresszáló mediobasalis hipotalamusz (MBH) ívmag sejtekben (ARC) egy gyors etetés után [5]. Az MBH-ban található leucinszint az előagy/agy agy neurocirkulációját vonja maga után, amely negatív visszacsatolást biztosít az energiaegyensúlyra azáltal, hogy csökkenti az étkezés mennyiségét [6]. Cota és mtsai. azt javasolta, hogy ezek a hipotalamikus BCAA-érzékeny válaszok fenntartsák az organizmusokat a metabolikus egyensúly állapotában [5].
A BCAA-k mind a gyomor-bél traktusban, mind a zsírlerakódásokban szabályozzák a hormon felszabadulását. A hat hétig tartó leucinnal végzett kezelés megnövelte az adiponektint és a koleszterinszintet a korábban elhízott egerek plazmájában, anélkül, hogy megváltoztatta volna a testsúlyt vagy a zsírtömeget [7]. A BCAA-k és az étkezési fehérje fokozta a glukagon, például az 1-es peptid (GLP-1) felszabadulását és csökkentette a zsírsavak szintéziséhez és adszorpciójához szükséges gének expressziós szintjét egy emberi bélsejtvonalban (NCI-H716), ami bélmechanizmusra utal a a BCAA-k jótékony hatása [8]. Ezenkívül az emelkedett BCAA szint inzulinémiás reakciókat és inzulinintrop hatásokat váltott ki egerekben [9,10].
Mind a BCAA-ban gazdag étrendnek, mind a BCAA-kiegészítésnek pozitív szerepe van az anyagcserében, támogatva a fehérje étrendi ajánlását a BCAA-szint növelésére.
3. A BCAA negatív hatásai az anyagcserére
A legújabb metabolomikai vizsgálatok és az átfogó anyagcsere-profilalkotási vizsgálatok következetesen kimutatták a normális aminosav-anyagcsere zavarait és a specifikus aminosavak, gyakran a BCAA-k növekedését, az elhízás vagy a T2DM egyes rágcsálómodelljeiben, valamint elhízásban vagy T2DM-ben szenvedő betegeknél [17,18, 19,20,21]. Figyelembe véve a BCAA fent idézett egészségügyi előnyeit, a BCAA magas szintjének korrelációja az inzulinrezisztenciával, az elhízással és a T2DM-rel ellentmondásosnak tűnik.
Feltételezték, hogy a BCAA-k befolyásolják az agy működését azáltal, hogy versengenek a dopamin és az 5-hidroxi-triptamin aminosav-prekurzorainak felvételével az agyban [26]. A nagy semleges aminosav (LNAA) transzportot a BCAA-k és az aromás aminosavak közösen használják, ezáltal versenyre kelve egymással. A BCAA szintjének emelkedése csökkenti az aromás aminosav szintet, ami az aromás aminosavakból származó neurotranszmitterek szintézisének és felszabadulásának csökkenéséhez vezet, ami esetleg hozzájárul a depresszió fokozott kockázatához [2].
A BCAA-k metabolizmusra gyakorolt pozitív hatása ellenére a BCAA-szintek szoros összefüggése az inzulinrezisztenciával és a metabolikus szindrómával arra utal, hogy a megnövekedett BCAA-szintek inzulinrezisztenciát és T2DM-et okozhatnak, bár ez egyelőre spekuláció. A korreláció hátterében álló mechanizmus még nem teljesen ismert. A BCAA-k IR-hez való hozzájárulásának lehetséges mechanizmusát a következő szakasz tárgyalja.
4. Az IR mechanizmusa az mTOR segítségével
Annak ellenére, hogy még mindig nem világos, hogy a BCAA-k okozó tényezők-e az IR kialakulásában, vagy a károsodott inzulinhatás biomarkerei-e, a tápanyagok szignalizációjának szerepe az inzulinrezisztenciában megjelent. A magas BCAA-szintek tartósan aktiválják az mTORC1-et (mTOR-komplex 1), ami inzulinrezisztenciát eredményez az 1-es inzulinreceptor szubsztrát foszforilezésén keresztül (IRS-1).
4.1. Az aminosav által indukált mTORC1 aktiválás mechanizmusa
Az mTOR a foszfatidil-inozitol (PI) kinázhoz kapcsolódó protein-kináz családba tartozó szerin/treonin kináz [27]. Az mTOR jelátviteli hálózat szabályozza a kritikus sejtes és fejlődési folyamatokat, például a sejtek növekedését, differenciálódását, a sejtek túlélését és az anyagcserét [28]. Az mTOR legalább két biokémiailag és funkcionálisan elkülönülő komplexben létezik, az mTOR 1 komplexben (mTORC1) és az mTOR 2 komplexben (mTORC2) [29]. Az mTORC1 számos extracelluláris és intracelluláris szignálra reagálva szabályozza a sejtek növekedését, beleértve a növekedési faktorokat, a sejt energiaállapotát, a sejt oxigénszintjét és az aminosavak rendelkezésre állását. Az mTORC1 az „mTOR szabályozással összefüggő fehérjéjéből” (raptor) áll, amely szubsztrátumokat toboroz és segíti az mTOR lokalizációját; „40 kDa Pro-dús Akt szubsztrát” fehérje (PRAS40), „DEP domént tartalmazó mTOR-interakcióval rendelkező fehérje” (DEPTOR), amelyek mindegyike negatív szabályozó az mTORC1-nek; és „emlős halálos SEC13 fehérjével 8” (mLST8; más néven GβL), amely pozitívan szabályozza az mTORC1-et. Az mTORC1 két legismertebb downstream célpontja a 4EBP1 és az S6K1, amelyek szabályozzák az mRNS transzláció iniciációját és progresszióját, következésképpen a fehérjeszintézist [28].
Tuberous sclerosis 1/2 (TSC1/2) komplex transzdukálja az upstream jelet mTORC1-be [30]. A TSC egy guanozin-trifoszfát (GTP) ase-aktiváló fehérje (GAP) a Rheb kis GTPáz (agyban dúsított Ras homológ) számára, amely negatívan szabályozza az mTORC1-t azáltal, hogy növeli a Rheb GTP-hidrolízis sebességét. Az aminosav-jelátvitel azonban aktiválja az mTORC1-t a TSC-szabályozástól függetlenül az intracelluláris mTORC1 lokalizációjának szabályozásával [31]. Az aminosavhiány során az mTORC1 az egész citoplazmában diffundál. Aminosavstimuláció után az mTORC1 transzlokálódik a lizoszómális felületre, ahol a kicsi GTPáz Rheb található [29]. Zoncu és mtsai. arról számoltak be, hogy az aminosavak extracelluláris hozzáadásuk után felhalmozódnak a lizoszómában, ami arra utal, hogy a lizoszóma az aminosavak által kiváltott mTOR-aktiváció kulcsfontosságú helye [32].
Egy friss jelentés a GATOR komplexeket a Rag fehérjék negatív szabályozóiként azonosította. A GATOR1 közvetlenül kölcsönhatásba lép a Rag fehérjékkel, GAP-ként funkcionál a Rag A és Rag B irányába, ami az mTORC1 aktiváció gátlásához vezet [37]. A GATOR2 gátolja a GATOR1-et, blokkolva az mTORC1 gátló szabályozását, ami mTORC1-aktivációt eredményez [37]. Nevezetesen a Sestrin 2, egy leucin szenzor, szintén kötődik a GATOR2-hez, ezáltal gátolja az mTORC1-et leucin hiányában, annak ellenére, hogy kölcsönhatása hogyan gátolja az mTORC1-et [38]. Végül kimutatták, hogy a leucin közvetlenül kötődik a Sestrin 2-hez, megszakítva a GATOR2-vel való kölcsönhatást, és aktiválva az mTORC1-et [39].
Az aminosav-mediátorok azonosítása az mTORC1 lizoszómára történő transzlokációján, a Vps34-foszfolipáz D1 (PLD1) tengely ellenére javasoljuk az mTORC1 aktiválását a lizoszómán is [40]. A foszfatidinsav (PA), a D1-foszfolipáz terméke, ismert, hogy az mTOR-aktiváció kritikus szabályozója. A PA az mTOR FKBP rapamicin-kötő (FRB) doménjéhez kötődik, versengve a rapamicinnel és aktiválva az mTOR-ot [41]. Ezenkívül a PLD1 által termelt PA felelős az mTOR-aktivációért mind az aminosav-, mind a mitogén-indukálta mTOR-aktiváció során [42]. A közelmúltban kiderült, hogy a PI3P, egy Vps34 termék, aktiválja a PLD1-t, elősegítve annak transzlációját a lizoszómába, függetlenül a Rag-Ragulator komplextől [40]. A PLD1 PA-t termel a lizoszóma felületén, aktiválva az mTOR-t, a Rag-indukálta mTOR-szabályozás mellett. Javasolták ugyan a Ca 2 + -kalmodulin bevonását a Vps34 aktiválása során, de a Vps34-et aktiváló upstream szabályozók ismeretlenek maradnak.
4.2. A BCAA-k által kiváltott mTORC1-aktiváció által az IR-t megalapozó javasolt mechanizmus: Néhány lehetséges mechanizmus
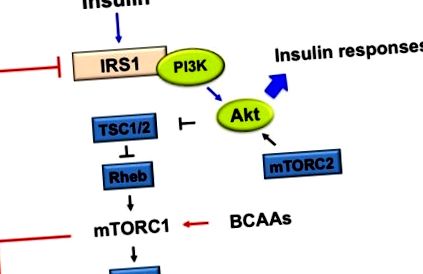
Az mTOR az aminosavak és az inzulin közötti áthallás központi jelátviteli közvetítője. Az inzulin aktiválja az mTOR-t, majd az riboszomális S6K1 aktivációja következik be, amely az S6 foszforilezésével szabályozza a transzláció megindulását és megnyúlását [43]. Vagy aktivált mTOR, vagy aktivált S6K1 IRS-1 foszforilát, amely blokkolt inzulinjelzéshez vezet [44,45] (1. ábra).
Az elágazó láncú aminosavak (BCAA) által stimulált emlősök által a rapamicin-komplex1 (mTORC1) aktiválásának mechanizmusa inzulinrezisztencián (IR). BCAA-k által aktivált mTORC1 és az S6K1 foszforilát inzulinreceptor 1. szubsztrát (IRS-1) követése a 307., 636/639., 1101., 312. szerinnél, amelyek gátolják az IRS-1-et. A fehérje kináz B (PKB, más néven Akt) aktivációja a negatív visszacsatolási szabályozás révén gyengíti az inzulinválaszokat, például a glükózfelvétel és a glikogénszintézis növekedését, valamint a glükózszintézis csökkenését.
5. Vita az mTORC1 szerepéről IR-ben
Annak ellenére, hogy számos kísérleti bizonyíték támasztja alá azt a nézetet, hogy a BCAA-k inzulinrezisztenciára gyakorolt hatása az mTORC1-aktiváció révén jelentkezik, néhány megfigyelés ellentmondásos.
A BCAA szintjének növelése kiegészítéssel vagy genetikai módosítással korrelál az anyagcsere javulásával, az aktivált mTORC1 jelátvitel ellenére. A mitokondriális elágazó láncú aminotranszferáz (BCATm) törlése növelte az energiafelhasználást és javította az inzulinérzékenységet [53]. A BCATm katalizálja az a-amino-csoport átvitelét a BCAA-ból az a-ketoglutarátba, glutamátot és a megfelelő három elágazó láncú a-keto savat képezve. A BCATm kimerülése a BCAA szintjét a vad típusú egerekhez képest tízszeresére emeli a BCAA katabolizmus blokkolása miatt. Váratlanul ezek az egerek több táplálékot fogyasztottak, és fokozott étrend-indukált termogenezist (DIT) mutattak ki, ezt követte a fehérjeszintézis és lebontás megnövekedett sebessége, karcsú fenotípus kíséretében. Ezek az eredmények arra utalnak, hogy a hiányos BCAA katabolizmussal rendelkező egerekben a megnövekedett BCAA-szintek a megnövekedett fehérjeforgalmi sebességből származnak, ami megnövekedett energiafelhasználást.
6. A BCAA szintjét befolyásoló folyamatok
A fehérjeforgalmat az aminosavakon kívül az inzulin szabályozza. Bár az inzulin aktiválja a fehérjeszintézist újszülött malacokban [64], a hiperaminoacidémia körülményei között az intenzívebb fehérjeszintézis az inzulinnak tulajdonítható, ami csökkenti a fehérje lebomlási sebességét [65]. Ennek megfelelően az inzulin csökkenti a MAFbx és a proteaszóma C2 alegység fehérjék mRNS expresszióját az emberi izomban [66]. Az inzulin és az aminosavak elérhetősége additív módon aktiválja a fehérjeszintézist, ami arra utal, hogy az aminosavak és az inzulin függetlenül szabályozzák a fehérjeszintézist [66]. Ez figyelembe veheti azt a megfigyelést, hogy az elhízott és inzulinrezisztens éhomi egyénekben fokozódik a fehérjebontás, anélkül, hogy befolyásolná a fehérjeszintézist [67,68,69]. Bár a BCAA-k nem befolyásolják közvetlenül a fehérje lebomlását, a BCAA-k kritikus szerepet játszhatnak az izomtömeg modulálásában, amikor az inzulin által kiváltott fehérje lebomlás az inzulinrezisztencia hatására csökken.
Ezenkívül a bél mikrobiota befolyásolja a BCAA szintjét a plazmában [70]. A bélmikrobiota számos aminosavat, köztük a gazdaszervezet BCAA-jait használja fel, vagy szintetizálják a baktériumok sejtkomponenseit, vagy katabolizálják őket metabolikus termékek, például rövid szénláncú zsírsavak (SCFA) és elágazó láncú zsírsavak (BCFA) előállításához, amelyek szerepet játszanak a fejlődésben az elhízás. Nevezetesen, a bélbaktériumok emelik az aminosavak szintjét vagy de novo bioszintézissel [71], vagy befolyásolják a tápanyagok felszívódását [72]. Annak ellenére, hogy a bélmikrobákról kimutatták, hogy hozzájárulnak a gazdanövények aminosavszintjéhez, tovább kell értékelni a bélmikrobák jelentőségét a BCAA-szintekben.
7. BCAA diszmetabolizmus
A tartós mTORC1 aktivációval együtt a BCAA anyagcseréjének károsodásai az inzulinrezisztenciához és a T2DM-hez kapcsolódnak az esetlegesen toxikus köztitermékek és a BCAA szint felhalmozódásával a plazmában.
Az elágazó láncú aminotranszferáz mitokondriális izoformája (BCATm, amelyet a BCAT2 kódol) katalizálja a BCAA-k metabolizmusának első lépését a legtöbb perifériás szövetben. A BCAA metabolitok csökkentek a BCAT2 -/- egerek perifériás szöveteiben [53], amint azt az előző szakasz említi. Az mTORC1 folyamatos aktiválása ellenére a BCAT2 -/- egerek nem rendelkeznek inzulinrezisztenciával, ami várható. Ehelyett a BCAT2 -/- egerek javított glikémiás kontrollt és inzulinérzékenységet mutatnak magas energiafelhasználással, valószínűleg a glükoneogén prekurzorok elvesztése miatt, ami azt jelzi, hogy az izomtranszaminázok kritikus szerepet játszanak a máj glükoneogén szubsztrátjainak előállításában.
A BCAA metabolikus útvonal következő lépését a multienzim mitokondriális elágazó láncú α-ketoav-dehidrogenáz komplex (BCKDC) katalizálja [2]. A BCKDC irreverzibilisen oxidálja a BCAA-kat a megfelelő keto-savakká. Fontos, hogy a BCKDC expresszióját és aktivitását számos metabolikus tényező módosíthatja, amelyek összefüggenek az elhízással, az inzulinrezisztenciával és a T2DM-mel. A BCKDC és aktivátorának, az 1K fehérje-foszfatáz mitokondriális izoformájának (PPM1K) mutációja BCAA-k és elágazó láncú α-ketoavak (BCKA) felhalmozódását, majd juharszirup vizeletbetegséget (MSUD) követi [73,74,75] . Valójában a gliasejtek, az agykéreg vagy a patkány májsejtjeinek kezelése több BCKA-val vagy a leucin, a-ketoisokaproát (α-KIC) α-keto-savjával mitokondriális diszfunkciót eredményezett [73,76,77] . Elágazó láncú acil-koenzim A (CoA) fajokat a BCKDC termel. Ezeket több enzimatikus lépés tovább metabolizálja a mitokondriális mátrixban, végül lipogén, ketogén vagy glükogén szubsztrátumokat képezve (acetoacetil-CoA, acetil-CoA és propionil-CoA).
Az elhízott és inzulinrezisztens T2DM-es betegek zsírszövetében a BCAA-metabolizmus enzimjeit kódoló gének expressziója meghatározatlan mechanizmus révén jelentősen csökken - legalábbis az első két lépést katalizáló enzimeket kódoló gének - emelkedett plazmaszinthez vezetnek a BCAA-k [78,79]. Figyelembe véve, hogy az egész test BCAA-metabolizmusa lényegében interorgan-függő, figyelembe kell venni ezen enzimek más szervekben, például a májban és az izmokban való expresszióját. A BCAA metabolizmus enzimjeit kódoló gének expressziója csökkent volt a T2DM-ben szenvedő betegek izom- és májszövetében [80,81]. Hasonló eredményeket tapasztaltak patkányokon is [82]. Ezzel szemben a máj BCKDH aktivitása valóban megnövekszik, és kompenzálhatja a zsírszövet csökkenő aktivitását [83]. Ezért a kapott plazma BCAA-szint vagy megemelkedik, vagy nem változik, a többi szerv enzimatikus aktivitásától függően.
A mutációk vagy az epigenetikus szabályozás által okozott megváltozott génexpresszió befolyásolja a BCAA metabolizmus összes enzimatikus aktivitását. Tiffin és mtsai. azonosította a BCKDH4-et, a BCKDC szabályozó alegységét kódoló gént, a két elsődleges érzékenységi gén egyikeként, amelyek befolyásolják a T2DM és az elhízás kialakulásának kockázatát a számítógépes betegségprioritizáló módszerekkel [84]. Továbbá ugyanez a tanulmány megállapította, hogy az IVD másodlagos T2DM-fogékonysági gén. Az IVD az izovaleril-CoA dehidrogenázt kódolja, amely részt vesz a leucin metabolizmusában [84]. A PPM1K-t, a BCKDHA-foszfatázt választották a T2DM-vizsgálat 20 legjobb jelöltje közé [85]. Az akut testmozgással elért megváltozott BCKDC aktivitás [86] vagy a BCKA szabályozó [87] szintén módosíthatja a plazma BCAA szintjét, akár rövid, akár hosszú távon. Számos tényező közül a hosszú láncú zsírsavak és metabolitjaik közvetlenül, a redoxi állapotok vagy az acetil-CoA koncentrációinak befolyásolásával, vagy közvetett módon az enzimek gátló karbonilezésével, esetleg BCAA diszmetabolizmust okozva akadályozták a BCKDC aktivitást [88,89,90, 91].
8. Következtetések
Összefoglalva, a legújabb tanulmányok szoros összefüggést javasolnak a BCAA-k és az inzulinrezisztencia között. Javasolták azokat a mechanizmusokat, amelyek révén a megnövekedett BCAA inzulinrezisztenciát vált ki. A BCAA jelátviteli úttal és a BCAA anyagcserével kapcsolatos új megállapítások tágabbá teszik az inzulinrezisztencia megértését. Az azonban továbbra is bizonytalan, hogy a BCAA-k csupán az inzulinrezisztencia markerei, vagy közvetlenül hozzájárulnak-e az inzulinrezisztenciához, és ez a kérdés fokozott kutatási érdeklődést vált ki. Ezenkívül a BCAA jelátviteli útjai és metabolizmusa terápiás célpont lehet az inzulinrezisztencia és a T2DM kezelésében.
Köszönetnyilvánítás
Ezt a felülvizsgálatot az Alapkutatási Program támogatta az Oktatási Minisztérium által finanszírozott Koreai Nemzeti Kutatási Alapítvány (NRF) révén, valamint a Gachoni Egyetem Gil Orvosi Központja (Támogatás száma: 2015-15).
- TYROSINE N-ACETYL-TYROSINE TYROSINE 500 MG (100 KAPS) AMINOSAVAK ALINESS iNatural - Healthy Shop
- A tested; s Válasz az inzulin szerepének rágására és kiköpésére; Az evészavarok tudománya
- Az aminosavak terápiás hatásai a májbetegségekben Jelenlegi tanulmányok és jövőbeli perspektívák
- Milyen egészségügyi előnyei vannak a glicin-aminosavaknak?
- Zsigeri zsír (aktív zsír) - a zsír típusai, inzulinrezisztencia; Egészségügyi kockázatok