Az Eleutheroside E, az Eleutherococcus senticosus aktív összetevője, javítja az inzulinrezisztenciát a 2-es típusú diabéteszes db/db egerekben
Jiyun Ahn
1 Anyagcsere és táplálkozás kutatócsoport, Koreai Élelmiszer-kutató Intézet, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Koreai Köztársaság
Min Young Um
1 Anyagcsere és táplálkozás kutatócsoport, Koreai Élelmiszer-kutató Intézet, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Koreai Köztársaság
Hyunjung Lee
1 Anyagcsere és táplálkozás kutatócsoport, Koreai Élelmiszer-kutató Intézet, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Koreai Köztársaság
Chang Hwa Jung
1 Anyagcsere és táplálkozás kutatócsoport, Koreai Élelmiszer-kutató Intézet, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Koreai Köztársaság
Seok Hyun Heo
2 Kutatási részleg, Koreai Egészségügyi Kiegészítő Intézet, Seongnam 463-400, Koreai Köztársaság
Tae Youl Ha
1 Anyagcsere és táplálkozás kutatócsoport, Koreai Élelmiszer-kutató Intézet, 516 Baekhyun, Bundang, Seongnam, Gyeonggi 463-746, Koreai Köztársaság
Absztrakt
1. Bemutatkozás
A cukorbetegség olyan anyagcsere-rendellenesség, amelyet hiperglikémia jellemez, és amelyet a máj megnövekedett glükóztermelése, a perifériás szövetekben bekövetkező rendellenes glükózfelhasználás és a nem megfelelő inzulinszekréció okoz [1]. A 2. típusú inzulinrezisztens diabetes mellitus (T2DM) az összes cukorbetegség 90–95% -át teszi ki. Ez a heterogén rendellenesség a nyugati társadalmakban a felnőtt lakosság becsült 6% -át érinti [2]. Számos megközelítést ajánlottak a hiperglikémia csökkentésére, ideértve a hasnyálmirigy inzulin felszabadulásának növelését szulfonilureákkal, a máj glükóztermelésének csökkentését a metformin által, a tiazolidindionok inzulinhatásának fokozását és a bél glükóz felszívódásának elnyomását az a-glükozidáz által. Ezeknek a kezeléseknek azonban korlátozott hatékonysága, a tolerálhatósági problémák nagy valószínűsége és jelentős mechanizmuson alapuló mellékhatások [1].
Az Eleutherococcus senticosust (Rupr. És Maxim.) Harms-nak (ES), Acanthopanax senticosus-nak, szibériai ginzengnek vagy Koreában Gasiogapinak is nevezik. Ez egy jól ismert tonik és nyugtató kínai gyógynövény, amely antibakteriális, fáradtságcsökkentő [3], antioxidáns [4] és immunmoduláló [5] aktivitásával különböző betegségeket érint. Beszámoltak az ES metanol-kivonat hipoglikémiás aktivitásáról is [6]. Azonban melyik funkcionális komponens közvetíti az ES antidiabetikus hatását, továbbra sem ismert.
Beszámoltak arról, hogy az ES-nek számos aktív alkotóeleme van, többek között lignánok (szezamin, eleutheroside E), glikánok (eleutherans, eleutheroside D), triterpén szaponinok (eleutheroside I, K, L és M), szteroid glikozidok (eleutheroside A), hidroxi-kumarinok (izoflaxidin), fenil-akrilsav-származékok (syringin) és flavonok [7].
Az Eleutheroside E (EE) köztudottan csökkenti a fizikai fáradtságot és javítja az állóképesség teljesítményét [3]. Ezenkívül gyulladáscsökkentő hatásáról is beszámolt az NF-κB gátlásával és a szívinfarktus elleni védelemmel [9]. A mai napig azonban az EE hatásait a glükózfelvételre és az inzulinrezisztenciára még nem vizsgálták.
Jelen tanulmányban megmértük az EE hatását a myocső és az inzulinrezisztens adipociták glükózfelvételére. Feltártuk továbbá az ES és az EE hipoglikémiás hatását T2DM db/db egerekben. A vázizomzat inzulin jelátviteli útját és a máj metabolizmusával kapcsolatos gének mRNS expresszióját értékelték az ES és az EE által indukált aktivitás molekuláris mechanizmusainak meghatározására.
2. Anyagok és módszerek
2.1. A növényi kivonat elkészítése és a HPLC elemzések
2.2. Glükózfelvételi vizsgálatok
A C2C12 (ATCC, Manassas, VA, USA) sejteket 10% FBS-sel, 30 μg/ml penicillinnel és 100 μg/ml sztreptomicinnel kiegészített DMEM-ben tartottuk. A C2C12 myoblast differenciálódást úgy indukáltuk, hogy az összefolyó sejteket 2% lószérummal kiegészített DMEM-re cseréltük, és napi közegváltozásokkal lehetővé tettük a myocső kialakulását. A sejteket a differenciálás után 4 nappal használtuk a kísérletekben. A C2C12 sejteket 24 órán át 10 μM syringinnel, EE-vel vagy izoflaxidinnal kezeltük.
A 3T3-L1 fibroblasztokat (ATCC) fenntartottuk és differenciáltuk a korábban leírtak szerint [10]. Az inzulinrezisztencia kiváltása érdekében a differenciált 3T3-L1 adipocitákat 20 ng/ml rekombináns egér TNF-α-val (Sigma Aldrich) kezeltük 6 órán át. Az inzulinrezisztens 3T3-L1 adipocitákat 24 órán át 10 μM EE-vel kezeltük.
Fluoreszcens glükózanalógot, 2- [N- (7-nitrobenz-2-oxa-1,3-diazol-4-il) amino] -2-dezoxi-glükózt (2-NBDG, Invitrogen, Carlsbad, Kalifornia, USA) kaptunk. a glükózfelvétel mérésére szolgál. A fent leírt vegyületeknek való kitettség után 500 µM 2-NBDG-t adtunk a tenyésztő tápközegbe 10 perces inkubálás céljából. A sejteket Krebs pufferrel mostuk, és 100 nM inzulinnal inkubáltuk 10 percig. A válasz leállításához a sejteket jéghideg Krebs pufferrel mostuk, és a 2-NBDG fluoreszcencia intenzitását 480 nm gerjesztési hullámhosszon és 540 nm emissziós hullámhosszon mértük.
2.3. Állatok, intraperitoneális glükóz tolerancia tesztek (IPGTT) és inzulin tolerancia tesztek (IPITT)
Öt hetes hím db/db egereket kaptunk az SLC-től (Hamamatsu, Japán). A db/db egér rendelkezik a leptin receptor mutációjával, és a T2DM metabolikus szindrómájának modellje [11]. 1 hetes akklimatizálás után az egereket 5 hétig AIN-76 alapú étrenden (DM) vagy 0,05% vagy 0,1% ES kivonatot (ESL, ESH, ill.) Vagy 0,003% EE-t tartalmazó étrenden tartottuk. Minden egér testtömegét és 4 órás éhomi vércukorszintjét hetente ellenőriztük.
Öt héttel az etetés után intraperitoneális glükóz tolerancia teszteket (IPGTT) és inzulin tolerancia teszteket (IPITT) hajtottak végre. Az IPGTT-t 2 g D-glükóz/testtömeg-kg intraperitoneális beadásra adott válaszként határoztuk meg 4 órás böjt után. A vércukorszintet a farokvénából 0, 15, 30, 60, 90 és 120 perccel mértük a glükóz beadása után. Az IPITT-t 1,2 NE humán inzulin/testtömeg-kg intraperitoneális beadására adott válaszként határoztuk meg 4 órás böjt után. A vércukorszintet az inzulin beadása után 0, 15, 30, 60, 90 és 120 perccel mértük. A görbe alatti területet (AUC) trapéz módszerrel számoltuk. 5 hét diéta után az egereket 12 órás böjt után feláldoztuk. Valamennyi állatkísérletet a Koreai Élelmiszer-kutató Intézet Intézményi Állattenyésztési és Felhasználási Bizottsága által jóváhagyott protokollnak megfelelően végezték.
2.4. Vérparaméterek
A vércukorszintet, a triglicerideket (TG), a szabad zsírsavakat (FFA), az összkoleszterin (TC) és a nagy sűrűségű lipoproteinek (HDL) szintjét enzimatikusan mértük kereskedelmi készletekkel (Shinyang Chemical Co., Busan, Koreai Köztársaság). A szérum inzulinszinteket ELISA kit segítségével (ALPCO Diagnostics, Salem, NH, USA) mértük. Az inzulinrezisztencia (HOMA-IR) homeosztázis-modelljének értékelését a következő képlet segítségével számoltuk:
2.5. Szövettani vizsgálat
A szövettani elemzésekhez a hasnyálmirigy szöveteit 10% pufferelt formalinban rögzítettük, paraffinba ágyazottuk, metszettük, és hematoxilinnel és eozinnal festettük. A festett területeket fénymikroszkóppal (Olympus, Tokió, Japán) figyeltük meg × 200 nagyítóval. Az immunhisztokémia céljából a hasnyálmirigy-metszeteket paraffinizáltuk és rehidratáltuk, és 25 percig inkubáltuk 70% -os metanolban és hidrogén-peroxidban (H2O2). Tris-pufferolt sóoldattal (TBS, pH 7,3) történő mosás után a metszeteket egy éjszakán át 4 ° C-on inkubáltuk egy inzulinellenes antitesttel (BioGenex, Fremont, CA, USA), 1: 1000 arányban hígítva 10% marha szérumot tartalmazó TBS-ben . A metszeteket 90 percig inkubáltuk tengerimalac-ellenes antitesttel (Vectastain, Vector, Servion, Svájc) 10% szarvasmarha-szérumot tartalmazó TBS-ben (1: 200 hígítás). Mosás után a metszeteket avidin-peroxidáz komplexel (Vectastain) inkubáltuk 15 percig, majd újra mostuk. A metszeteket 5 percig 3,3-diaminobenzidinnel (DAB) festettük, és 30 másodpercig hematoxilinnel ellenfestettük.
A hasnyálmirigyben a relatív béta-sejt térfogatot az anti-inzulin antitesttel festett területnek megfelelő pontok számaként/a megmaradt hasnyálmirigy területének megfelelő pontok számaként írták le.
2.6. Inzulin jelzés
Az inzulinjelzési kísérletekhez az egereket intraperitoneálisan 5 U/kg humán inzulinnal (Sigma Aldrich) injektáltuk egy éjszakán át tartó böjtöt követően. 5 perc elteltével az izomszöveteket eltávolítottuk és folyékony nitrogénben lefagyasztottuk. A szöveteket RIPA pufferben lizáltuk, és a Western blot elemzéseket a korábban leírtak szerint hajtottuk végre [10]. Az alkalmazott primer antitestek közé tartoztak a foszfo-AKT, a foszfo-P70S6 kináz (P70S6K), a foszfo-inzulin receptor béta alegység (IRβ) és a β-aktin (Cell Signaling, Danvers, MA, USA).
2.7. Kvantitatív valós idejű reverz transzkripció-polimeráz láncreakció (qRT-PCR)
2.8. Statisztikai elemzések
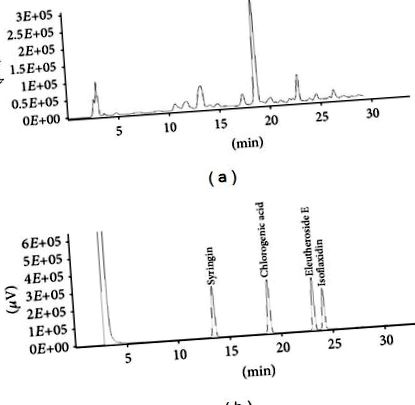
Az eredményeket a sejttanulmányok átlag ± standard deviációjaként (SD) és az állatkísérletek átlag ± standard hibájaként (SEM) fejezzük ki. A statisztikai elemzéseket GraphPad Prism 5 szoftverrel (San Diego, Kalifornia, USA) végeztük. Az egyirányú varianciaanalízist (ANOVA) alkalmazták a kvantitatív adatok összehasonlítására a csoportok között. Bonferroni post hoc tesztet alkalmaztunk, ha az ANOVA szignifikanciát mutatott (P 1. ábra. Az egyes hatóanyagok tartalmát az 1. táblázat tartalmazza. Az ES kivonat 16,78, 64,8 és 10,72 mg/g sziringin, klorogénsav és EE kivonatot tartalmazott. Korábbi kutatások azt mutatják, hogy a sziringin, az EE, a klorogénsav és az izoflaxidin jelentik az ES farmakológiai hatásainak fő összetevőit [12]. Az izoflaxidint azonban nem találtuk ES mintáinkban.
Az E. senticosus (ES) kivonat és funkcionális standard vegyületeinek reprezentatív HPLC-kromatogramja. a) az ES-kivonat HPLC-kromatogramja. (b) A főbb vegyületek HPLC-kromatogramja, beleértve a sziringint, a klorogénsavat, az eleutherosid E-t és az izoflaxidint.
Asztal 1
Az E. senticosus kivonatok funkcionális alkotóelemei.
| 16,78 ± 0,18 | 64,80 ± 0,79 | 10,72 ± 0,19 |
Az adatokat legalább három mérés átlagának ± SD-ként fejezzük ki.
3.2. Az Eleutheroside E fokozza az inzulin által kiváltott glükózfelvételt
Először megvizsgáltuk az ES funkcionális komponenseinek hatását az izom myocsőbe történő glükózfelvételre. Amint a 2. (a) ábra mutatja, a syringin növelte a bazális glükózfelvételt a C2C12 myocsőben. Az EE észrevehetően felerősítette az inzulin által stimulált glükózfelvételt.
3.3. Eleutheroside E tartalmú étrend javítja a cukorbetegséget db/db egerekben
Az EE hiperglikémiára és glükóz intoleranciára gyakorolt hatásának igazolására db/db egeret kiegészítettünk egy kísérleti étrenddel, amely ESL-t, ESH-t vagy EE-t tartalmazott 5 hétig. Az állatok testtömegének változását a kísérleti időszak alatt a 3. ábra (a) mutatja. A testtömeg 5 héten át fokozatosan nőtt, és a kísérleti csoportokba tartozó állatok (ESL, ESH és EE) testtömege szignifikánsan magasabb volt, mint a kontroll állatoké.
2. táblázat
Az ES és az EE hatása a db/db egerek lipidprofiljára.
| Összes koleszterin (mg/dl) | 375,11 ± 74,79 | 238,19 ± 86,42 * | 247,29 ± 45,91 * | 330,59 ± 21,17 |
| Triglicerid (mg/dl) | 180,24 ± 57,19 | 137,89 ± 35,77 | 113,93 ± 20,17 * | 112,35 ± 29,75 * |
| FFA (uEq/L) | 1412,78 ± 74,28 | 1080,16 ± 160,21 * | 1190,08 ± 102,30 | 1072,38 ± 269,91 * |
| Glükóz (mg/dl) | 486 ± 21,53 | 397,8 ± 29,30 * | 389,2 ± 21,24 * | 315,0 ± 24,67 * |
| Inzulin (ng/ml) | 8 ± 1,8 | 2,81 ± 0,71 * | 4,28 ± 1,29 * | 3,56 ± 0,41 * |
| HOMA-IR | 75,89 ± 13,64 | 36,49 ± 12,22 * | 42,79 ± 15,95 * | 33,5 ± 6,63 * |
Valamennyi értéket átlag ± SEM-ben fejezzük ki. A hathetes db/db egereket 5 hétig kísérleti táplálékkal etették, amely nem tartalmazott 0,05–0,01% E. senticosus (ES) kivonatot és 0,1% eleutheroside E (EE).
DM: diabetes mellitus csoport; ESL: 0,05% ES kivonattal kiegészített csoport; ESH: 0,1% ES kivonattal kiegészített csoport; EE: 0,003% eleutheroside E-kiegészítő csoport.
* P A 3. (c) ábra szerint mind az ES, mind az EE javította a csökkent glükóz toleranciát, bár az ES kezelés nem érte el a statisztikai szignifikanciát. A görbe alatti terület (AUC) 17,7% -kal, 22,6% -kal és 43,9% -kal csökkent az ESL-, ESH- és EE-csoportokban, szemben a diabéteszes kontrollcsoporttal.
Az IPITT (3. ábra (d) ábra) esetében az ES és az EE kezelés mérsékelten enyhítette az inzulin károsodását a diabéteszes kontrollcsoporthoz képest. Az IPITT AUC-értéke szignifikánsan csökkent az EE-vel kezelt egerekben a diabéteszes kontroll egerekhez képest. Ezek az eredmények együttesen azt jelzik, hogy az ES-nek és az EE-nek hipoglikémiás hatása van és javítja a glükóz toleranciát.
Feltételeztük, hogy a glükóz tolerancia javulása ES és EE által a β-sejtek működésének védelme miatt következett be. Ennek a hipotézisnek a teszteléséhez megvizsgáltuk az ES és az EE hatását a hasnyálmirigy α- és β-sejtjeinek működésére (4. ábra (a)). A β-sejtek inzulintartalmát immunkémia alkalmazásával határoztuk meg, és megállapítottuk, hogy az ESL és az EE hatékonyan megakadályozta a β-sejtek diabéteszes veszteségét (4. ábra (b)). Ezenkívül az ESL és az EE enyhítette az a-sejtek károsodását, amit immunohisztológiai glükagon festés igazolt (4. ábra (a)). Ezek az eredmények arra utalnak, hogy az ES és az EE kiegészítése hatékonyan megakadályozza a hasnyálmirigy α- és β-sejtjeinek diabéteszes károsodását.
Az ESL (a) és az EE (b) hatása a vázizmok inzulinjelzésére. Az IRβ, az AKT és a P70S6K inzulin által indukált foszforilezésének elemzését Western blot módszerrel végeztük. Egy éjszakán át tartó böjtöt követően az egereket vagy feláldoztuk, vagy 5 U/kg inzulinnal injektáltuk őket. Öt perccel az injekció beadása után az izomszöveteket összegyűjtöttük és az összes fehérjét elemeztük. Az egyes fehérjék foszforilezési helyét meg kell jelölni.
Végül megvizsgáltuk az ES és az EE hatását a máj glükóz metabolizmusára a glikolízisben és a glükoneogenezisben szerepet játszó gének expressziójának mérésével. Amint a 6. (a) ábrán látható, az ESL és az EE kiegészítés jelentősen megnövelte a glükokináz és a 6-foszfofruktokináz mRNS expresszióját. Ezzel szemben az ESL és az EE jelentősen csökkentette a G6Pase és a PEPCK mRNS expresszióját (6. ábra (b)). Ezek az adatok azt mutatják, hogy az ES és az EE javította a glükóz anyagcserét a glikolízis szabályozásával és a glükoneogenezis downregulációjával cukorbeteg egerekben.
Az ESL és az EE hatása a máj glükóz metabolizmusára. (a) bemutatjuk a glikolízissel kapcsolatos gének, a glükokináz és a 6-foszfofruktokináz mRNS-expresszióját. (b) bemutatjuk a glükoneogenezissel kapcsolatos gének, a G6Páz és a PEPCK mRNS-expresszióját. Az egyes gének 18S génné történő normalizálása után az mRNS-szinteket a cukorbeteg egerek százalékában fejezzük ki. Az értékek az átlag ± SEM értékét jelzik. * P Moller DE. Új gyógyszercélok a 2-es típusú cukorbetegség és a metabolikus szindróma szempontjából. Természet. 2001; 414 (6865): 821–827. [PubMed] [Google Tudós]
- A zsírmáj központi szerepe az elhízott serdülők cukorbetegségének inzulinrezisztenciájának patogenezisében
- Ellenpont a zsigeri zsírosság nem okoz ok-okozati összefüggést az inzulinrezisztencia cukorbetegség ellátásával
- A gamma-aminovajsavval dúsított rizskorpás étrend gyengíti az inzulinrezisztenciát és kiegyensúlyozza az energiát
- Az elhízás hibás máj-autofágiája elősegíti az ER stresszt és inzulinrezisztenciát okoz -
- A magas fehérjetartalmú étrend hatása a glikémiás kontrollra, az inzulinrezisztenciára és a 2. típusú vérnyomásra