Az elhízás és az inzulin hatása az immunitásra nem inzulinfüggő diabetes mellitusban
Absztrakt
Célkitűzés: Megérteni az elhízás és az inzulin immunfunkciókra gyakorolt hatását nem inzulinfüggő diabetes mellitusban (NIDDM).
Tantárgy: Tizennégy elhízott NIDDM (testtömeg-index (BMI) = 30,6 ± 1,1), hét nem elhízott NIDDM (BMI = 24,2 ± 0,5) és öt elhízott, nem NIDDM (BMI = 28,3 ± 0,67).
Beavatkozások: Először az inzulin hatását vizsgáltuk több emberi sejtvonal szaporodására. Másodszor, összehasonlítottunk számos immunfunkciót elhízott és nem elhízott NIDDM, valamint elhízott, nem NIDDM betegek között, perifériás vér mononukleáris sejteket használva.
Eredmény: Az inzulin csökkentette a T-sejtvonalak szaporodását, de más típusú sejtvonalaké nem. Ezenkívül az elhízás fokozta az IL-1β termelését, amely citotoxicitással bírhat a NIDDM szigeti β sejtjeivel szemben.
Következtetés: Adataink azt sugallják, hogy a NIDDM patofiziológiáját befolyásolhatja az elhízás miatti immunitásváltozás, és az NIDDM-ben az elhízás kezelése immunológiai szempontból fontos lehet.
Bevezetés
Beszámoltak arról, hogy az elhízásban számos immunfunkció szabályozatlan (Tanaka és mtsai, 1993; Nieman és mtsai, 1999). Elhízott alanyok és genetikailag elhízott állatok vizsgálatában a limfociták száma és a proliferatív válaszok alacsonyabbak voltak, mint a kontrollokban (Tanaka és mtsai, 1993, 1998; Nieman és mtsai, 1999). Beszámoltunk arról is, hogy a diéta által kiváltott elhízott egerekben megváltozott a citokin-egyensúly (Mito és mtsai, 2000). Az elhízás károsodott immunitását befolyásoló mechanizmus és tényezők azonban nem teljesen ismertek.
Bár a nem inzulinfüggő diabetes mellitus (NIDDM) betegek gyakran elhízottak, az elhízással járó NIDDM immunfunkcióját nem vizsgálták. Az elhízás számos metabolikus és endokrinológiai tényezőt megváltoztathat, mint például az inzulin, a leptin vagy a kortikoszteron, amelyek befolyásolhatják az immunfunkciókat (Hunt & Eardley, 1986; Brinkmann & Kristofic, 1995; Loffreda et al, 1998; Lord et al, 1998; Martin -Romero és mtsai, 2000). Az inzulin mind a NIDDM, mind az elhízás szempontjából fontos tényező, azonban az inzulin immunrendszerben betöltött szerepe nem egyértelmű ezekben az állapotokban.
A különböző immunsejtek által kiválasztott inter-leukin (IL) -1β az egyik fontos mediátor, amely szabályozza a gazda gyulladásra és immunitásra adott válaszát (Dinarello, 1984; Dinarello és Mier, 1987). Mivel ez a citokin citotoxikus az inzulintermelő β-sejtekre (Mandrup-Poulsen és mtsai, 1986), elhízással vizsgáltuk az IL-1β termelés változását a NIDDM-ben.
A vizsgálat célja az inzulin immunsejtekre gyakorolt hatásának vizsgálata volt in vitro, valamint a PBMC-k proliferatív válaszának és IL-1β termelésének megváltozása elhízott NIDDM betegeknél annak érdekében, hogy tisztázzák az elhízás immunitásra gyakorolt hatását a NIDDM-ben. Ez egy új tanulmány az elhízott és nem elhízott NIDDM betegek immunológiai különbségének kezelésére.
Anyagok és metódusok
Az emberi sejtvonalak vizsgálata
A sejtvonalak proliferatív válaszai
Humán leukémiás sejtvonalakat, HUT-102 és MOLT-4 (T-sejt), RAJI (B-sejt) és U937 (monocita) sejteket használtunk ebben a vizsgálatban. A sejteket RPMI-1640 táptalajban (NISSUI, Tokió, Japán) tartottuk, amely 10% hő-inaktivált borjúmagzati szérumot tartalmaz (JRH, Lenaxa, Ausztrália). Ezeknek a sejteknek a szaporodását egy 3- (4, 5-dimetil-tiazol-2-il) -2,5-difenil-tetrazolium-bromid (MTT) módszerrel vizsgáltuk 72 órán át tartó inkubálás után (Mito et al., 2000) inzulinnal (0; 0,01, 0,1, 1, 10, 100 vagy 1000 ng/ml). MTT-oldat (200 μg/ml) hozzáadása után a sejteket 3 órán át 37 ° C-on 5% CO2-atmoszférában inkubáltuk. Az MTT – amazon termék képződését 10% SDS – 0,01 N HCl hozzáadásával oldottuk fel. Az egyes üregek optikai sűrűségét 550 és 650 nm vizsgálati és referencia hullámhosszakkal mértük. A maximális válasz és a sejtek tenyésztési idejét a vizsgálat előtt határoztuk meg, és a sejtvonalak között nem volt különbség.
Emberi betegek vizsgálata
Tárgyak
Tizennégy elhízott és hét nem elhízott NIDDM beteg és öt elhízott, nem NIDDM alany vett részt a vizsgálatban. Minden beteg nő volt. A betegség időtartama nem különbözött az elhízott és a nem elhízott NIDDM között. NIDDM-ben szenvedő betegeket egy kivételével orális antidiabetikus szerekkel kezeltek. A betegek klinikai profilját az 1. táblázat foglalja össze. Minden betegnél tájékozott beleegyezést kaptunk.
Sejtek előkészítése
A vérmintákat a vizsgálat után azonnal feldolgozták a vizsgálat céljából. A perifériás vér mononukleáris sejtjeit (PBMC) a heparinizált vérből HISTOPAQUE-1077 sűrűséggradiens centrifugálással izoláltuk (Sigma, St Louis, MO, USA).
A PBMC-ket 106 sejt/ml sűrűségre állítottuk be RPMI-1640 táptalajjal, amely 5% hő-inaktivált borjúmagzati szérumot, L-glutamint (2 mM, GIBCO, Grand Island, NY, USA), penicillint (100 U/ml) tartalmazott., Streptomicin (100 μg/ml, GIBCO), és fitohemagglutininnel vagy anélkül (PHA; 1 μg/ml, DIFCO, Detroit, MI, USA) tenyésztettük 48 vagy 72 órán át 37 ° C-on, 5% -ban CO2 légkör.
A PBMC-k proliferatív válaszai
72 órás tenyésztés után a PBMC-k proliferatív válaszát MTT vizsgálattal mértük (Mito és mtsai, 2000). Az adatokat a mitogénnel stimulált tenyészetek abszorbanciaképességének és a nem stimulált tenyészetek abszorpcióképességének arányában fejezzük ki (stimulációs indexnek nevezzük). A maximális válaszhoz szükséges PBMC-k tenyésztési idejét a vizsgálat előtt határoztuk meg, és nem különbözött három csoport között.
Citokintermelés és mérés
A PBMC felülúszókat 48 óra tenyésztés után összegyűjtöttük, centrifugáltuk és -30 ° C-on tároltuk az elemzésig. A citokintermelés mérésére enzimhez kapcsolt immunszorbens vizsgálatokat (ELISA) hajtottunk végre tenyészet felülúszóin. Az IL-1β méréséhez ELISA kitet használtunk (Otsuka, Tokió, Japán). Az ebben a vizsgálatban alkalmazott ELISA-vizsgálat tartománya 15,6–500 pg/ml volt. A PBMC-k optimális inkubációs idejét a citokin termeléshez a vizsgálat előtt határozták meg.
Statisztikai analízis
Az eredményeket átlagként ± s. Statisztikai összehasonlítást végeztek három betegcsoport között a klinikai profilok, a limfocita proliferatív válaszok és a PBMC-k citokintermelésének paramétereiben, ANOVA alkalmazásával, és mindegyik csoportot Fisher által védett legkevésbé szignifikáns teszttel hasonlították össze.
Eredmények
Az emberi sejtvonalak vizsgálata
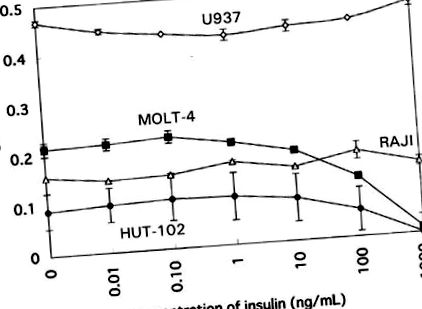
Emberi sejtvonalakban az inzulin magas koncentrációja (> 10–100 ng/ml) csak a T-sejtvonalak, például a MOLT-4 és a HUT-102 szaporodását gátolta. A szuppresszió dózisfüggő volt a 10 ng/ml koncentráció felett. A B-sejtvonal (Raji) vagy a monocita sejtvonal (U937) szaporodását semmilyen inzulinkoncentráció nem befolyásolta (1. ábra). Ezek az eredmények arra utalhatnak, hogy a T-sejtvonalak szelektív érzékenységet mutatnak az inzulinra.
Az inzulin hatása az emberi sejtvonalak, a HUT-102, a MOLT-4, az U937 és a RAJI proliferatív válaszára.
Emberi betegek vizsgálata
Klinikai profil
Három csoport (elhízott NIDDM, nem elhízott NIDDM és elhízott, nem NIDDM betegek) klinikai profilját az 1. táblázat mutatja. A nem elhízott NIDDM-hez képest az elhízott NIDDM és az elhízott nem NIDDM testtömeg-indexe (BMI) szignifikánsan magasabb volt és nagyobb súlyú. Magas HbA1c szintet találtak mindkét NIDDM csoportban. A szérum éhomi inzulinszintje nem elhízott NIDDM-ben szignifikánsan magasabb volt, mint az elhízott NIDDM-ben.
A PBMC-k proliferatív válaszai
A PBMC-k proliferatív válaszai PHA stimulációval nem különböztek elhízott és nem elhízott NIDDM betegek között. Az elhízott nem NIDDM-ben a proliferatív válasz alacsonyabb volt, mint az elhízott és nem elhízott NIDDM-ben, bár szignifikáns különbséget figyeltek meg (2. táblázat).
Citokintermelés PBMC-kből
A PBMC-k által végzett citokintermelésben az elhízott NIDDM-ben (216,4 ± 27,18 pg/ml) és az elhízott, nem NIDDM-ben (279,6 ± 71,56 pg/ml) az IL-1β szignifikánsan megnőtt a nem elhízott NIDDM-mel (98,0 ± 19,09 pg/ml); P
Vita
A NIDDM-es betegeknél fokozottan fordul elő fertőzések az immunitás romlása miatt (Plouffe és mtsai, 1978; Feng-Yee és Men-Fang, 1995; Reyzelman és mtsai, 1999). Az immun-kompetens sejteket több endokrin hormon szabályozhatja, beleértve az inzulint is, a felület-specifikus receptorok megkötésével (Kiess & Belohradsky, 1986). Ezért feltételezzük, hogy az immunrendszer változása a NIDDM-ben az endokrin homeosztázis változásával jár. Eközben az elhízás károsodott T-sejtszámmal és proliferációval jár együtt (Tanaka és mtsai, 1993; Nieman és mtsai, 1999). Már beszámoltunk arról, hogy a diéta okozta elhízott egerekben megváltozott a citokin-egyensúly (Mito és mtsai, 2000). Mivel a NIDDM-nek és az elhízásnak jellegzetes metabolikus változásai vannak, például változások az inzulinban, a leptinben vagy a kortikoszteronban, lehetséges, hogy az elhízással rendelkező NIDDM immunfunkciói eltérhetnek a normál testtömegű NIDDM-től.
Az emberi sejtvonalak vizsgálatában az exogén inzulin nagy koncentrációban csökkentette a T-sejtvonalak, például a MOLT-4 és a HUT-102 proliferációját, de nem volt hatással a B-sejt és a monocita-sejtvonalakra. Az inzulin hatása más sejtvonalak (HL-60 és K562) szaporodására szintén nem volt megfigyelhető (az adatokat nem mutatjuk be). Ez azt sugallja, hogy az inzulin hatása sejttípusonként vagy az immunsejtek differenciálódásának különböző szakaszaiban eltérő lehet. A T-sejtvonalak különösen érzékenyek lehetnek az inzulinra. E tekintetben egy korábbi tanulmány arról számolt be, hogy a szuperfiziológiai inzulinkoncentráció in vitro csökkentette a limfociták, különösen a CD45RO +, összes számát, de nem változtatta meg a CD45RA +, CD4 + vagy CD8 + értékeket (Kappel és mtsai, 1998).
Hivatkozások
Brinkmann V., Kristofic C. 1995 A Th1 és Th2 citokintermelés kortikoszteroidokkal történő szabályozása humán CD4 + effektor T-sejtekben, CD45RO− és CD45RO + alcsoportokból J. Immunol. 155: 3322–3328
Bunout D, Munoz C, Lopez M, de la Maza képviselő, Schlesinger L, Hirsch S, Pettermann M. 1996 Interleukin 1 és tumor nekrózis faktor elhízott alkoholistákban a normál testsúlyú betegeknél Am. J. Clin. Nutr. 63: 373–376
Ciampolillo A, Guastamacchia E, Caragiulo L, Lollino G, Robertis OD, Lattanzi V, Giorgino R. 1993 In vitro interleukin-1β és interferon-γ szekréciója perifériás vér limfomononukleáris sejtjeiben cukorbetegeknél Diabetes Res. Clin. Gyakorlat. 21: 87–93
Clausell N, Kalil P, Biolo A, Molossi S, Azevedo M. 1999 A tumor nekrózis faktor-alfa fokozott expressziója diabéteszes macrovasculopathiában Cardiovasc. Pathol. 8.: 145–151
Considine RV, Sinbe MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, ohannesian JP, Marco CC, Mckee LJ, Bauer TL, Garo JF. 1996 Szérum immunreaktív leptin koncentráció normál testsúlyú és elhízott embereknél New Engl. J. Med. 334: 292–295
Davaraj S, Jialal I. 2000 Kis sűrűségű lipoprotein posztszekréciós módosítás, monocita funkció és keringő adhéziós molekulák 2-es típusú cukorbetegeknél, makrovaszkuláris szövődményekkel vagy anélkül: az alfa-tokoferol kiegészítés hatása Keringés 102: 191–196
Dinarello C. 1984 Interleukin-1 és az acte-fázisú válasz patogenezise New Engl. J. Med. 311: 1413–1418
Dinarello C, Mier J. 1987 Lymphokines New Engl. J. Med. 317: 940–945
Feng-Yee C, Men-Fang S. 1995 Csökkent sejt-közvetített immunitás nem inzulinfüggő diabetes mellitusban szenvedő betegeknél Diabetes Res. Clin. Gyakorlat. 28.: 137–146
Frederichi RC, Hamann A, Anderson S, Lollmann B, Lowell BB, Flier JS. 1995 A leptinszintek tükrözik a test lipidtartalmát egerekben: bizonyíték a diéta által kiváltott leptin-rezisztenciára Nature Med. 1: 1311–1314
Helderman JH. 1981 Az inzulin szerepe az aktivált timiás eredetű limfociták közbenső metabolizmusában J. Clin. Invest. 67: 1636–1642
Helderman JH, Raskin P. 1980 A T-limfocita inzulinreceptor cukorbetegségben és elhízásban: belső kötődési hiba Cukorbetegség 29.: 551–557
Holden RJ, Mooney PA. 1995 Interleukin-1β: az Alzheimer-kór és a diabetes mellitus gyakori oka Med. Hipotézisek 45: 559–571
Hunt P, Eardley D. 1986 Az inzulin és az inzulinszerű növekedési faktor-1 (IGF1) szuppresszív hatása az immunválaszokra J. Immunol. 136: 3994–3999
Kappel M, Dela F, Barington T, Galbo H, Pedersen BK. 1998. Hyperinsulinaemiás euglycaemiás inzulin bilincs immunológiai hatásai egészséges férfiaknál Scand. J. Immunol. 47: 363–368
Kiess W, Belohradsky BH. 1986 Az immunrendszer endokrin szabályozása Klin. Wochenschr. 64.: 1–7
Loffreda S, Yang SQ, Lin HZ, Karp GL, Brengman ML, Klein AS, Bulkley GB, Bao C, Noble PW, Lane MD. 1998 A leptin szabályozza a gyulladásos immunválaszokat F.A.S.E.B. J. 12.: 57–65
Lord GM, Matares G, Howard JK, Baker RJ, Bloom SR, Lechler RI. 1998 A leptin modulálja a T-sejt immunválaszt, és megfordítja az éhezés által kiváltott immunszuppressziót Természet 394: 897–901
Mandrup-Poulsen T, Bendtzen K, Nerup J, Dinarello C, Svenson M, Nielsen J. 1986 Affinitással tisztított humán interleukin-1 citotoxikus az izolált Langherans-szigetekre Diabetologia 29.: 63–67
Martin-Romero C, Santos-Alvarez J, Goberna R, Sanchez-Margalet V. 2000 Az emberi leptin fokozza az emberi keringő T-limfociták aktiválódását és szaporodását Cell Immunol. 199: 15–24
Mito N, Hosoda T, Chiaki K, Sato K. 2000 A citokin egyensúly változása az étrend okozta elhízott egerekben Anyagcsere 49: 1295–1300
Mohamed-Ali V, Pinkney J, Coppack S. 1998 A zsírszövet mint endokrin és parakrin szerv Int. J. Obes. Relat. Metab. Disord. 22.: 1145–1158
Nieman DC, Henson DA, Nehlsen-Cannarella SL, Ekkens M, Utter AC. 1999 Az elhízás hatása az immunfunkcióra J. Am. Diéta. Assoc. 99: 294–299
Plouffe JF, Silva J Jr, Fekety R, Allen JL. 1978 Sejtközvetített immunitás diabetes mellitusban Fertőz. Immun. 21: 425–429
Reyzelman A, Lipsky B, Hadi S, Harkless L, Armstrong D. 1999 Az A csoportba nem tartozó streptococcusok által okozott súlyos nercotizáló fertőzések megnövekedett előfordulása J. Am. Podiat. Med. Assoc. 89: 454–457
Santos-Alvarez J, Goberna R, Sanchez-Margalet V. 1999 Az emberi leptin serkenti az emberi keringő monociták proliferációját és aktivációját Cell Immunol. 194: 6–11
Tanaka S, Inoue S, F Isoda, Waseda M, Ishihara M, Yamakawa T, Sugiyama A, Takamura Y, Okuda K. 1993 Az immunitás romlása az elhízásban: elnyomott, de visszafordítható limfocita válaszkészség Int. J. Obes. Relat. Metab. Disord. 17.: 631–636
Tanaka S, Isoda F, Yamakawa T, Ishihara M, Sekihara H. 1998 T limfopénia genetikailag elhízott patkányokban Clin. Immunol. Immunopathol. 86: 219–225
Varner AE. 2000 Az elhízás és az asztma közötti összefüggés immunológiai mechanizmusa Boltív. Gyakornok. Med. 160: 2395
- Az elhízás okozza a 2-es típusú cukorbetegséget (T2DM), vagy éppen ellenkezőleg Malone - 2019 - Gyermekgyógyász
- Bőrbetegségek cukorbetegségben és elhízásban szenvedő gyermekeknél - ScienceDirect
- Az elhízás és a cukorbetegség epidemiológiája és kardiovaszkuláris szövődményei Keringéskutatás
- KILÉPÉS; nbsp; Az elhízás 2020-ban erősebb kockázati tényező a cukorbetegség szempontjából, mint a poligén hajlam
- Konszenzusos nyilatkozat Elhízás és 2. típusú cukorbetegség Mi lehet egységes és mi kell annak