Az elhízást szabályozó agyjelző út gének azonosítva
Nemzetközi kutatócsoport azonosított olyan jelzőfehérjéket, amelyek az agy hipotalamuszában hatnak a súlykontrollban részt vevő idegsejtek fejlődésének irányítására. Sadaf Farooqi, PhD, FRCP, FMedSci, az Egyesült Királyság Cambridge-i Egyetem professzora és Sebastien Bouret, PhD, az endokrinológia, a cukorbetegség és az anyagcsere kutatója által vezetett tanulmányok a Los Angeles-i Gyermekkórházban (CHLA) ritka mutációkat azonosítottak 3. osztályú szemaforinokhoz (SEMA3) súlyosan elhízott embereknél. A későbbi tenyésztett sejtekben végzett kísérletek, valamint a géntechnológiával módosított zebrafish és egerek vizsgálata azt mutatta, hogy a SEMA3 által közvetített jelátvitel a hipotalamuszban melanokortin áramkörök kialakulását hajtja végre, amelyek részt vesznek az energia homeosztázisában.
"Most felfedeztük azokat a géneket, amelyek megalapozzák a pontos idegi kapcsolatokat, amelyek ezeket az áramköröket alkotják" - kommentálta Agatha van der Klaauw PhD, aki a Farooqi laboratóriumában vezette a tanulmányt, és aki a kutatók Cellben megjelent cikkének társszerzője. "Ez a munka új betekintést nyújt az étvágyat és az anyagcserét szabályozó hipotalamusz áramkörök fejlesztésébe." A csapat tanulmányát és megállapításait egy cikkben írta le: „Az emberi szemaforin 3 változatai összekapcsolják a melanokortin áramkörök fejlesztését és az energiaegyensúlyt”.
A hipotalamuszban található idegi áramkörök kritikus szerepet játszanak az energia homeosztázis szabályozásában, a melanocortin neuronok pedig "sarkalatos" szerepet töltenek be a súlyszabályozásban - írták a szerzők. "Tudjuk, hogy az agynak, különösen a hipotalamusz nevű területnek nagyon fontos szerepe van az étkezés és a vércukorszint szabályozásában" - magyarázta Bouret, aki a Keck Orvostudományi Kar gyermekgyógyászati docense is. Dél-Kaliforniai Egyetem. A tudósok évek óta tanulmányozzák a hipotalamusz szerepét az elhízásban, amely állapot csak az Egyesült Államokban csaknem 14 millió gyermeket és serdülőt érint. Amit a tudósok még nem értenek, jegyezte meg Bouret, az, hogy miként szerveződnek ezek a kapcsolások a hipotalamuszban. "Szeretnénk tudni, hogy az agy hogyan állítja össze magát, és mi irányítja pontosan ezt a folyamatot." Annak megértése, hogy a hipotalamusz agysejtjei hogyan alkotnak nagyon specifikus és összetett kapcsolatokat, és hogyan lehet ezt a folyamatot megzavarni, megvalósítható betekintést nyújthat a gyermekkori elhízás és a hipotalamusz rendellenességeinek kialakulásába.
A 3. osztályú szemaforinok részt vesznek a hipotalamusz neuronjainak specifikus részhalmazainak kialakulásában, és már ismert, hogy a jelátvitelt megzavaró SEMA3 gének ritka variánsai emberben hipogonadotrop hipogonadizmussal társulnak, olyan állapotban, amelyben a herék és a petefészkek nagyon keveset termelnek., vagy nincsenek nemi hormonok. A csapat feltételezte, hogy ha a SEMA3-kat és azok receptorait kódoló gének hozzájárulnak az emberek testtömegének szabályozásában részt vevő idegsejtek kialakulásához, akkor néhány súlyos korai elhízásban szenvedő ember hordozhatja e gének funkcionális variánsait.
Amikor 573 súlyos korai elhízásban szenvedő egyén kezdeti sorozatának szekvenálási adatait elemezték, 40 ritka változatot találtak a szemaforin szignálozásban részt vevő 13 génben. Úgy találták, hogy ezek a nagyon ritka funkcionális variánsok gazdagabbak egy nagyobb, 982 súlyosan elhízott egyedből álló csoportban (amelybe a kezdeti 573 ember is beletartozott), összehasonlítva 4449 egészséges kontrollal. A SEMA3 jelátviteli génvariánsok több molekuláris mechanizmus révén megzavarják a normális jelátvitelt. "A SEMA3 sok változata csökkentette a szekréciót és/vagy a receptor által közvetített jelátvitelt" - jegyezték meg a tudósok. Elismerték, hogy a variánsok ritkasága miatt az egyesületek nem értek el statisztikai szignifikanciát egyetlen gén szintjén, ezért nagyobb léptékű összehasonlításokra lesz szükség.
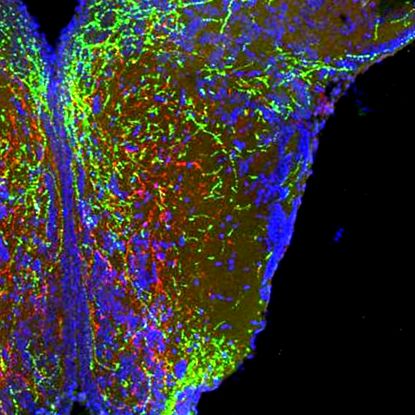
A szemaforinok kommunikációs rendszerként működnek az agysejtek között, ami egyfajta útitervnek tekinthető, amely a sejteket más sejtek felé irányítja, vagy azoktól távol tartják őket. Annak érdekében, hogy mi történjen, amikor ezt a térképet inaktiválják, Sophie Croizier, PhD, aki Bouret laboratóriumában vezette a munkát, blokkolta a szemaforin szignalizációt a laboratóriumban növesztett hipotalamusz sejtekben, és megállapította, hogy az agysejtek már nem úgy nőttek, ahogyan kellett volna és hogy a cellák közötti kapcsolatokat nem sikerült létrehozni.
A csapat ezután a CRISPR technológiát használta a korábban azonosított szemaforinnal szignalizációval kapcsolatos gének megzavarására a nagyon korai zebrafish embriókban. A tesztek azt mutatták, hogy hét gén deléciója társult azzal, hogy az állatok testtömegük és/vagy zsíruk megnövekedett. A mérnökölt egerek felhasználásával végzett további kísérletek hasonlóan azt mutatták, hogy a SEMA3 szignálozás szempontjából releváns gének megzavarása súlygyarapodást is eredményezett. "Azt látjuk, hogy a szemaforinok irányítják és alakítják a hipotalamusz áramkörök fejlődését, amelyek végső soron szabályozzák a kalóriabevitelt" - magyarázta Bouret.
"Ebben a tanulmányban ritka heterozigóta variánsokat azonosítottunk a SEMA3-ban, azok receptoraiban és társreceptoraiban olyan korai elhízásban szenvedő egyéneknél" - összegezték a szerzők. „A zebrafish-ban megmutattuk, hogy több gén deléciója ezen az úton megnövelte a súlyhoz kapcsolódó fenotípusokat, ami szerepet játszik ezeknek a molekuláknak az energia homeosztázisban. Ezek a gének számos lehetséges mechanizmus segítségével módosíthatják a testtömeget és/vagy a zsírtömeget ... Ezek a tanulmányok összesítve azt mutatják, hogy a SEMA3 által közvetített jelátvitel hajtja az energia homeosztázisban részt vevő hipotalamusz melanokortin áramkörök kialakulását. "
- Az új vizsgálat az MRI-t használja az elhízás és az agyi jelzés tanulmányozására a pulzuson lévő gyermekeknél
- Elhízott jelzés útja - Kreatív diagnosztika
- Áttétes agydaganatok; Tájékoztató lapok; Yale Medicine
- Táplálja az agyát
- A szülők olyan rendkívüli vegán étrendre helyezték a babát, amely agykárosodást szenvedett - World News -