Az emberi elhízás zsírszöveti mitokondriális diszfunkciója egy specifikus DNS-metilációs aláírással kapcsolódik a zsírszármazékokból származó őssejtekben
Tárgyak
Absztrakt
Háttér
Az adipocita prekurzorok funkcionális populációja, az úgynevezett zsírszármazékokból származó stroma/őssejtek (ASC) döntő fontosságú a zsírszövet (AT) megfelelő terjeszkedése, a lipidkezelés és a krónikus pozitív energiaegyensúlyra adott lipotoxicitás megelőzése szempontjából. Korábban kimutattuk, hogy az elhízott emberi alanyok diszfunkcionális ASC-készletet tartalmaznak. Az ASC rendellenes működésének hátterében álló mechanizmusok tisztázása terápiás beavatkozásokhoz vezethet a lipotoxicitás megelőzéséhez az ASC adipogén képességének javításával.
Mód
Az epigenómára kiterjedő asszociációs tanulmányok segítségével feltártuk az elhízás hatását az emberi ASC-k és differenciált társaik metilációs aláírására. A sovány és elhízott ASC-k mitokondriális fenotipizálását végeztük. TBX15 A funkcióvesztés és a funkció elnyerése kísérleteket hajtottunk végre, a mitokondriumok Western blot- és elektronmikroszkópos vizsgálatait fehér AT biopsziákban végeztük sovány és elhízott személyektől.
Eredmények
Megállapítottuk, hogy az adipocita prekurzorok DNS-metilációját jelentősen módosítja az elhízott környezet, és az adipogenezis, a gyulladás és az immunszuppresszió volt a leginkább érintett útvonal. Emellett azonosítottuk TBX15 mint az elhízott ASC-k egyik legkülönbözőbb hipometilezett génje, és genetikai kísérletek azt tárták fel TBX15 az elhízott adipociták mitokondriális tömegének szabályozója. Ennek megfelelően az AT morfológiai elemzése elhízott alanyoktól a mitokondriális hálózat változását mutatta, változásokkal a mitokondriális alakban és számban.
Következtetések
Az elhízással összefüggő adipocita prekurzorokban azonosítottunk egy DNS metilációs szignált, amely jelentős hatással van az érett adipociták metabolikus fenotípusára.
Bevezetés
Az elhízás komoly közegészségügyi problémává vált, mivel számos betegség kockázati tényezője, beleértve a 2-es típusú cukorbetegséget (T2D), a szív- és érrendszeri betegségeket és a rák egyes formáit. Ma már felismerték, hogy az elhízás, amelyet hagyományosan elsősorban az energiabevitel és a zsírraktározást elősegítő kiadások közötti egyensúlyhiányból erednek, a környezeti és genetikai tényezők közötti kölcsönhatásból ered. Valójában egyre több bizonyíték támasztja alá az epigenetikát, mint az elhízás és társbetegségei mögött álló gén-környezet kölcsönhatások kulcsszereplő mechanikus közvetítőjét [1].
A fehér zsírszövet (WAT) feltehetően a test legplasztikusabb szerve. A krónikus pozitív energiamérlegre reagálva a WAT kibővül azáltal, hogy megnöveli a már létező adipociták mennyiségét (hipertrófia), és új adipocitákat generál (hiperplázia) az adipocita progenitorok toborzása révén, amelyeket zsírszármazékból származó sztróma/őssejteknek (ASC) neveznek. perivascularis WAT stromában. Az ASC-k adipogenezison mennek keresztül, és érett adipocitákká differenciálódnak, hogy fenntartsák az adipocita-forgalmat normális anyagcsere-állapot alatt [2]. A rendelkezésre álló információk azt sugallják, hogy a diszregulált adipogenezis miatt a WAT homeosztázis obezogén kontextusban zavart [3], alátámasztva azt az elképzelést, hogy az ASC-k fontos szereplők az elhízás során a WAT átalakításában [4].
Mi és mások kimutattuk, hogy az elhízott alanyok szubkután zsírszövete (SAT) az emberi ASC-k diszfunkcionális készletét tartalmazza. Ennek megfelelően bizonyíték van az elhízás és a hASC multipotencia elvesztése [5], a megnövekedett hASC proliferáció [6], az apoptózissal szembeni rezisztencia [7] és a csökkent adipogén potenciál [6, 8] között. Sőt, csoportunk nemrégiben végzett vizsgálata azt mutatta, hogy a donor metabolikus fenotípusa rontja a hASC-k immunmoduláló tulajdonságait [9].
Anyagok és metódusok
Tanulmányi tárgyak
Az epigenetikai szintű asszociációs vizsgálatokhoz (EWAS) hASC-kat nyertek egészséges női donorokból, akiket elektív zsírleszívási műtéten estek át (I. kohorsz): n = 6 sovány, BMI 22,4 ± 12 kg/m 2, életkor 44,3 ± 9,2 év; n = 6 elhízott, BMI 32,6 ± 2,2 kg/m 2, életkor 34,3 ± 7,4 év (LaCell LLC, New Orleans). A donorokat az Egészségügyi Világszervezet kritériumai alapján a BMI alapján soványnak vagy elhízottnak minősítették. Minden résztvevő megalapozott beleegyezését adta, és a tanulmányt a Western Institutional Review Board (Puyallup, WA, USA; Protokoll # 201304490) felülvizsgálta és jóváhagyta.
Más molekuláris elemzésekhez a hASC-kat elkülönítették az életkor és nem szerint egyező donoroktól, akik nem akut műtéti beavatkozásokon, például sérvön vagy kolecisztektómián estek át ütemezett rutinműtéten (II. Kohorsz): n = 4 sovány, BMI 23,7 ± 1,1 kg/m 2, életkor 52,8 ± 11,5 év; n = 4 elhízott, BMI 32,4 ± 3 kg/m 2, életkor 52 ± 10,5 év. Minden résztvevő megalapozott beleegyezését adta, és a tanulmányt a spanyolországi Tarragona Joan XXIII Egyetemi Kórház etikai és kutatási bizottsága felülvizsgálta és jóváhagyta.
DNS metilációs profilozás univerzális gyöngy tömb alkalmazásával
A genomi DNS-t a sejtekből a NucleoSpin® Tissue Kit (Macherery-Nagal GmbH) segítségével extraháltuk. A DNS-metilációs profilokat az Infinium Human-Methylation450K BeadChip (Illumina) alkalmazásával állítottuk elő. A BeadChip-et több mint 480 000 CpG-hely és párhuzamosan kiválasztott CpG-lokuszok vizsgálatára fejlesztették ki. A DNS-metilációs adatokat az alapértelmezett beállítások alkalmazásával a GenomeStudio szoftver (Illumina) segítségével dolgoztuk fel. A metilációs adatok a belépési kóddal a GEO adatbázisban találhatók GSE111632.
Metilezési adatok elemzése
Az összes számítást és statisztikai elemzést az R 3.0.2 és a Bioconductor 2.13 alkalmazásával hajtottuk végre. A szemcseméret elemzését a BiSeq 1.8.0 csomag [18] segítségével végeztük, amely a következő szakaszokat foglalta magában: a Bssraw osztályú objektum létrehozása (a nyers adatok tárolója), CpG klaszter azonosítása, metilációs arány simítása minden egyes azonosított CpG klaszterben, tesztelje és modellcsoportos hatást gyakoroljon a CpG-klaszterek belsejében lévő CpG-helyekre, tesztelje a CpG-klasztereket a differenciálmetilezés és a differenciálisan metilált helyek (DMS) azonosítására [19]. A simítási kritériumokat 90% -os kvantilok alkalmazásával végeztük, és a DMS azonosításához figyelembe vett CpG klasztereket hamis felfedezési arány −ΔΔCt módszerrel szűrtük. Az endogén 18s RNS-t használtuk a génexpressziós szintek normalizálására és a ΔCt értékek kiszámítására. Az értékeket átlag ± SEM-ben fejezzük ki. Az adatokat Excel és GraphPad Prism szoftverekkel elemeztük. A különbségeket statisztikailag szignifikánsnak tekintettük, ha a o érték volt
Eredmények
Az elhízás hatása a globális DNS-metilációs mintázatokra a hASC-kban és a differenciált adipocitákban
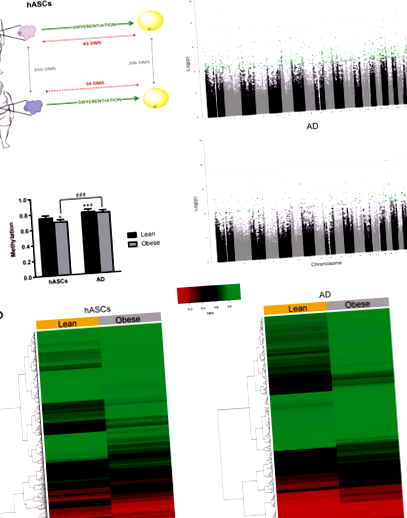
Az elhízás DNS-metilációhoz és adipocita-differenciálódáshoz való potenciális hozzájárulásának vizsgálatához első lépésként a hASC-kat izolálták a sovány és elhízott alanyok SAT-rekeszéből (n = 6; anyagokban és módszerekben leírtak szerint). A hASC-k izolálását és differenciálását érett adipocitákra a leírtak szerint hajtottuk végre [6, 9]. Genomikus DNS-t nyertünk ki a sejtekből a differenciálás előtt és után, és EWAS-t végeztünk az Illumina platformon az Infinium Human-Methylation450K BeadChip tömb felhasználásával (1a. Ábra). Megállapítottuk a log kétszeres változásának küszöbértékét a-val o érték 1. ábra
Ezután a négy metilómát három osztályba soroltuk: teljesen metilált régiókat (FMR-k;> 50% metilált CpG-k), alacsony metilezettségű régiókat (LMR-k; polc> part> nyílt tenger) a 2b. Ábra, jobb oldali panelek. Mindkét környezetben a jelentős változások 67% -át a CpG-sziget legtávolabbi területein (part és nyílt tenger) találták.
Összességében a fenti adatok azt mutatják, hogy a hASC-k elhízástól függenek az epigenetikus módosítások felhalmozódása révén, legalábbis a DNS-metiláció szintjén, ami alapul szolgálhat az elhízott eredetű hASC-k megváltozott plaszticitásával, amiről korábban beszámoltunk [6, 9] és mások [8, 25]. Megpróbáltuk felismerni, hogy melyik molekuláris útvonal befolyásolhatja a hASC-rést elhízott környezetben, funkcionális elemzést végeztünk GO-dúsítással, az összes DMS-t tartalmazó gén Ingenuity adatbázisának felhasználásával. Mivel kifejezetten az adipocita prekurzorok, mint a zsírszövet-terjeszkedés kulcsfontosságú tényezői iránt érdeklődtünk, a hASC rekesz változásaira összpontosítottunk. A várakozásoknak megfelelően a GO-elemzés azonosította az adipogenezishez kapcsolódó génfunkciókat (2c. Ábra). A kimutatott egyéb, differenciáltan dúsított biológiai útvonalak közé tartozik a gyulladás (LPS/IL-1) és az immunszuppresszió/helyreállítás (TFG-β). Ezek a megállapítások összhangban vannak korábbi vizsgálatainkkal, amelyek azt mutatják, hogy az elhízott betegek hASC-jainak fokozott gyulladásos profilja és csökkent immunszuppresszív tulajdonságai vannak [6, 9], és összhangban állnak más független vizsgálatok eredményeivel [26, 27].
Az epigenetikus aláírás hatása a génexpresszióra a hASC-kban
A mezodermális fejlődési gén hipometilezése TBX15 elhízott hASC-k az érett adipocyták mitokondriális funkciójával társulnak
Az emberi szubkután zsírszövet mitokondriális fenotípusa elhízásban
Vita
A DNS-metiláció az egyik legjobban vizsgált epigenetikus mechanizmus, amely szabályozza a génátírást, és a genetikai és környezeti hatásokat a DNS stabil kémiai módosításaként kódolja. A hASC-k epigenetikájának jobb megismerése segíthet az elhízás leküzdésére és/vagy az „egészséges” WAT terjeszkedés elősegítésére tervezett új stratégiák kidolgozásában. Jelen tanulmányban megmutatjuk, hogy a hASC-k érett adipocitákká történő differenciálódása a DNS-metiláció diszkrét számú változásában tükröződik. Ezzel szemben az elhízott és sovány hASC-k metilációs aláírása nagyban különbözik, és példátlan epigenetikai modellt mutat be az elhízott hASC-k szárahálózatának általános rövidzárlatához [5]. Ennek megfelelően az elhízott környezet egy specifikus epigenetikus aláírást nyomtathat az adipocita prekurzorokra, így azok diszfunkcionális adipocitákká válnak. Ennek fényében csoportunk egy korábbi vizsgálata feltárta, hogy az elhízással kapcsolatos zsírszöveti hipoxia szükséges, de nem elegendő az érett zsírsejtek jelentős funkcionális változásainak összehangolásához [6].
Genomra kiterjedő megközelítésünk lehetővé tette számunkra, hogy meghatározzunk olyan új szabályozási régiókat, amelyek differenciáltan metilálódnak a hASC-kban, és amelyek a kritikus adipogén differenciálódási gének ellenőrzéséhez kapcsolódnak. A jelen vizsgálatban azonosított DMS-ek közül sok a proximális gén promoteren vagy a CpG-szigeten kívül található. Hagyományosan a promótereken végzett metiláció blokkolja a transzkripciót, míg a metiláció a géntestben nem blokkolja, sőt stimulálhatja is a transzkripciót [31]. Bár a géntest DNS metilációjának funkcionális szerepei még vita tárgyát képezik [32], eredményeink szerint a géntest metilációja közvetlen hatással van a génexpresszióra.
Más vizsgálatok a hASC-k epigenetikus állapotát vizsgálták differenciálódási potenciáljukkal kapcsolatban, arra a következtetésre jutva, hogy a DNS-metiláció nem tükrözi sem a transzkripciós státust, sem pedig a gén-expresszió lehetőségét a differenciálódáskor [12, 33]. Ezeket a vizsgálatokat azonban szűk adipogén géneken végezték (LEP, PPARG, FABP4, LPL), és annak megállapítása ellenére, hogy a metilációs szintek hasonlóak voltak a klónok között, az érett adipociták mRNS-szintje és a hASC differenciálódási potenciálja heterogén volt [12]. Ezenkívül nem vettek figyelembe olyan egyéb típusú ingereket, amelyek epigenetikusan képesek előidézni a zsírsejt progenitor sejteket, például a donor metabolikus állapotát vagy az elhízást, ami megmagyarázhatja a klónok között megfigyelt különbségeket. Eredményeinkkel összhangban Moskaug és munkatársai [34] kimutatták, hogy a hASC-k kitettsége magas glükózszintű, szabályozott gyulladásos géneknek és megváltoztatta a hiszton H3 metilációját a transzkripciós de-represszióra utaló módon. Nyilvánvaló, hogy további vizsgálatokra van szükség a hASC-k epigenetikus aláírásának alapjául szolgáló, az elhízással összefüggő tényezők, valamint a folyamat potenciális reverzibilitásának teljes körű jellemzéséhez.
Az elhízott egyének és a T2D-ben szenvedő betegek zsírszövete diszfunkcionális hASC-készletet tartalmaz [8, 9]. Legjobb tudomásunk szerint a jelen tanulmány az első, amely megállapítja, hogy a hASC kóros adaptációja elhízott körülmények között, legalábbis részben, epigenetikai szinten van szabályozva. Ennek az elképzelésnek az alátámasztásaként Ollikainen és munkatársai [27] átfogó vizsgálatot végeztek a genom egészére kiterjedő DNS-metilációról SAT-ban, diszkrét BMI-vel rendelkező monozigóta ikrekből, és megállapították a gyulladás és az extracelluláris mátrix átalakító gének szabályozását, az adipogén gének visszaszorításával együtt. Bár keveset tudunk az elhízás miatt meghibásodó molekuláris mechanizmusokról, egyértelmű, hogy epigenetikusan szabályozhatók lehetnek a betegség kialakulása előtt. A SAT változásai általában társulnak az egészségtelen elhízás kialakulásához, és tanulmányunk bizonyítékot szolgáltat a hASC epigenetikai diszfunkcióra, mint az elhízás lehetséges kulcsszabályozó eseményére, amely az adipociták károsodott érését eredményezi.
A sovány és elhízott hASC-k között differenciálisan metilezett 650 CpG közül 13 kapcsolódott a transzkripciós faktorhoz TBX15. Ez a gén köztudottan fontos szerepet játszik a gerincesek mezodermális fejlődésében [15]; a WAT-ban betöltött szerepe azonban ellentmondásos. Ennek megfelelően leírták, hogy az elhízás mind fokozódhat [30], mind csökkenhet [35]. TBX15 mRNS expresszió. Ezenkívül ellentétes függvényeket tulajdonítottak TBX15 az adipogenezis és a mitokondriális aktivitás tekintetében [15, 17].
Fontos megemlíteni, hogy megvizsgáltuk az enyhe elhízás (átlagos BMI 30 kg/m 2) hatását a mitokondriális funkcióra, amelyben a zsírsejt kompenzációs válasza bekövetkezhet. Így az enyhe elhízás károsíthatja a mitokondriális funkciót, de az adipocita ezt ellensúlyozhatja a mitokondriumok számának növelésével. Ismeretes, hogy a mitokondriumok képesek alkalmazkodni az endokrin vagy metabolikus kihíváshoz (mitokondriális plaszticitásnak nevezik őket), hogy megfeleljenek bioenergetikai igényeiknek. A mitokondrium megnyúlása a megnövekedett fúzió vagy csökkent hasadási aktivitás eredménye, amely jellemző a megnövekedett energiahatékonyságú állapotokra (például éhezés vagy öregedés). Ezen a vonalon és az eredményeinkkel összhangban a mitokondriumok megrövidülése a csökkent fúziós aktivitás vagy a megnövekedett hasadási aktivitás eredménye, ami jellemző a csökkent bioenergetikai hatékonyságú állapotokra, például egy túlkínálati állapotra, mint például az elhízás [41]. Valójában, mivel az elhízás váltást vált ki a glükózról a lipid oxidációra, ami az ATP termelés szempontjából kevésbé hatékony folyamat, nem indokolatlan azt tekinteni, hogy az elhízás kezdeti szakaszában a zsírsejtek megpróbálják ezt kompenzálni a mitokondriumok számának növelésével.
Összefoglalva, megmutatjuk, hogy az adipocita prekurzorok metilációs állapotát jelentősen módosítja az elhízott környezet, és meghatározhatja a zsírszövet mitokondriális funkcióját, támogatva a hASC diszfunkcióját, mint az elhízás kulcsfontosságú szabályozó eseményét. Összességében az adataink határozottan azt sugallják, hogy bár a DNS-metilációs minták lényegében megőrződnek a zsírszövet-vonzat elköteleződése során, az elhízás előfeltétele a kiválasztott régiókban a DNS-metiláció dinamikus elvesztésével járó HASC-k, amelyek végső soron WAT-diszfunkciót és metabolikus szindrómák kialakulását okozhatják az elhízásban.
Hivatkozások
van Dijk SJ, Tellam RL, Morrison JL, Muhlhausler BS, Molloy PL. Az epigenetika elhízásban és anyagcsere-betegségben betöltött szerepével kapcsolatos legújabb fejlemények. Clin Epigenetics. 2015; 7: 66.
Yu G, Floyd ZE, Wu X, Hebert T, Halvorsen YD, Buehrer BM és mtsai. A zsírszármazékból származó őssejtek adipogén differenciálása. Módszerek Mol Biol. 2011; 702: 193–200.
- Az emberi barna zsírszövet-cukorbetegség anatómiai elhelyezkedése
- Adipocita halál, zsírszövet átalakítás és elhízás szövődmények cukorbetegség
- 36 adenovírus DNS szokatlan viscerális elhízással rendelkező beteg zsírszövetében - 16. kötet, szám
- A barna zsírszövet és az elhízási cukorbetegség elleni hidegháború
- Autós ingázóként elhízás 32% -kal nőtt a korai halálozás kockázata miatt - írja a ScienceDaily