36 adenovírus DNS szokatlan viscerális elhízással rendelkező beteg zsírszövetében - 16. kötet, szám
Masszív zsírszövet-lerakódások a hasban és a mellkasban, amelyek elegendőek ahhoz, hogy megzavarják a légzést a többszörös orvosi problémákkal küzdő páciensnél. A zsírszövet biopsziája azonosította a humán adenovírus 36 (Adv 36) DNS-t. Az Adv 36 adipogenezist okoz állatokban és emberekben. A masszív lipomatosis kialakulását az Adv 36 okozhatja.
Beszámoltak arról, hogy a humán 36-as adenovírussal (Adv 36) történő fertőzés 4 állat (csirke, egér, patkány és majom) nagy zsírfelhalmozódását okozta (1-3). Bizonyos vizsgálatokban a zsigeri zsír szelektív lerakódását a teljes zsírlerakódással aránytalanul figyelték meg. A viscerális zsír vagy az összes testzsír növekedése a fertőzött állatokban a nem fertőzött állatokhoz képest néhány kísérletben> 100% volt (1–3). A fertőzött állatok 60–100% -a elhízott a nem fertőzött állatokhoz képest (1–4). Az elhízást a nem fertőzött állatok 85. percentilisénél nagyobb tömegnek vagy zsírtartalomnak határozták meg.
Számos humán vizsgálat kimutatta az Adv 36 elleni antitestek és az elhízás összefüggését (4–8). Egy> 500 főből álló vizsgálatban az elhízottak 30% -ának és a sovány emberek 11% -ának volt antitestje az Adv 36-mal szemben (4). A fertőzöttek testtömege ~ 25 kg-mal volt nagyobb, mint a nem fertőzötteké (4). Az ikrek 26 párjában diszkrimináns Adv 36 antitest státuszban a fertőzött ikrek nehezebbek és kövérebbek voltak (4). A dél-koreai elhízott iskolás gyermekek egy csoportjában 30% -nak volt antitestje az Adv 36 ellen, és a fertőzött gyermekek testtömeg-indexének z-pontszáma magasabb volt, mint a nem fertőzött gyermekeké (5). Az Egyesült Államokban élő állatokban és felnőttekben azonban az elhízás ellenére paradox módon csökkent a szérum koleszterin- és trigliceridszintje (1–4). Az olaszországi felnőttekről és a dél-koreai gyermekekről szóló legfrissebb jelentések támogatják az Adv 36 és az elhízás társulását, és azt mutatják, hogy az Adv 36 gyakoribb az elhízott embereknél; prevalencia 29% és 65% között mozog (6,7).
A megnövekedett zsírbetegségért felelős mechanizmusok a több enzim gén expressziójában bekövetkező változások és a vírus által végzett transzkripciós faktorok változásai (8–15). Az adipocitákban a szterin szabályozó elemhez kötődő fehérje útja megnő, ami a szterin szabályozó elemet kötő fehérje 1 és a zsírsav szintáz szintjének növekedését eredményezi. Mivel a CCAAT/enhancer kötő fehérje-β, a peroxiszóma proliferátor által aktivált receptor-γ és a lipoprotein lipáz szintje szintén megnő, a lipidek sejtekbe történő transzportja és a sejteken belüli zsírsavszintézis fokozódik (8-15). Az izomsejtekben megnő a glükóz transzporterek, a Glut 1 és a Glut 4, valamint a foszfoinozidid 3-kináz génexpressziója, ami nem inzulin által közvetített növekedést eredményez a glükóz transzportban (14).
Úgy gondolják, hogy ezeket a változásokat az Adv 36 nyitott leolvasási keret 1. korai 4. régiójának génje okozza, és kis interferáló RNS vagy antivirális cidofovir gyógyszer blokkolhatja őket (11, 13). Amikor a nyitott olvasási keret 1. korai régiójának 4. génjét átvittük egy retrovírusba, és in vitro beillesztettük a preadipocitákba, a gén képes volt az enzimek indukálására és a zsír felhalmozódásának fokozására (13.
Az Adv 36 DNS a kezdeti fertőzés után hosszú ideig fennáll a fertőzött állatok több szövetében (3). A majmok agyából, tüdejéből, májából, izomból és zsírszövetéből vírus DNS-t izoláltak 7 hónappal a kezdeti fertőzés után, jóval azután, hogy az aktív vírus eltűnt a vérből és a székletből (3). A vírus DNS láthatóan továbbra is krónikusan megváltoztatja a génexpressziót a szövetekben.
Jelentünk egy olyan beteget, akinek hatalmas a zsírrétege a mellkasban és a hasban. Feltételezzük, hogy ezeket a rendellenes zsírszövet-lerakódásokat az Adv 36 fertőzés okozta.
A páciens
A páciens, egy 62 éves férfi, akinek magas fokú nagysejtes limfómát diagnosztizáltak 1999-ben, többgyógyszeres (ciklofoszfamid, doxorubicin, vinkrisztin és prednizolon) kemoterápiát, citarabinnal végzett központi idegrendszeri profilaxist és nagy dózisú metotrexátot kapott. 2000 februárjában autológ csontvelő-átültetésen esett át, és kondicionáló kezelést kapott etopoziddal, citoxánnal és frakcionált teljes test besugárzással. Hypothyreosis, kemoradiation okozta hypogonadismus és mellékvese-elégtelenség alakult ki a betegben, amelyek krónikus glükokortikoid-pótlást igényeltek.
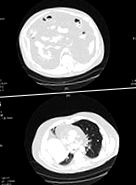
1. ábra: A páciens számítógépes tomográfiás vizsgálata, amely a has (A) és a mellkas (B) markáns zsigeri zsírszövetét mutatja. A diffúz intrabadominalis, retroperitoneális lipomatosis és a mediastinum herniája látható.
A következő 7 évben prosztatarák, vastagbélelterelést igénylő végbélfekély, hemolitikus vérszegénység, trombocitopénia, mielodiszplasztikus szindróma és diabetes mellitus alakult ki a betegben; inzulinnal kezelték a cukorbetegség miatt. 2007. augusztusában kórházba került légzési elégtelenség miatt, amelyet feltehetően hatalmas intratorakális és intraabdominális zsírlerakódások okoztak vagy súlyosbítottak. A nyaka, az oldalsó mellkasa és a hasa elhízott, hasában és felső végtagjaiban azonban korlátozott volt a bőr alatti zsír. Nem volt bölénypúpja, kerek fáciája vagy a Cushing-szindróma egyéb jelei. A páciens tachycardia volt, fojtott szívhangokkal, tompa volt a jobb mellkas tövében, és a bibasilar csökkent légzési hangokat. A mellkas és a has számított tomográfiás vizsgálata azt mutatta, hogy a zsírsűrűség az intrabdominális, az intraperitoneális és a retroperitoneális területekre terjed ki, és a nyelőcső hiatusán át a mediastinumba hernizálódik (1. ábra). Ezek a zsírsűrűségek határozott pericardialis effúzió nélkül terjedtek a szívburokban.
A beteg súlya 113 kg, magassága 183 cm, testtömeg-indexe 34, derék kerülete 145 cm, csípő kerülete 111 cm volt. A laboratóriumi vizsgálatok 1,356 mmol/l triglicerideket, 2,2015 mmol/l teljes koleszterint, 0,5957 mmol/l nagy sűrűségű lipoprotein koleszterint és 0,9842 mmol/l alacsony sűrűségű lipoprotein koleszterint mutattak ki. A szérum lipidértékek az előző mérésekhez képest jelentős csökkenést jelentenek. 2002 decemberében alacsony sűrűségű lipoprotein koleszterinszintje 2,7412 mmol/l volt. 2007 áprilisában a szérum triglicerid szintje 4,92244 mmol/l volt. Az adenovírusok elleni szérum immunglobulin (Ig) M teszt eredménye negatív volt (0,07 NE), a szérum IgG teszt eredménye pozitív (2,18 NE).
2. ábra: A beteg adenovírus 36 (Adv 36) DNS PCR termékeinek HaeIII emésztése. 1. sáv, molekulatömeg-marker; 2. sáv, Adv 36 DNS HaeIII emésztése; 3. sáv, emésztetlen Adv 36.
Disszeminált lipomatózist okozó Adv 36 fertőzés gyanúja merült fel. A szubkután zsírbiopsziás mintát beágyazott PCR-rel vizsgáltuk az Adv 36 DNS-re (4). A 4 zsírszövetmintából három az Adv 36 DNS-sel kompatibilis sávot mutatott. Az assay vízkontrolljának negatív eredményei voltak. A feltételezett Adv 36 DNS-sáv HaeIII-emésztése a várt helyen mutatott emésztést és 2 azonos méretű sávot eredményezett (2. ábra). A DNS-sáv szekvenálása a Virginia Commonwealth University Massey Cancer Center Molecular Biology Core (Richmond, VA, USA) segítségével a szekvenciát Adv 36 DNS-ként azonosította.
Kontrollként 12 zsíros szövet biopsziával nyert zsírszövet mintáit kóros zsírszövet-lerakódások nélkül, beágyazott PCR-rel és kvantitatív PCR-rel értékeltük Taqman primerek és szonda használatával (Obetech, Richmond, VA, USA). Ezek a személyek írásbeli tájékozott beleegyezést adtak. A kvantitatív PCR-mintákat ABI Step One PCR készülékkel (Applied Biosystems, Foster City, CA, USA) elemeztük. A beágyazott PCR-rel vizsgált 8 minta közül kettő pozitív, a kvantitatív PCR-rel vizsgált 12 minta közül 5 pozitív volt. A PCR-rel azonosított Adv 36 fertőzés prevalenciája hasonló volt az elhízott felnőttek szérumneutralizációjával azonosítottakhoz az Egyesült Államokban (5).
Következtetések
A beteg zsírszövetében található Adv 36 DNS dokumentálja, hogy fertőzött ezzel a vírussal. Az Adv 36 hajlandósága a zsigeri zsírszövet növelésére kísérletileg fertőzött állatokban arra utal, hogy a hasi és mellkasi üregekben, valamint a mellkas és a nyak szubkután terében a rendellenes zsírszövet-lerakódásokat az Adv 36-fertőzés okozhatja. Helyettesítő kortikoszteroidokkal kezelték, de nem voltak Cushing-szindróma jelei.
További kutatásokra van szükség annak megállapításához, hogy az Adv 36 szerepet játszik-e a kóros zsírszövet-lerakódásokban/lipomatosisban. Ha kiderül, hogy az Adv 36 ok, akkor kutatásra van szükség a hatékonyabb vírusellenes szerek azonosításához, amelyek tolerálhatóbb mellékhatásprofillal rendelkeznek. A cidofovir in vitro hatékony az Adv 36 ellen, de embernél jelentős mellékhatásokkal jár.
Dr. Salehian a cukorbetegség, az endokrinológia és az anyagcsere klinikai docense a Hope City Diabetes Tanszékén és a kaliforniai Duarte-i Beckman Research Institute-ban. Elsődleges kutatási területe a glükokortikoid myopathia, a pajzsmirigyrák, az anyagcsere és a táplálkozás kritikus betegségben szenvedő betegeknél, valamint a cachexia.
Köszönetnyilvánítás
Köszönjük Susan Ward-nak a PCR-vizsgálatok elvégzését és Ellen Anderson-nak a kontrollminták összegyűjtésében nyújtott segítséget.
Ezt a tanulmányt a Remény Város és a Beckman Kutatóintézet, valamint az Obetech elhízáskutató központ támogatta.
- A szuper-szuper elhízás (BMI; 80) végzetes esete egy nekrotikus lágy szöveti fertőzésben szenvedő betegnél
- Az emberi elhízás zsírszöveti mitokondriális diszfunkciója egy specifikus DNS-metilációhoz kapcsolódik
- Adipocita halál, zsírszövet átalakítás és elhízás szövődmények cukorbetegség
- A barna zsírszövet és az elhízási cukorbetegség elleni hidegháború
- Az aszkorbinsav aktiválásával gátolja a zsigeri elhízást és az alkoholmentes zsírmáj betegségeket