Az étrendi glutamin-kiegészítés megakadályozza a nyálkahártya sérülését és modulálja a bélhám helyreállítását az ecetsav okozta bélkárosodás után patkányokban
Absztrakt
Bevezetés
Azok a tényezők, amelyek megakadályozzák a nyálkahártya károsodását a bélkárosodás során, valamint azok a tényezők, amelyek javítják a bél helyreállítását a bél sérülését követően, új terápiás stratégiákat tárhatnak fel a gyomor-bél traktus nyálkahártya-integritásának fenntartására, javítva ezzel a bélgyulladásban szenvedő betegek eredményeit. Az ecetsav (AA) intrakolon beadását korábban a kísérleti vastagbélgyulladás modelljeként írták le [1]. Nemrégiben kifejlesztettünk egy új rágcsáló-modell rendszert az AA által kiváltott vékonybél sérülés tanulmányozására, amelynek során az altatott patkányokban az ecetsavat (0,67 mol/l) közvetlenül adták egy ligált bélhurokhoz, ami szövettani sérüléshez és a bélpermeabilitás megváltozásához vezetett [2]. . Az AA kezelés jelentős szövettani elváltozásokat váltott ki a bél nyálkahártyájában, beleértve a kicsi, szabálytalan és torz villákat; hámkárosodás; a lamina propria ödémája; gyulladásos sejtek felhalmozódása; és vérzés. Ezt az új modellt alkalmazták a glutamin (GLN) szerepének tanulmányozására az AA által kiváltott vékonybél sérülésben, amely egyre aktuálisabb téma, mivel a GI sérülésnek ez a formája meglehetősen gyakori a Crohn-betegségben szenvedő betegek körében.
A GLN nem esszenciális aminosav, amelyet főleg az izmok termelnek, és számos fiziológiai és biológiai folyamatban játszik fontos szerepet. A legújabb bizonyítékok azt sugallják, hogy a GLN fontos tápanyag a gyorsan osztódó sejtek számára, például az immunrendszerben és a bélben található sejtek számára [3]. A különféle kísérleti modelleket magukban foglaló kiterjedt vizsgálatok megállapították, hogy a GLN a vékonybél nyálkahártyájának sejtjeinek nélkülözhetetlen légzőszubsztrátja, amely a vékonybélben termelt összes CO2 több mint egyharmadát teszi ki [4]. Ezenkívül a GLN pozitív hatást gyakorol a bélhez kapcsolódó limfoid szövetekre és fokozza a bélgát funkciót.
Tekintettel a GLN trofikus bélhatásaira, a jelen tanulmányban feltételeztük, hogy ez az aminosav megakadályozhatja a bél nyálkahártyájának sérülését és/vagy javíthatja a bél helyreállítását az AA okozta bélkárosodás után. A GLN stimulálhatja az enterocita forgalmát a proliferáció vagy a sejtek migrációjának közvetlen stimulálásával, vagy az enterocita apoptózisának gátlásával. Korábbi tanulmányok kimutatták, hogy a bélkárosodás apoptotikus és nekrotikus sejtek megjelenését eredményezi a bélhámban. Ezenkívül az apoptózis stimulálása a villiák felső részein belül a hámsejtekben kifejezettebb, összehasonlítva a Lieberkühn kriptáiban lévő, differenciálatlanul szaporodó sejtekkel [5].
Jelen tanulmány célja az volt, hogy patkánymodellben értékelje az étrendi GLN-kiegészítés hatását a nyálkahártya strukturális változásaira az AA okozta bélkárosodást követően, és értékelje azokat a mechanizmusokat, amelyek révén a glutamin befolyásolja a bél helyreállítását, ideértve az enterocita proliferációra és a halálra gyakorolt hatását is. apoptózis.
Anyagok és metódusok
Állatok
250-350 g tömegű hím Sprague – Dawley patkányokat az Intézményi Állattenyésztési és Felhasználási Bizottság (Rappaport Orvostudományi Kar, Technion, Haifa, Izrael) irányelveinek megfelelően kezeltünk. A patkányokat egyenként rozsdamentes acélból készült ketrecekben helyezték el, és a szokásos szobahőmérsékleti körülményekhez (25 ° C) akklimatizálva váltogatták a 12 órás világos-sötét ciklusokat, és standard patkány chow-val és vízzel etették őket. ad libitum legalább öt napos stabilizációs időszak alatt.
Kísérleti terv
A patkányokat véletlenszerűen a négy kísérleti csoport egyikébe soroltuk: a kontroll (CONTR) patkányoknak laparotomiát hajtottak végre, a jejunális hurok izolálását és a normál sóoldat intraluminális injekcióját hajtották végre. A kontroll-glutamin (CONTR-GLN) patkányokat enterális GLN-vel kezeltük ivóvízben (2%), 48 órával a laparotómiát megelőzően és azt követő 5 nappal. A kontroll-ecetsav (C-AA) patkányokon laparotómiát hajtottak végre, a jejunális hurkot izolálták és 2 ml (0,67 mol/l) AA intraluminális injekcióját hajtották végre, az előzőekben leírtak szerint [2]. Végül az ecetsav-glutamin (AA-GLN) patkányok AA okozta sérülést szenvedtek (hasonlóan a C-AA patkányokhoz), és enterális glutaminnal kezelték őket 48 órával a műtét előtt és 5 nappal azután (hasonlóan a C-GLN patkányokhoz).
Sebészeti eljárás
A patkányokat műtét előtt 12 órán át éheztettük. Az operatív eljárásokat standard steril technikával, általános érzéstelenítésben végeztük ketamin (intraperitoneálisan, 90 mg/kg) és xilazin (intraperitoneálisan, 10 mg/kg) alkalmazásával. A hashoz egy középvonalú metszésen keresztül jutottak. A C patkányok laparotomián, a jejunális hurok izolálásán és a normál sóoldat intraluminális injekcióján estek át. AA patkányokban laparotomia és a jejunális hurok izolálása után atraumatikus vaszkuláris bilincseket használtak az izolált bélhurok elzárására, és 2 ml AA-t (0,67 mol/l) injektáltak a lumenbe 10 percig. A sérülés ideje alatt a hasfal bemetszését közelítettük, hogy megakadályozzuk a folyadék- és hőveszteséget. 10 perces károsodás után az AA-t kiürítették, és a bélelzáródások felszabadultak. A beleket gondosan visszahelyezték a hasba, és a bemetszést nedves gézzel borították be. A patkányokat az eljárás időtartama alatt melegítő takaróra helyezték. Ezt követően 3 ml intraperitoneális, 0,9% -os fiziológiás sóoldat injekcióval újraélesztettük, és a bemetszést egy Dexon S Polyglycolic Acid 3-0 (TYCO Healthcare, Mansfield, MA) varrattal zártuk. Ezután a patkányokat ébren hagyták, szabad hozzáféréssel a vízhez és az élelemhez.
A kísérleti vizsgálat során az első, a harmadik és az ötödik napon bekövetkezett változásokat vizsgálták az AA injekció után. Mivel a hisztopatológiai bélváltozások egy és három nap után főként akut sérülést jelentettek, az öt napos eredményeket a krónikus károsodás reprezentatívjának tekintették, amely pontosabban hasonlít az emberek gyulladásos bélbetegségére. Az áldozat idejét tehát a bélkárosodás után öt nappal határoztuk meg. A patkányokat intraperitoneális pentobarbitállal (75 mg/kg) újra érzéstelenítettük, és nyílt pneumothorax segítségével leöltük őket. Két bélszegmenst (a proximális jejunumot és a distalis ileumot, egyenként 10 cm-t) eltávolítottunk és hideg sóoldattal átöblítettük, mielőtt nedves súlyt regisztráltunk volna. A nyálkahártyát egy üveglemezzel kapartuk ki az alatta lévő szövetből, és lemértük. A bél és a nyálkahártya tömegét mg/cm-bélhossz/100 g-testtömegben számoltuk.
Szövettani vizsgálat
Szövettani metszeteket készítettünk a proximális jejunumból és a distalis ileumból. A vékonybél szegmenseit 24 órán át fixáltuk 4% -os pufferelt formalinban, xilolban tisztítottuk és standard paraffin blokkokká dolgoztuk fel. Öt mikronos szövetszeleteket parafinizáltunk, és H & E-vel festettük. A bélszövet sérülésének mértékét 0 és 8 közötti osztályozási skálán értékeltük, Park és mtsai. [6]: 0 - normál nyálkahártya, 1 - subepithelialis tér a villus csúcsán, 2 - kiterjedtebb subepithelialis tér, 3 - epitheliális emelés a villus oldalain, 4 - denuded villi, 5 - villus szövet veszteség, 6 - kriptaréteg infarktus, 7 - transzmucosalis infarctus, 8 - transmuralis infarktus.
A Villus magasságát és kriptamélységét tíz villiban és kriptában mértük az Image-Pro Plus 4 képelemző szoftver segítségével (Media Cybernetics, Baltimore, Maryland, USA).
Az enterocita proliferációja
Az enterocita proliferáció meghatározása céljából a patkányokat standard 5-bróm-oxi -uridin (5-BrdU) jelző reagenssel (Zymed Laboratories Inc., CA) injektáltuk 1 ml/100 g testtömeg dózisban 90 percig az elpusztítás előtt. Öt mikrométeres paraffinba ágyazott szeleteket (5 μm) deparaffinizáltunk xilollal, fokozatos alkohollal rehidratáltunk és biotinilezett monoklonális anti-BrdU antitest rendszerrel festettük a BrdU festékkészlet (Zymed Laboratories Inc., CA) alkalmazásával. A proliferációs index a tíz kriptánként pozitív BrdU-ra festődő kriptasejtek aránya volt.
Enterocita apoptózis
Az apoptotikus sejteket a kaszpáz-3 immunhisztokémiai elemzésével azonosítottuk. A Caspase-3 (CPP32/YAMA) a korai apoptotikus fázis markere. Az öt mikrométeres paraffinba ágyazott részeket viaszmentesítettük és xilollal és osztályozott alkohollal rehidratáltuk. A szövetrészeket mikrohullámúan előkezeltük 10 mM citrátpufferben (pH 6,0). A kaszpáz-3 immunhisztokémiai elemzését a gyártói protokollok szerinti sztreptavidin-biotin-peroxidáz módszerrel végeztük. Az endogén biotin aktivitás blokkolása után a szöveti metszeteket primer antitestekkel (Caspase-3 hasított koncentrált poliklonális antitest; 1: 100 hígítás; Biocare Medical, Walnut Creek, CA) inkubáltuk 1 órán át szobahőmérsékleten, majd másodlagos antitestekkel inkubáltuk. (ember által felszívódó, biotinilezett, affinitással tisztított antitest) 20 percig. A DAB-t intenzív barna lerakódás létrehozására használtuk a mintában lévő antigén-antitest-enzim komplex körül. Minden csoport esetében a festett sejtek számát két bélkeresztmetszetben számoltuk meg. Az apoptotikus indexet (AI) úgy definiáltuk, mint az apoptotikus sejtek számát tíz villiánként. Vezérlő készlet az Eurogentec-től, az EGT Group-tól.
Western blottolás
A szövetet RIPA lízispufferben homogenizáltuk, amely 50 mM Tris-HCl-t (pH 7,4), 150 mM NaCl, 1% NP-40, 2 mM EDTA-t tartalmazott, kiegészítve proteáz és foszfatáz inhibitorok koktéljával. A fehérjekoncentrációkat Bradford reagenssel határoztuk meg a gyártó utasításai szerint. Az azonos mennyiségű teljes fehérjét (30 μg) tartalmazó mintákat SDS-PAGE-val rezolváltuk redukáló körülmények között. Elektroforézis után a fehérjéket PVDF membránra vittük, és különböző anti-bax antitest elleni elsődleges antitestekkel (1: 200 hígítás, sc-493), anti-foszfo-ERK antitesttel (1: 2500 hígítás, sc-7383) és anti-β-Tubulint (1: 5000 hígítás, Sigma T6557) használtunk a fehérje normalizálására. Torma-peroxidázzal konjugált másodlagos antitestet a Jackson ImmunoResearch Laboratories Inc.-től (West Grove, PA) és egy továbbfejlesztett kemilumineszcens szubsztrátot vásároltunk a Biological Industries-től (Kibbutz Beth HaEmek, Izrael). A specifikus fehérje sávok optikai sűrűségét denzitométerrel (Vilber Lourmat, Lion, Franciaország) számszerűsítettük.
Statisztikai analízis
Az adatokat átlag ± SEM-ben fejezzük ki. Páros diák t-tesztet és a nem-parametrikus Kruskal-Wallis ANOVA tesztet alkalmaztuk. P
Eredmények
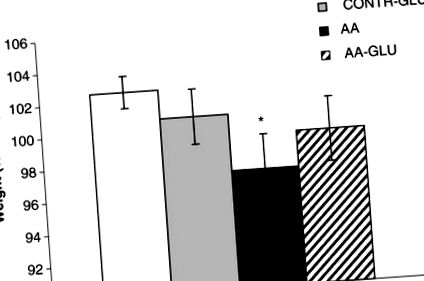
Testsúly
A színlelt patkányok kezelése enterális GLN-rel (CONTR-GLN csoport) nem változtatta meg szignifikánsan a végső testsúlyt a CONTR patkányokhoz képest (1. ábra). AA patkányok szignifikáns csökkenést mutattak a végső testtömegben (97 ± 2 vs. 103 ± 1% kezdetben, p 1. ábra
Bélsérülési pontszám
Míg a CONTR és a CONTR-GLN patkányok jejunuma és ileumja normális nyálkahártya-felépítést mutatott ép bolyhokkal, addig az AA állatok szignifikáns szövettani sérülést mutattak a sérült jejunumban és kevésbé jelentős ileumváltozásokat (2. ábra), valamint gyulladásos sejtek felhalmozódását, ödémáját és vérzés, amely főleg a sérülés helyén látható. AA patkányok (C csoport) szignifikáns növekedést mutattak az átlagos bélkárosodás fokozatában a jejunumban (háromszoros, p 2. ábra
A bél nyálkahártyájának paraméterei
A kontroll állatok enterális glutaminnal történő kezelése (CONTR-GLN csoport) nem változtatta meg szignifikánsan a bél és a nyálkahártya súlyát a kontroll állatokhoz képest (C csoport). 5 nappal a bélkárosodás után csökkent a bélfal vastagsága és a bélátmérője. Az AA patkányok szignifikánsan kisebb béltömeggel számoltak az ileumban (44 ± 7 vs. 54 ± 2, p 3. ábra
Mikroszkópos nyálkahártya-paraméterek
Az AA-patkányok szignifikáns csökkenést mutattak a jejunumban (279 ± 52 vs. 421 ± 37 μm, p 4. ábra)
Enterocita proliferáció és apoptózis
A kontroll patkányok glutaminnal történő kezelése (CONTR-GLN csoport) a sejtproliferáció sebességének enyhe növekedéséhez vezetett az ileumban (165 ± 3 vs. 141 ± 10 BrdU pozitív sejt/10 kriptában, p 5. ábra
A CONTR-GLN patkányok szignifikáns növekedést mutattak a sejt apoptózisában a jejunumban (2,4 ± 0,7 vs. 1,1 ± 0,2 Caspase-3 pozitív sejt/10 villi, p 6. ábra
Western blottolás
Az AA állatok (B és C csoport) csökkenő sejtproliferációs sebessége a p-ERK fehérje szintjének csökkenésével járt. Érdekes módon a sejtek megnövekedett apoptózisát a bax-fehérje szintjének csökkenése kísérte AA állatokban (B és C csoport) a kontroll állatokhoz képest. A glutaminnal (C csoport) végzett kezelés nem változtatta meg jelentősen a p-ERK és a Bax fehérje szintjét az AA-val nem kezelt állatokhoz képest (B csoport) (7. ábra).
Vita
Végül a jelen tanulmány bebizonyítja, hogy az orális GLN gyengíti a bél nyálkahártya károsodását és felgyorsítja a bél helyreállítását patkányokban az AA okozta bélkárosodást követően. Ez az előny korrelál az enterocita proliferáció növekedésével és a bélnyálkahártya sejtek apoptózisának csökkenésével.
Hivatkozások
Ablin J, Shalev O, Okon E, Karmeli F, Rachmilewitz D: A deferipron, egy orális vas kelátképző, javítja a kísérleti vastagbélgyulladást és a gyomorfekélyt patkányokban. Bélgyulladás Dis. 1999, 5: 253-261. 10.1097/00054725-199911000-00003.
Lavy A, Naveh Y, Coleman R, Mokady S, Werman MJ: Az étrendi Dunaliella bardawil, egy béta-karotinban gazdag alga, patkányokban véd az ecetsav által kiváltott vékonybél-gyulladás ellen. Bélgyulladás Dis. 2003, 9: 372-379. 10.1097/00054725-200311000-00005.
Van der Hulst RR, von Meyenfeldt MF, Soeters PB: Glutamin: esszenciális aminosav a bélben. Táplálás. 1996, 12 (11–12 Kiegészítő): S78-S81.
Windmuelle HG, Spaeth AE: A plazma glutamin felvétele és metabolizmusa a vékonybélben. J Biol Chem. 244, 5070-5079 (1974)].
Craig M, Coopersmith M, O’Donnell D, Gordon JI: A Bcl-2 gátolja az iszkémia-reperfúzió által kiváltott apoptózist a transzgénikus egerek bélhámjában. Am J Physiol Gastrointest Liver Physiol. 1999, 276: G677-G686.
Park PO, Haglund U, Bulkley GB, Falt K: A bélszöveti sérülés kialakulásának szekvenciája fojtási ischaemia és reperfúzió után. Sebészet. 1990, 107: 574-580.
Podolsky DK: Gyulladásos bélbetegség. N Engl J Med. 2002, 347: 417-429. 10.1056/NEJMra020831.
Strober W, Fuss IJ, Blumberg RS: A gyulladás nyálkahártya-modelljeinek immunológiája. Annu Rev Immunol. 2002, 20: 495-549. 10.1146/annurev.immunol.20.100301.064816.
Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R: Új módszer megbízható kísérleti akut és krónikus fekélyes vastagbélgyulladás indukálásában egerekben. Gasztroenterológia. 1990, 98: 694-702.
Elson CO, Sartor RB, Tennyson GS, Riddell RH: A gyulladásos bélbetegségek kísérleti modelljei. Gasztroenterológia. 1995, 109: 1344-1367. 10.1016/0016-5085 (95) 90599-5.
Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M: Az IKKbeta összekapcsolja a gyulladást és a tumorgenezist a colitishez társuló rák egérmodelljében. Sejt. 2004, 118: 285-296. 10.1016/j.cell.2004.07.013.
Neurath MF, Finotto S: A gyulladásos bélbetegségek kutatásának átültetése a klinikai orvoslásba. Immunitás. 2009, 31: 357-361. 10.1016/j.immuni.2009.08.016.
Rosenstiel P, Sina C, Franke A, Schreiber S: A molekuláris kockázati térkép felé - a gyulladásos bélbetegség etiológiájának közelmúltbeli előrehaladása. Semin Immunol. 2009, 21: 334-345. 10.1016/j.smim.2009.10.001.
Melis GC, ter Wengel N, Belens PG, van Leeuwen PA: Glutamin: a glutamin klinikai jelentőségének kutatásában a legújabb fejlemények. Curr Opin Clin Nutr Metab Care. 2004, 7: 59-70. 10.1097/00075197-200401000-00011.
Chapman MA, Grahn MF, Giamundo P, O'Connell PR, Onwu D, Hutton M, Maudsley J, Norton B, Rogers J, Williams NS: Új technika a nyálkahártya anyagcsere mérésére és annak felhasználása a szubsztrátok felhasználásának feltérképezésére az egészséges nagy emberi bél. Br J Surg. 1993, 80: 445-449. 10.1002/bjs.1800800412.
Ikeda S, Zarzaur BL, Johnson CD, Fukatsu K, Kudsk KA: A teljes parenterális táplálékkiegészítés glutaminnal javítja a túlélést a bél ischaemia/reperfúzió után. J Parenter Enterális Nutr. 2002, 26: 169-173. 10.1177/0148607102026003169.
Fukatsu K, Ueno C, Hashiguchi Y, Hara E, Kinoshita M, Mochizuki H, Hiraide H: Glutamin infúzió az ischaemia alatt, káros az egér bél ischaemia/reperfúziós modelljében. J Parenter Enterális Nutr. 2003, 27: 187-192. 10.1177/0148607103027003187.
Wu GH, Wang H, Zhang YW, Wu ZH, Wu ZG: A glutaminnal kiegészített parenterális táplálás megakadályozza a bél ischaemia-reperfúziós károsodást patkányokban. Világ J Gasztroenterol. 2004, 10: 2592-2594.
Wasa M, Soh H, Shimizu Y, Fukuzawa M: A glutamin stimulálja az aminosav transzportot az iszkémia-reperfúzió során az emberi bél hámsejtjeiben. J Surg Res. 2005, 123: 75-81. 10.1016/j.jss.2004.07.018.
Higashiguchi T, Hasselgren PO, Wagner K, Fischer JE: A glutamin hatása a fehérjeszintézisre izolált bélhámsejtekben. J Parenter Enterális Nutr. 1993, 17: 307-314. 10.1177/0148607193017004307.
Mok E, Hankard R: Glutamin-kiegészítés beteg gyermekeknél: hasznos-e ?. J Nutr Metab. 2011, 2011: 617597-
Sukhotnik I, Helou H, Mogilner J, Lurie M, Bernshteyn A, Coran AG, Shiloni E: Az orális arginin javítja a bél gyógyulását patkányok ischaemia-reperfúziós sérülését követően. Pediatr Surg Int. 2005, 21: 191-196. 10.1007/s00383-004-1318-0.
Noda T, Ivakiri R, Fujimoto K, Matsuo S, Aw TY: Az IR által indukált programozott sejthalál patkány bélnyálkahártyában. Am J Physiol. 1998, 274: 270-276.
Buttke JM, Sandrtrom PA: Oxidatív stressz, mint az apoptózis mediátora. Immunol ma. 1994, 15: 7-10. 10.1016/0167-5699 (94) 90018-3.
Braga-Neto MB, Warren CA, Oriá RB, Monteiro MS, Maciel AA, Brito GA, Lima AA, Guerrant RL: Az alanil-glutamin és a glutamin kiegészítés javítja az 5-fluorouracil által kiváltott bélhám károsodását in vitro. Dig Dis Sci. 2008, 53: 2687-2696. 10.1007/s10620-008-0215-0.
Larson SD, Li J, Chung DH, Evers B: Molekuláris mechanizmusok, amelyek hozzájárulnak a glutamin által közvetített bélsejtek túléléséhez. Am J Physiol Gastrointest Liver Physiol. 2007, 293: G1262-G1271. 10.1152/ajpgi.00254.2007.
- A Bacillus subtilis étrend-kiegészítése befolyásolta az elválasztott sertések bél egészségét
- Az étrend-kiegészítő l -argininnel vagy N-karbamilglutamáttal fokozza a bél növekedését és
- Az étrendi kurkuminpótlás fokozta a növekedési teljesítményt, a bél emésztését és felszívódását
- Az étrendi édesgyökér-gyökér kiegészítés csökkenti az étrend okozta súlygyarapodást, a lipidlerakódást és
- Étrendi zsírpótlás és következményei a petesejtek és embriók minőségének magas vérnyomására vagy jelentősek