Az étrendi rostok hatása a súlygyarapodásra, a szénhidrát-anyagcserére és a gyomor-grelin génexpresszióra magas zsírtartalmú étrendben táplált egerekben
Zhong Q. Wang
* Penningtoni Orvosbiológiai Kutatóközpont, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Aamir Zuberi
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Xian H. Zhang
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Jacalyn Macgowan
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Jianhua Qin
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Xin Ye
* Penningtoni Orvosbiológiai Kutatóközpont, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Leslie Son
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Qinglin Wu
** Kompozitok/Faipari termékek, Louisiana Forest Products Development Center, megújuló természeti erőforrások iskolája, Louisiana State University
Kun Lian
*** Fejlett mikrostruktúrák és eszközök központja, Louisiana Állami Egyetem, Baton Rouge, LA 70808
William T. Cefalu
* Pennington Biomedical Research Center, Táplálkozási és Krónikus Betegségek Osztálya, Louisiana Állami Egyetemi Rendszer
Absztrakt
Bevezetés
Számos tanulmány vizsgálta a makrotápanyagok, azaz az étkezési zsír, fehérje és szénhidrátok energiafogyasztásra gyakorolt hatását, de az élelmi rostoknak ebben a folyamatban betöltött szerepét értékelő tanulmányok korlátozottabbak (1). A rostot nem tekintik alapvető tápanyagnak, de szerepet játszhat az energiafogyasztás modulálásában, és ezzel kapcsolatban felvetették, hogy csökkentse az elhízás kialakulásának kockázatát (2). Az étrendi rostok, vagyis a növényi ételek emészthetetlen része nagyjából besorolható „oldható” vagy „oldhatatlan” és „erjedhető” vagy „nem erjeszthető” kategóriába. Kémiailag az étkezési rost nem keményítő poliszacharidokból és számos növényi komponensből áll, mint például cellulóz, lignin, viaszok, kitinek, pektinek, béta-glükánok, inulin és oligoszacharidok. Ezeknek a szálkomponenseknek egyedülálló kémiai szerkezete és jellegzetes fizikai tulajdonságai vannak, pl. tömeg/térfogat, viszkozitás, víztartó képesség, adszorpció/kötés vagy fermentálhatóság, amelyek meghatározzák későbbi fiziológiai viselkedésüket.
Az American Dietetic Association (ADA) legalább 20–35 g/napot ajánl egy egészséges felnőtt számára (3), míg az átlagos amerikai étrend alig tartalmazza ennek a mennyiségnek a felét, például napi 10–15 grammot (4). Beszámoltak arról, hogy az epidemiológiai és keresztmetszeti vizsgálatok sugallják az alacsonyabb rostbevitel és az elhízás közötti jelentős összefüggéseket (5–7). Mint ilyen, az élelmi rostok fokozott bevitele további egészségügyi előnyöket kínálhat az elhízott és a cukorbetegek számára. Például az élelmi rost-kiegészítés kimutatta, hogy jelentősen javítja a szénhidrát-anyagcserét és az inzulinérzékenységet túlsúlyos és elhízott nőknél (8). Ezenkívül az élelmi rostok magas bevitele, különösen az oldható típusú, javult a glikémiás kontroll, csökkent a hiperinsulinémia és csökkent a plazma lipidkoncentrációja a 2-es típusú cukorbetegségben szenvedő betegeknél (9). A megnövekedett élelmi rostbevitel ezen előnyeit a patkányokkal végzett hosszú távú vizsgálatok során is megfigyelték (10, 11). Más jelentések további előnyöket javasolnak az emberi egészség számára, ha késleltetik a vastagbélrák egyes típusainak megjelenését, valamint szabályozzák a glükóz és a lipid felszívódását a bélben (12).
Amint arról beszámoltunk, a magas oldhatatlan rosttartalmú étrend segíthet a glikémiás kontrollban (13, 14). Van azonban kevés adat, amely összehasonlítja az előnyösen oldható és oldhatatlan rostokat tartalmazó étrendeket specifikus paraméterek alapján. Ezenkívül vannak olyan beszámolók, amelyek szerint bizonyos növények rostjai, azaz a cukornádból származó bagass befolyásolhatják a szénhidrát- és lipidanyagcserét (15 Ezen jelentések alapján arra törekedtünk, hogy meghatározzuk a különféle élelmi rosttartalmú (oldható és oldhatatlan) étrendek súlygyarapodásra és a szénhidrát-anyagcserét értékelő paraméterekre gyakorolt hatását. Pontosabban összehasonlítottuk az elsősorban oldhatatlan rostokat, azaz tisztított cellulózokat vagy oldható rostokat, azaz a psylliumot tartalmazó étrendeket, és összehasonlítottuk azokat, amelyek elsősorban cukornádból származó rostokat tartalmaztak. A súly és a szénhidrát-anyagcsere klinikai mutatóinak értékelése mellett arra kerestük a választ, hogy megváltoztak-e a specifikus mechanizmusok a változó étrenddel. Mint ilyenek, értékeltük a leptin, a GLP-1 és a gyomor gén expressziójának specifikus biokémiai markereit a különféle étrendi kezelési módok között.,
Tanulmányterv és módszerek
Dizájnt tanulni
ASZTAL 1
Négy magas zsírtartalmú diéta étrend-összetétele és energiasűrűsége 10% élelmi rost hozzáadásával vagy anélkül (átlag + SEM).
| Kazein, 80 háló | 228 | 205.2 | 205.2 | 205.2 |
| DL-metionin | 2 | 1.8 | 1.8 | 1.8 |
| 10. maltodextrin | 170 | 153 | 153 | 153 |
| Szacharóz | 175 | 157.5 | 157.5 | 157.5 |
| Szójabab olaj | 25 | 22.5 | 22.5 | 22.5 |
| Kókuszolaj, hidrogénezett | 333,5 | 300.1 | 300.1 | 300.1 |
| Mineal keverék> S10001 | 40 | 36 | 36 | 36 |
| Szódabikarbóna | 10.5 | 9.45 | 9.45 | 9.45 |
| Kálium-citrát | 4 | 3.6 | 3.6 | 3.6 |
| Vitamin keverék V10001 | 10. | 9. | 9. | 9. |
| Kolin bitartarát | 2 | 1.8 | 1.8 | 1.8 |
| Rost (szénhidrát gm) | 0 | 100 (8.7) | 100 (18,4) | 100 (32,5) |
| Oldhatatlan (%) | 0 | 99.5 | 58 | 86 |
| Oldható (%) | 0 | 0.5 | 42 | 14 |
| Energia (kcal/kg) | 5558.5 | 5037.5 | 5058.5 | 5132.7 |
| Zsírból származó energia (%) | 58 | 52.2 | 52.2 | 52.2 |
Az étrendi rostok forrása
A psyllium héjport (PSY) a Source Naturals, Inc.-től (Scotts Valley, Kalifornia) szereztük be. Az élelmi rostos cellulózport (CEL) a NutriCology, Inc.-től (Hayward, Kalifornia) szereztük be. Cukornádrostot (SCF) nyertek és tisztítottak Dr. Lian irányításával a Louisiana Állami Egyetem Fejlett Mikrostruktúrák és Eszközök Központjában (CAMD). Szabadalmaztatott módszert alkalmaztak a cukornád bagass rostjának mikrométer nagyságú és nanométer nagyságú részecskékké történő redukálására (az arány megváltoztatható a feldolgozási paraméterek megváltoztatásával). A Bagasse szálat kriogén hőmérsékletre hűtötték, majd a bagassát mechanikusan apró részecskékké porlasztották, néhány nanométertől több száz mikrométerig. A porlasztási folyamat során a tészta kémiai oxidációját megakadályozta a hűvösebb hőmérséklet. A teljes feldolgozás során semmilyen vegyszert és más mesterséges tartósítószert nem használtak. Ez a feldolgozási technológia megőrzi az eredeti bagasse összetevőinek integritását, amely általában 46% cellulózot, 24,5% hemicellulózt, 19,95% lignint, 3,45% zsírt és viaszt, 2,4% hamu, 2,0% szilíciumot, 1,70% egyéb tömegű anyagot pulzál.
Vérkémia és hormonelemzés
4 órás éhezés után vérmintákat vettünk öntudatlan egerek orbitális sinusából, amelyet CO2 belélegzése indukált. A plazma glükózszintjét kolorimetriás hexokináz glükóz vizsgálattal (Sigma Diagnostics, St. Louis, MO) mértük. A plazma inzulinszintet ultraérzékeny patkány inzulin ELISA készlettel határoztuk meg a Crystal Chem Inc-től (Downers Grove, IL). A plazma leptint az egér szérum Adipokine LINCOlex Kit (Cat # MADPK-71K) alkalmazásával határoztuk meg, és a plazma GLP-1 koncentrációt GLP-1 (aktív) ELISA kit (Cat # EGLP-35k, LINCO Research) segítségével mértük a gyártó utasításai szerint. Minden vizsgálatot két példányban végeztek.
A testösszetétel mérése
Az összes állat testösszetételét a mágneses magrezonanciával (NMR) mértük (17). Feljegyeztük az összes zsírtömeget (FM) és a szabad zsírtömeget (FFM).
A szénhidrát-anyagcsere értékelése
Az étrendek inzulin- és glükózparaméterekre gyakorolt hatását intraperitoneális glükóz tolerancia teszt (IPGTT) és inzulin tolerancia teszt (IPITT) alkalmazásával határoztuk meg, amelyeket a vizsgálat 11. és 12. hétén kaptunk. Egy éjszakán át tartó böjt után az IPGTT-t testtömeg-kilogrammonként 2 g glükóz (20% glükóz 0,9% NaCL-ben) intraperitoneális injekciójával végeztük, és a vércukorszintet a megadott időpontokban mértük az alábbiakban leírtak szerint (18). Az IPITT esetében intraperitoneális injekciójú humán inzulint (Eli Lilly Co, IN) 0,75 U/testtömeg-kg dózisban adtunk be 4 órás éhezés után. A teljes vércukorszintet a farokvénából mértük 0, 30, 60, 90 és 120 perccel az injekciók beadása után mind az IPGTT, mind az IPITT esetében a FreeStyle vércukorszint-ellenőrző rendszerrel (TheraSense, Phoenix, AZ).
Kvantitatív RT-PCR eljárás
A teljes RNS-t a gyomorszövetekből TRIzol Reagens (Invitrogen Corp) alkalmazásával extraháltuk. Az RNS elemzését és mennyiségi meghatározását RNA 6000 Nano LabChip készlettel végeztük (Agilent Technologies, Foster City, CA).
Az egér ghrelin amplifikációját egy lépésben hajtottuk végre (Brilliant QRT-PCR master mix kit (Cat # 60055, Stratagene), és a ciklofilin B mRNS-t SYBR Green QPCR master kit-rel (Cat # 600548, Stratagene) mértük a gyártó protokollja szerint. Minden egyes futtatás után megmértük az amplifikált PCR-termék relatív kvantitatív meghatározását a különböző mintákban. A célgén relatív koncentrációjának meghatározásához standard görbét használtunk, és az eredményeket a ciklofilin B koncentrációjának megfelelően korrigáltuk. a HFD-csoport százalékában kifejezve, a kontrollcsoport átlagát 100% -ra állítva, majd kiszámítva a többi 3 vizsgált állatcsoport mindegyikének egyedi értékét. TaqMan egér ghrelin (NM_01190296, Cat # 445046) primer-próba készleteket vásároltunk Applied Biosystems (Foster City, CA). Az egér ciklofilin B primereit a PRIMER EXPRESS szoftver (Applied Biosystems) felhasználásával terveztük meg. A cél gén primer párok a következők: egér ciklushoz lophilin (> NM_011149), Forward, 5'-TGGAGAGCACCAAGACA-GACA-3 'és Reverse, 5'-GTCGACAATGATGACATCCTTCA-3'. Ezeket az Integrated DNA Technologies, Inc. (Coralville, LA) cégtől szereztük be.
Statisztikai analízis
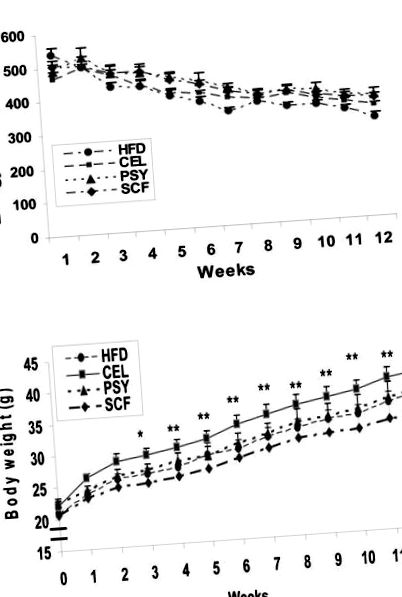
Valamennyi adatot átlag ± átlagos átlaghiba (SEM) formájában fejeztük ki. Az adatokat statisztikai szignifikancia szempontjából kétirányú ANOVA-val értékeltük, és P 1A ábra). Az összes testtömeg-egységben kifejezett átlagos energiafogyasztás a vizsgálat végén körülbelül 35 százalékkal csökkent a kiindulási értékkel összehasonlítva (1A. Ábra).
Energiabevitel, testtömeg-gyarapodás és testösszetételek a magas zsírtartalmú étrendben táplált egereket étkezési rostokkal kiegészítve és anélkül. Az 1. ábra egy kcal/testtömeg kg-ban kifejezett energiafogyasztást mutat be 12 héten keresztül. Az 1. B ábra az élelmi rostok testtömeg-növekedésre gyakorolt hatását mutatja. * P 1B ábra). A vizsgálat végén a nettó testtömeg-növekedés (átlag ± SEM) 12,4 ± 1,03 g volt az SCF csoportban, 14,38 ± 0,88 g egyedül a HFD esetében, 14,4 ± 1,6 g a PSY csoportban és 16,7 ± 1,3 g a CEL-ben csoportok. A nettó testtömeg-növekedés az SCF-ben, a HFD-ben és a PSY-csoportban szignifikánsan kisebb volt, mint a CEL-csoportban (P 2A ábra). A szabad zsírtömeg (FFM) az összes csoportban nem volt szignifikánsan különbözõ (2B. Ábra), kivéve a CEL csoportot a 8. héten (P 3A. Ábra). Az éhomi plazma inzulin sokkal alacsonyabb volt a PSY és az SCF csoportokban, mint a CEL csoportban a 4. héttől, és a vizsgálat végéig tartott (P 3B ábra). Az IPGTT adatok azt mutatták, hogy a glükózkoncentráció sokkal alacsonyabb volt a PSY és az SCF csoportokban, mint a kontroll és a CEL csoportokban (P 4A ábra). Az IPGTT alatti glükózgörbe alatti terület 945 ± 115 volt HFD-ben, 1101 ± 36 CEL-ben, 724 ± 39 PSY-ben és 667 ± 24 mg/dl SCF-csoportokban. Ezekben a csoportokban az IPITT eredményei hasonló tendenciát mutattak (4B. Ábra).
- Változó mennyiségű szénhidrát hatása az anyagcserére a fogyás után A táplálékforrás
- A táplálkozási menedzsment beavatkozásának hatása a terhességi súlygyarapodásra és a perinatális kimenetelre
- A méhek bél mikrobiotája a baktériumok anyagcseréje és a hormonális jelátvitel révén elősegíti a gazda súlygyarapodását
- Okozhat-e súlygyarapodást az IUD és milyen mellékhatások lehetnek
- A tejivás miatt hízik-e a tej; Hatások a testsúlyodra - Tejipari Ausztrália