Az étrendi só aktiválja az endotheliális prolinban gazdag tirozin-kináz 2/c-Src/foszfatidil-inozitol-3-kináz komplexet az endoteliális nitrogén-oxid-szintáz-foszforiláció elősegítése érdekében
A nephrológiai osztálytól (W.-Z.Y., K.A., P.W.S.), Orvostudományi Tanszék, valamint Fiziológiai és Biofizikai Tanszék (P.W.S.), Alabama Egyetem, Birmingham; és a Veteránügyi Ügyek Osztálya (P.W.S.), Birmingham, Ala.
A nephrológiai osztálytól (W.-Z.Y., K.A., P.W.S.), Orvostudományi Tanszék, valamint Fiziológiai és Biofizikai Tanszék (P.W.S.), Alabama Egyetem, Birmingham; és a Veteránügyi Ügyek Osztálya (P.W.S.), Birmingham, Ala.
A nephrológiai osztálytól (W.-Z.Y., K.A., P.W.S.), Orvostudományi Tanszék, valamint Fiziológiai és Biofizikai Tanszék (P.W.S.), Alabama Egyetem, Birmingham; és a Veteránügyi Ügyek Osztálya (P.W.S.), Birmingham, Ala.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
Bár számos laboratórium kimutatta, hogy az étrendi NaCl (só) bevitel növeli a rágcsálók és az emberek NO-termelését, a mechanizmust még nem fedezték fel. Jelen tanulmányban farmakológiai és domináns-negatív stratégiákat alkalmaztak annak bizonyítására, hogy a megnövekedett sótartalmú étrend etetése fiatal hím Sprague-Dawley patkányoknak egy prolinban gazdag tirozin-kináz 2-t tartalmazó endoteliális sejtjelző komplex kialakulását idézte elő., c-Src (más néven pp60 c-src ) és foszfatidil-inozitol-3-kináz. Magas sótartalmú étrend mellett a prolinban gazdag tirozin-kináz 2 szolgált a c-Src-közvetített foszfatidil-inozitol-3-kináz-aktiváció állványaként. A foszfatidil-inozitol-3-kináz volt a protein-kináz B (Akt) upstream aktivátora, amely felelős volt az NO-szintáz patkány endotheliális izoformjának S1176-nál történő foszforilezéséért, és ezáltal elősegítette az NO-termelés növekedését. Az egyesített eredmények jól illusztrálták a prolinban gazdag tirozin-kináz 2-jelátviteli komplex döntő szerepét a sóbevitelre adott endotheliális válaszban.
Az NO 1 szerepének az étrendi NaCl (ebben a cikkben „sónak” nevezett) változásában bekövetkező vérnyomásválaszokban mutatott szerepének eredeti leírását követően 1 későbbi tanulmány megerősítette, hogy a megnövekedett sóbevitel növelte a NO-termelést a 2–5-ös rágcsálókban és az egészséges emberekben . 6 A NO fontos szerepet játszik a sóbevitel változásaira adott hemodinamikai reakcióban. A só által kiváltott NO felszabadulás elősegíti az afferens arteriol vazorelaxációját, 7 növeli a glomeruláris szűrési sebességet, 8 és javítja a nyomás-natriuresis görbét, megkönnyítve a sókiválasztást. A NO gátlása sóvisszatartást és sóérzékeny magas vérnyomást eredményez 10, és ha elhúzódik, vesekárosodáshoz vezet, különösen akkor, ha az állatokat magas sótartalmú étrenden tartják. 11.
Kimutatták az endothelium közvetlen szerepét a NO-termelés közvetítésében a magas sótartalmú étrend hatására. 12 Úgy tűnik, hogy a sóbevitel növeli az endoteliális NO-termelést a nyíróerők létrehozásával. 13–15 A NO-szintáz endoteliális izoformája, amelyet ebben a cikkben „NOS3” -nak neveznek, egy erősen szabályozott enzim, amelyet számos poszttranszlációs esemény vezérel, amelyek magukban foglalják a NOS3 többszörös szerin- és treonin-maradékainak foszforilezését. Noha a NOS3 enzimaktivitás függ a kalcium/kalmodulin komplex NOS3-hoz való kötődésétől, az autoinhibitorikus hurok kiszorításától és a funkció aktiválásától, számos laboratórium kimutatta, hogy a nyírófeszültség elősegíti a NOS3 kalcium-független aktiválódását is. Jelen álláspont szerint az NOS3 kalcium/kalmodulin aktiválása csak az NO tranziens növekedéséért felelős, míg más poszttranszlációs események hosszabb ideig tartó NO felszabadulást biztosítanak a NOS3-ból. 18,19 Különösen az NOS3 szubsztrátja lehet a protein-kináz B-nek (Akt), amely elősegíti a szerin-foszforilációt az 1176-os maradéknál az NOS3 karboxi-terminális részében, és növeli a NOS3-érzékenységet a kalcium/kalmodulin és az enzimaktivitás iránt. 20
A legújabb tanulmányok azt mutatják, hogy az étrendi sóbevitel aktiválja a prolinban gazdag tirozin-kináz 2-t (Pyk2). 21 A Pyk2 (más néven FAK2, CAK-ß, CADTK vagy RAFTK) a fokális adhéziós fehérje tirozin-kináz család tagja. Ezt a nonreceptoros tirozin-kinázt tipikusan extracelluláris stressz szignálok, például nyírófeszültség, 23, valamint G-fehérjéhez kapcsolt receptorok, például az 1-es típusú angiotenzin receptorok aktiválják. A 22,24 Pyk2-nek több kötőpartnere van, amelyek között van a c-Src, a 60 kDa fehérje c-src (más néven pp60 c-src ), a foszfatidil-inozitol-3-kináz (PI3-kináz) és a Grb2. 22,25–27 A Pyk2-hez való kötődés aktiválja a c-Src és a PI3-kinázt, és ez a jelátviteli komplex különféle intracelluláris folyamatokban vesz részt. 22,28 Mivel a PI3-kináz az Akt egy upstream aktivátora, ezért ezt a tanulmányt arra terveztük, hogy meghatározzuk, vajon a NOS3 S1176 foszforilációs állapotának növekedése okozza-e a megnövekedett endoteliális NO-termelést, amely a megnövekedett állapotban jelentkezik sóbevitel és az étrendi sóbevitel indukál-e egy Pyk2/c-Src/PI3-kináz komplexet, amely viszont az Akt aktiválásával növeli a NOS3 aktivitást.
Mód
Állatok és szövetek előkészítése
In vitro inkubációs vizsgálatok
A tapadó zsír és a kötőszövet eltávolítása után az aortát 3 mm-es gyűrűszakaszokra vágtuk, és 48 lyukú lemezekre helyeztük. Az izolált glomerulusokat (5 × 103 glomerul/milliliter), amelyeket vesekéregszövet szitálásával állítottunk elő, és az aorta gyűrű készítményeket hideg PBS-sel mostuk. A pelletált glomerulusokat és az aorta gyűrűszegmenseket szérummentes közegben (DMEM; Invitrogen Corporation) szuszpendáltuk, amely önmagában vivőanyagot, 5 μmol/l tirfosztin A9-t (EMD Biosciences, Inc.) vagy 10 μmol/l PP2-t tartalmazott (EMD Biosciences, Inc.). ). A tirfosztin A9 a Pyk2, 32 és PP2, 4-amino-5- (4-klór-fenil) -7- (t-butil) pirazolo [3,4-d] pirimidin), erős, sejteket áteresztő, Src családba tartozó szelektív tirozin-kináz inhibitor. 33
Tanulmányok in vivo
Koimmunprecipitációs vizsgálatok
Koimmunprecipitációs vizsgálatokat végeztek az étrendi sóbevitel hatásának jellemzésére a Pyk2 és PI3-kináz kölcsönhatásaira. Az in vivo vizsgálatokban használt patkányokból 500 μg teljes fehérjét tartalmazó szöveti lizátumokat nyertünk, amelyeket 2 μg anti-Pyk2 poliklonális antitesttel (sejtjelzés) inkubáltunk 4 ° C-on 2 órán át, majd 30 ° C hozzáadásával. μL fehérje A-Sepharose és inkubálás. Az immunszemcséket háromszor jéghideg radioimmunprecipitációs vizsgálati pufferrel mossuk, majd ditiotreitolt tartalmazó SDS mintapufferben forraljuk. A fehérjéket 7,5% SDS-poliakrilamid géleken oldottuk fel, és polivinilidén-fluorid membránokra vittük át. A membránokat antitestekkel vizsgáltuk, amelyek a PI3-kináz (p110a, p110β, p110γ és p110δ) és a p85 szabályozó alegység (Upstate Chemicon) katalitikus egységének 4 izoformája ellen irányultak. Az immunreaktív sávokat fokozott kemilumineszcencia alkalmazásával tettük láthatóvá.
Statisztikai analízis
Az adatokat átlag ± SE-ként fejeztük ki. Jelentős különbségeket az adatsorok között az ANOVA határozott meg posthoc teszteléssel (Fisher's védett legkevésbé szignifikáns különbség; Statview 5.0, SAS Institute, Inc.). P 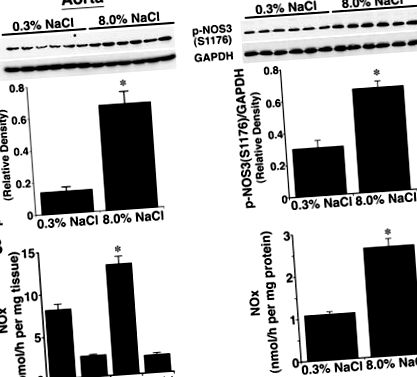
1.ábra. Az étrendi sóbevitel hatása az S1176 NOS3 foszforilációjára, a foszforilezett NOS3 sűrűségének a GAPDH és NO termelésének arányában kifejezve. A, Western analízis aorta és izolált glomeruláris készítmények lizátumainak felhasználásával. Patkányoktól 8,0% NaCl-diétával nyert érszövetekben a p-NOS3 (S1176) mennyisége nagyobb volt (P
2. ábra. Az LY294002 intravénás beadásának hatása a p-NOS3-ra (S1176), a foszforilezett NOS3: GAPDH sűrűségének arányában kifejezve. Az LY294002 a p-NOS3 (S1176) expresszióját olyan szintre csökkentette, amely nem különbözött a p-NOS3 (S1176) szintjétől a patkányok 0,3% -os NaCl-étrenden kapott érszövetében. A gélek minden sávja egyetlen patkányból nyert lizátumot jelent (n = 3 patkány mindegyik csoportban). *P
A NOS3 étrendi só általi aktiválása Pyk2/c-Src/PI3-kináz-függő mechanizmuson keresztül történt
Korábbi tanulmányok kimutatták, hogy az étkezési só egy endoteliális Pyk2/c-Src komplex foszforilációját és aktivációját indukálta. 21 Annak tesztelésére, hogy ezek az enzimek részt vesznek-e a NO-termelésben a fokozott sófogyasztás során, az első kísérletek során mindkét étrenden patkányok szövetmintáit inkubáltuk olyan táptalajban, amely tirphostin A9-t, Pyk2-gátlót, 32-et és PP2-t, c-Src inhibitorot tartalmaz A tápközegbe történő 33 és NOx kibocsátást számszerűsítettük. Mindkét inhibitor csökkentette az NOx termelést az aorta szegmensek és az izolált glomerulusok által (3. ábra). Ezután domináns-negatív megközelítést alkalmaztak annak meghatározására, hogy a Pyk2 közvetlenül részt vesz-e az Akt-aktivációban. A vizsgálat előtti napon 1,25 nmol Tat-AP, Tat-PBM és Tat-GBM fehérjét adtunk IV-ben mindkét étrendben lévő patkánycsoportoknak (4. ábra). Bár a Tat-GBM nem változtatta meg az Akt foszforilációs állapotát a T308-nál és az S473-nál a patkányok aorta- és glomeruláris lizátumaiban 8,0% -os NaCl-étrend mellett, mind a Tat-AP, mind a Tat-PBM csökkent (P A kombinált kísérletek azt mutatták, hogy a Tat-AP és a Tat-PBM megszakította az Akt-t aktiváló Pyk2/c-Src/PI3-kináz jelátviteli komplexet. Más vizsgálatokban mind a Tat-AP, mind a Tat-PBM, de a Tat-GBM nem, szintén csökkentette a p-NOS3 (S1176) relatív szintjét a patkányokban lévő szövetekben a 8,0% -os NaCl-étrend mellett (6. ábra). Amikor a 8,0% NaCl-diétával rendelkező patkányokból származó aortagyűrűket és izolált glomerulusokat in vitro inkubáltunk, a Tat-AP és Tat-PBM, de a Tat-GBM nem, a megfelelő tápközegben megfigyelt szintre csökkentette a NOx felszabadulását a táptalajba. patkányminták 0,3% NaCl-étrenden (7. ábra). A kísérlet reggelén kapott vizelet NOx: kreatinin arányok a vizelet NOx várható növekedését mutatták a patkánycsoportokban a 8,0% NaCl-étrenden, összehasonlítva a 0,3% NaCl-étrendet tartalmazó patkánycsoportokkal (8. ábra). A Tat-AP és a Tat-PBM parenterális beadása csökkentette a vizelet NOx: kreatinin szintjét, amely nem különbözött a 0,3% NaCl-diétán tartott és önmagában vivőanyag-kezelésben részesített patkánycsoportban megfigyeltektől.
3. ábra. A tirphostin A (Tyr) és a PP2 hozzáadásának hatása az NOx közegbe történő felszabadulására aortagyűrűk (felső) és izolált glomerulusok (alul) révén. Tyr és PP2 hozzáadása csökkent (P
4. ábra. A Tat fúziós fehérjék intravénás beadásának hatása a p-Akt (T308) és p-Akt (S473) Akt expressziójára aorta- és glomeruláris készítményekben. Az összes Akt-szint nem különbözött a két patkánycsoportból (mindegyik csoportban n = 4 patkány) kapott szövetek között a 2 NaCl-diéta során. A vivőanyagot (vehikulum) kapott patkányokhoz képest a Tat-AP és a Tat-PBM beadása, de a Tat-GBM nem, csökkent (P
5. ábra. A Tat fúziós fehérjék intravénás beadásának hatása a Pyk2 és a PI3-kináz komponenseinek asszociációjára. Miután mindkét étrenden az aortaszövet lizátumaiból és a patkányok izolált glomerulusaiból Pyk2 immunprecipitált, a pelletált mintákat SDS-PAGE alkalmazásával elválasztottuk, és p110a és p85-re vizsgáltuk. A Tat-AP és a Tat-PBM intravénás beadása, de a Tat-GBM nem, megzavarta a Pyk2 és a p110α és a p85 kapcsolatát a patkányokban 8,0% NaCl-étrenden nyert mintákban, de a Pyk2-hez való kötődést nem változtatta meg patkányok lizátumaiban. 0,3% NaCl diéta. Minden sáv egyetlen patkány adatait mutatja (n = 3 patkány minden csoportban).
6. ábra. A Tat fúziós fehérjék intravénás beadásának hatása a p-NOS3 (S1176) expressziójára a GAPDH-hoz képest az aorta szövetben és az izolált glomerulusokban. A Tat-AP és a Tat-PBM intravénás beadása, de a Tat-GBM nem, csökkentette a p-NOS3 (S1176) expresszióját olyan szintre, amely nem különbözött a 0,3% NaCl-étrenden lévő patkánycsoportoktól. A gél minden sávja egyetlen állatot képvisel; Minden csoportban 4 patkányt vizsgáltunk. *P
7. ábra. A Tat fúziós fehérjék intravénás beadásának hatása az aortagyűrűk és izolált glomerulusok NOx termelésére (n = 4 patkány mindegyik csoportban). A Tat-AP és a Tat-PBM beadása, de a Tat-GBM nem, csökkentette az NOx-termelést mindkét érszövetben olyan szintre, amely nem különbözött a 0,3% NaCl-étrenden patkányok érszöveteit használva megfigyelt termelési sebességtől. *P
8. ábra. A Tat fúziós fehérjék intravénás beadásának hatása az NOx vizelettel történő kiválasztására in vivo (n = 4 patkány mindegyik csoportban). A Tat-AP és a Tat-PBM csökkentette az NOx/kreatinin szintet azokhoz a patkányokhoz, amelyek 0,3% NaCl-étrendet kaptak. *P 0,05 szemben azzal a csoporttal, amely 0,3% -os NaCl-diétát és vivőanyagot kapott (Veh).
Vita
Felülvizsgálták a NOS3 aktivitását megváltoztató poszttranszlációs események sokféleségét. Az 1176-os aminosav-maradék 19,39-es szerin-foszforilezése az NOS3 karboxil-terminális részében különösen fontos szabályozója az enzimaktivitásnak és a kalcium/kalmodulin aktivációra való érzékenységnek. 20 Az Akt kivételével az AMP-kináz, a protein-kináz A, a protein-kináz G és a kalcium/kalmodulin-függő protein-kináz II szerepet játszik az NOS3 foszforilációs állapotának szabályozásában 1176-ban. 19,39 A szelektív érintettség bizonyítékai az Akt só által közvetített NOS3 foszforilációjában annak demonstrálását tartalmazta, hogy az Akt aktivációt és a NOS3 foszforilációt megakadályozta a PI3-kináz toborzásának és aktivációjának gátlása a Pyk2 által az étrendi sóbevitel növekedése után, és az LY294002 csökkentette a p-NOS3 értékét (S1176) A 8,0% NaCl-étrendben részesülő állatok szintje a 0,3% -os NaCl-étrenden patkányokban megfigyeltekhez képest. Mivel ez utóbbi megfigyelés azt sugallta, hogy az 1176-os foszforilezés elegendő az NO-termelés növekedésének magyarázatához, a NOS3 egyéb poszttranszlációs módosításai, például a NOS3 tirozin-foszforilációja a T83-nál, amely szintén növeli a NOS3 aktivitását és a c-Src-n keresztül történik, 40-et nem vizsgáltak.
Az adatok, amelyek a NOS3 fokozott foszforilációját mutatják az S1176-nál a glomerulusokban, ellentmondanak Mount et al., 5 megállapításainak, akik azt is kimutatták, hogy az NOx termelése nőtt az étrendi só növekedésével, de nem mutatták az S1176 foszforilációjának növekedését a vese lizátumokban. Új módszerük a NOS3 kvantitatív meghatározására kezdetben a teljes vese lizátumokból történő kicsapást használta 2 ', 5′-ADP Sepharose alkalmazásával; eltekintve ezzel a technikával kapcsolatos technikai aggályoktól, a vese lizátumok alkalmazásának megközelítése potenciálisan elhomályosítja a p-NOS3 regionális vagy helyi expressziójának változásait.
Azáltal, hogy lehetővé tettük fehérje-gátlóink intracelluláris bejuttatását vírus vektorok nélkül, 41,42 a Tat fúziós fehérjék használata lehetővé tette a hipotézis további tesztelését in vivo körülmények között. 21 A Tat fúziós fehérjéket (Tat-AP, Tat-PBM és Tat-GBM) úgy terveztük, hogy specifikusan zavarják a Pyk2 c-Src, p85 és Grb2 kötődését. Számos laboratórium függetlenül bizonyította ezen inhibitorok hatékonyságát. 21,43,44 Mind a Tat-AP, mind a Tat-PBM hozzáadása gátolta a p85 és a p110a kötődését a Pyk2-hez, majd az Akt ezt követő aktiválódását és a NOS3 foszforilezését. Ezen adatok egyik értelmezése szerint a c-Src kötődése a Pyk2-hez, amely a c-Src-n lévő SH3 doménen keresztül történik, 45,46 volt elengedhetetlen a Pyk2-hez való kötődéshez és a PI3-kináz aktiválásához. Az adatok összhangban voltak Taniyama és mtsai (28) eredményeivel, akik kimutatták, hogy az aktivált Pyk2 állványként szolgál a c-Src-függő PI3-kináz aktiváció elősegítésére. A Tat-GBM alkalmazásával előállított adatok azt mutatták, hogy a Grb2-nek nincs szerepe az étrendi só által kiváltott NO-termelésben, és a Tat-GBM további engedélyezett felhasználása további kontrollként a Tat fúziós fehérje kísérletekhez.
Perspektívák
A finanszírozás forrásai
A Nemzeti Egészségügyi Intézet támogatása (R01 DK46199) és a Kutatási és Fejlesztési Hivatal, Orvosi Kutatási Szolgálat, Veteránügyi Minisztérium támogatta ezt a kutatást.
- Diétás só, magas vérnyomás és egyéb egészségre káros hatások - ScienceDirect
- Diétás só
- Az étrendi só a bél által indított TH17 válasz révén elősegíti a neurovaszkuláris és kognitív diszfunkciókat
- Diétás só, a néma gyilkos Mennyi az sok
- Az étrendi sókiegészítés hatása a tilápia növekedésére, túlélésére és takarmány-felhasználására The Fish