Az étrendi só a bél által indított TH17 válasz révén elősegíti a neurovaszkuláris és kognitív diszfunkciókat
Tárgyak
Absztrakt
A sóban gazdag étrend az agyi érrendszeri betegségek és a demencia fokozott kockázatához kapcsolódik, de továbbra sem világos, hogy az étrendi só hogyan árt az agynak. Beszámolunk arról, hogy egerekben az étkezési sófelesleg elnyomja a nyugalmi agyi véráramlást és az endoteliális funkciót, ami kognitív károsodáshoz vezet. A hatás a TH17 sejtek vékonybélben való terjeszkedésétől függ, ami a plazma interleukin-17 (IL-17) jelentős növekedését eredményezi. Az IL-17 keringése viszont elősegíti az endothel diszfunkciót és a kognitív károsodást az endotheliális nitrogén-oxid szintáz Rho kináz-függő gátló foszforilezésével és az agyi endoteliális sejtek csökkent nitrogén-oxid termelésével. Az eredmények egy új bél – agy tengelyt tárnak fel, amely az étrendi szokásokat összekapcsolja a kognitív károsodással egy bél által indított adaptív immunválasz révén, amely az IL-17 keringésével az agy működését veszélyezteti. Így a TH17 sejt – IL-17 útvonal feltételezett célpont az étrendi só és a TH17 polarizációval járó egyéb betegségek okozta káros agyi hatások leküzdésére.
Hozzáférési lehetőségek
Feliratkozás a Naplóra
Teljes napló hozzáférést kap 1 évre
csak 4,60 € kiadásonként
Az árak nettó árak.
Az áfát később hozzáadják a pénztárhoz.
Cikk bérlés vagy vásárlás
Időben korlátozott vagy teljes cikkelérést kaphat a ReadCube-on.
Az árak nettó árak.
Hivatkozások
Mozaffarian, D. és mtsai. Globális nátriumfogyasztás és kardiovaszkuláris okokból bekövetkező halál. N. Engl. J. Med. 371, 624–634 (2014).
Zemel, M. B. és Sowers, J. R. sóérzékenység és szisztémás magas vérnyomás idősekben. Am. J. Cardiol. 61, 7H – 12H (1988).
Farquhar, W. B., Edwards, D. G., Jurkovitz, C. T. & Weintraub, W. S. Étrendi nátrium és egészség: nem csak vérnyomás. J. Am. Coll. Cardiol. 65, 1042–1050 (2015).
Appel, L. J. és mtsai. A lakosság egészére kiterjedő nátrium-csökkentés fontossága a szív- és érrendszeri betegségek és a stroke megelőzésének eszközeként: felhívás az American Heart Association fellépésére. Keringés 123., 1138–1143 (2011).
Orvostudományi Intézet (USA) a nátrium bevitelének csökkentésére irányuló stratégiák bizottsága. Stratégiák a nátrium bevitel csökkentésére az Egyesült Államokban. (Henney, J. E., Taylor, C. L. és Boon, C. S. szerk.) (National Academies Press, Washington DC, 2010).
Kotchen, T. A., Cowley, A. W. Jr. és Frohlich, E. D. só az egészségben és a betegségekben - kényes egyensúly. N. Engl. J. Med. 368, 1229–1237 (2013).
Nicholls, M. G. A populáció egészére kiterjedő étrendi nátrium-korlátozás: óvatos nézet. Curr. Hypertens. ismétlés. 13., 325–327 (2011).
Oh, Y. S. és mtsai. Az Országos Szív-, Tüdő- és Vérintézet munkacsoport jelentése a sóról az emberi egészségben és betegségben: a jelenlegi tudományos bizonyítékokra építve. Magas vérnyomás 68, 281–288 (2016).
Heye, A. K. és mtsai. Vérnyomás és nátrium: asszociáció MRI markerekkel agyi kisérbetegségben. J. Cereb. Véráram. Metab. 36, 264–274 (2016).
Strazzullo, P., D’Elia, L., Kandala, N.-B. & Cappuccio, F. P. sófelvétel, stroke és szív- és érrendszeri betegségek: a prospektív vizsgálatok metaanalízise. Br. Med. J. 339, b4567 (2009).
Boegehold, M. A. A magas sóbevitel hatása az endotheliális funkcióra: csökkent érrendszeri nitrogén-oxid magas vérnyomás hiányában. J. Vasc. Res. 50, 458–467 (2013).
Cosic, A. és mtsai. A középső agyi artériák gyengített áramlás által indukált dilatációja a rövid távú, magas sótartalmú étrendben lévő patkányokban megnövekedett vaszkuláris oxidatív stresszel függ össze. J. Physiol. (Lond.) 594, 4917–4931 (2016).
Iadecola, C. A neurovaszkuláris egység nagykorúvá válása: utazás a neurovaszkuláris kapcsolaton keresztül az egészség és a betegségek terén. Idegsejt 96, 17–42 (2017).
Iadecola, C. A vaszkuláris demencia patobiológiája. Idegsejt 80, 844–866 (2013).
Kleinewietfeld, M. és mtsai. A nátrium-klorid az autoimmun betegséget a patogén TH17 sejtek indukciójával hajtja. Természet 496, 518–522 (2013).
Wu, C. és mtsai. Patogén TH17 sejtek indukálása indukálható sót érzékelő kináz SGK1-vel. Természet 496, 513–517 (2013).
Kebir, H. és mtsai. Az emberi TH17 limfociták elősegítik a vér-agy gát lebontását és a központi idegrendszer gyulladását. Nat. Med. 13., 1173–1175 (2007).
Nguyen, H. és mtsai. Az interleukin-17 Rho-kináz által közvetített endotheliális diszfunkciót és magas vérnyomást okoz. Cardiovasc. Res. 97, 696–704 (2013).
Powles, J. és mtsai. Globális, regionális és országos nátrium-bevitel 1990-ben és 2010-ben: a 24 órás vizelettel történő kiválasztás szisztematikus elemzése és étrendi felmérések világszerte. BMJ Open. 3, e003733 (2013).
Cochet, H. és mtsai. A só által kiváltott hipertóniás szívbetegség átfogó fenotipizálása élő egerekben szívmágneses rezonancia segítségével. Eur. Radiol. 23, 332–338 (2013).
Schlote, J. és mtsai. Magas sótartalmú étrend szív- és érrendszeri és vesehatásai alacsony nephronszámú GDNF +/- egerekben. Vese vérnyomás. Res. 37, 379–391 (2013).
Jackman, K. A. és mtsai. A krónikus intermittáló hypoxia dichotóm hatása a fokális agyi iszkémiás károsodásra. Stroke 45, 1460–1467 (2014).
Toda, N., Ayajiki, K. & Okamura, T. agyi véráramlás szabályozása nitrogén-oxiddal: legújabb fejlemények. Pharmacol. Fordulat. 61, 62–97 (2009).
Wang, G. és mtsai. Az angiotenzin II lassú nyomású hipertónia fokozza az NMDA áramokat és az NOX2-függő szuperoxid termelést a hipotalamusz paraventricularis neuronjaiban. Am. J. Physiol. Regul. Integr. Comp. Physiol. 304, R1096 – R1106 (2013).
Chen, B. R., Kozberg, M. G., Bouchard, M. B., Shaik, M. A. & Hillman, E. M. C. A vaszkuláris endothelium kritikus szerepe az agy funkcionális neurovaszkuláris csatolásában. J. Am. Heart Assoc. 3, e000787 (2014).
Poggesi, A., Pasi, M., Pescini, F., Pantoni, L. & Inzitari, D. Az endotheliális diszfunkció keringő biológiai markerei agyi kisérbetegségben: áttekintés. J. Cereb. Véráram. Metab. 36, 72–94 (2016).
Cohen, S. J. és mtsai. A rágcsáló hippocampus elengedhetetlen a nem térbeli tárgyi memória számára. Curr. Biol. 23, 1685–1690 (2013).
Barnes, C. A. Az öregedéssel járó memóriahiányok: neurofiziológiai és viselkedési vizsgálat patkányon. J. Comp. Physiol. Psychol. 93, 74–104 (1979).
Deacon, R. M. A fészeképítés értékelése egerekben. Nat. Protokoll. 1, 1117–1119 (2006).
Rosenblum, W. I., Nelson, G. H. & Shimizu, T. L-argininfúzió helyreállítja az acetilkolinra adott reakciót a sérült endothelium agyi arteriolákban. Am. J. Physiol. 262, H961 – H964 (1992).
Harris, M. B. és mtsai. Az endoteliális nitrogén-oxid szintáz kölcsönös foszforilációja és szabályozása a bradikinin stimulációra adott válaszként. J. Biol. Chem. 276, 16587–16591 (2001).
Smith, L., Payne, J. A., Sedeek, M. H., Granger, J. P. & Khalil, R. A. a magas sótartalmú étrend során fokozódik az érösszehúzódás Ca2 + belépési mechanizmusainak endotelin-indukálta növekedése. Magas vérnyomás 41, 787–793 (2003).
Faraco, G. és mtsai. A keringő endotelin-1 megváltoztatja az agy mikrocirkulációját szabályozó kritikus mechanizmusokat. Magas vérnyomás 62, 759–766 (2013).
Benakis, C. és mtsai. A kommensális mikrobiota a bél γδ T-sejtjeinek szabályozásával befolyásolja az iszkémiás stroke kimenetelét. Nat. Med. 22., 516–523 (2016).
Hernandez, A. L. et al. A nátrium-klorid gátolja az FOXP3 + szabályozó T-sejtek szuppresszív működését. J. Clin. Invest. 125, 4212–4222 (2015).
Kipnis, J. Az adaptív immunitás és a központi idegrendszer közötti sokoldalú kölcsönhatások. Tudomány 353, 766–771 (2016).
Faraco, G. és mtsai. A perivaszkuláris makrofágok közvetítik a magas vérnyomáshoz kapcsolódó neurovaszkuláris és kognitív diszfunkciókat. J. Clin. Invest. 126., 4674–4689 (2016).
Binger, K. J. és mtsai. A magas sótartalom csökkenti az IL-4- és IL-13-stimulált makrofágok aktiválódását. J. Clin. Invest. 125, 4223–4238 (2015).
Mandala, S. és mtsai. A limfocita kereskedelem megváltoztatása szfingozin-1-foszfát receptor agonistákkal. Tudomány 296, 346–349 (2002).
Sugimoto, M. és mtsai. A Rho-kináz foszforilálja az eNOS-t a treonin 495-nél az endoteliális sejtekben. Biochem. Biophys. Res. Commun. 361, 462–467 (2007).
Guterbaum, T. J. és mtsai. Az endoteliális nitrogén-oxid-szintáz foszforilációja a Threonine 495-nél és a mitokondriális reaktív oxigénfajok képződése a magas H2O2-koncentrációra válaszul. J. Vasc. Res. 50, 410–420 (2013).
Katusic, Z. S. és Austin, S. A. endotheliális nitrogén-oxid: az egészséges elme védője. Eur. J szív. 35, 888–894 (2014).
Love, S. & Miners, J. S. Agyi hipoperfúzió és az energiahiány Alzheimer-kórban. Brain Pathol. 26., 607–617 (2016).
Garthwaite, J. Az idegi nitrogén-oxid által közvetített átvitel fogalmai. Eur. J. Neurosci. 27., 2783–2802 (2008).
Gu, C., Wu, L. & Li, X. IL-17 család: citokinek, receptorok és jelátvitel. Citokin 64., 477–485 (2013).
Tablazon, I. L. D., Al-Dabagh, A., Davis, S. A. és Feldman, S. R. A szív- és érrendszeri rendellenességek kockázata pikkelysömörben szenvedő betegeknél: jelenlegi és jövő. Am. J. Clin. Dermatol. 14, 1–7 (2013).
Liou, T.-H. et al. A stroke kockázata reumás betegeknél: országos longitudinális populációalapú vizsgálat. Sci. ismétlés. 4, 5110 (2014).
Ferro, J. M., Oliveira, S. N. & Correia, L. A gyulladásos bélbetegségek neurológiai megnyilvánulásai. Handb. Clin. Neurol. 120, 595–605 (2014).
Marshall, O. és mtsai. Károsodott cerebrovascularis reaktivitás sclerosis multiplexben. JAMA Neurol. 71., 1275–1281 (2014).
Park, L. és mtsai. A CD36 scavenger receptor elengedhetetlen az amyloid-beta által kiváltott cerebrovaszkuláris oxidatív stressz és neurovaszkuláris diszfunkció szempontjából. Proc. Natl. Acad. Sci. USA 108., 5063–5068 (2011).
Köszönetnyilvánítás
Hálásan köszönjük a Feil Family Foundation támogatását. Ezt a munkát az Országos Egészségügyi Intézet R37-NS089323 (CI) és 1R01-NS095441 (CI) támogatása, az American Heart Association (GF) tudós fejlesztési támogatása és a Fondation Leducq (Sphingonet) hálózati támogatása támogatta ( CI, JA, GF).
Szerzői információk
Hovatartozások
Feil Family Brain and Mind Research Institute, Weill Cornell Medicine, New York, NY, USA
Giuseppe Faraco, David Brea, Lidia Garcia-Bonilla, Gang Wang, Gianfranco Racchumi, Haejoo Chang, Izaskun Buendia, Monica M. Santisteban, Steven G. Segarra, Kenzo Koizumi, Yukio Sugiyama, Michelle Murphy, Joseph Anrather & Costantino Iadecola
Radiológiai Osztály, Weill Cornell Medicine, New York, NY, USA
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
Hozzájárulások
Tanulmányterv: C.I., J.A. és G.F. Kísérletek lebonyolítása és adatgyűjtés: G.F., D.B., L.G.B., G.W., G.R., H.C., I.B., M.M.S., S.G.S., K.K., Y.S., M.M. és H.V. Adatok elemzése: G. F., D. B., G. W., H. C., I. B., M. M. S. és K.K. A kézirat megírása: G.F. és C.I.
Levelezési cím
Etikai nyilatkozatok
Versenyző érdekek
A szerzők kijelentik, hogy nincsenek versengő pénzügyi érdekeik.
További információ
A kiadó megjegyzése: A Springer Nature semleges marad a közzétett térképeken és az intézményi kapcsolatokban szereplő joghatósági igények tekintetében.
Integrált kiegészítő információk
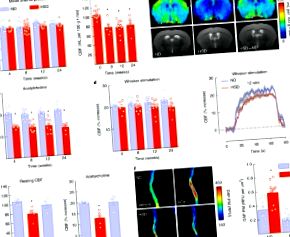
Kiegészítő 1. ábra A HSD hatása a testtömegre, az energiafogyasztásra, a szisztolés vérnyomásra, a hippocampalis nyugalmi CBF-re, valamint az adenozin és a whisker stimulációra adott CBF válasz.
A-C: A HSD nem változtatja meg a bajuszstimulációra és az adenozinra adott MAP vagy CBF reakciókat IL17 -/- és Rag1 -/- egerekben, vagy WT egerekben, amelyek IL17 semlegesítő antitesteket kapnak. IL17 -/-, MAP, étrend: p = 0,1864, genotípus: p = 0,2153; ND WT/IL17 -/- n = 5/4, HSD WT/IL17 -/- n = 8/6; Pofaszakáll, étrend: p = 0,5651, genotípus: p = 0,8474, WT/IL17 -/- n = 6/4, HSD WT/IL17 -/- n = 7/6; Adenozin, diéta: p = 0,8710, genotípus: p = 0,1662; WT/IL17 -/- n = 6/4, HSD WT/IL17 -/- n = 7/7 egér/csoport. Rag1 -/-, MAP, étrend: p = 0,0619, genotípus: p = 0,4521; ND WT/Rag1 -/- n = 4/8, HSD WT/Rag1 -/- n = 8/10; Pofaszakáll, étrend: * p = 0,0094, genotípus: p = 0,5461, WT/Rag1 -/- n = 5/8, HSD WT/Rag1 -/- n = 8/8; Adenozin, diéta: p = 0,6543, genotípus: p = 0,7647; WT/Rag1 -/- n = 5/7, HSD WT/Rag1 -/- n = 8/9 egér/csoport (Kétirányú ANOVA és Tukey-teszt). D: Az IL-17 beadása WT egerekben nem befolyásolja az MAP-t vagy az adenozin által termelt CBF növekedést; TÉRKÉP: p = 0,7772 vs jármű; Veh/IL-17 n = 7-8/egerek; Adenozin: p = 0,7102 vs Veh; Veh/IL-17 n = 7-8/egércsoport (páros t-teszt, kétfarkú). Az adatokat átlag ± SEM-ben fejezzük ki.
8. kiegészítő ábra Az agyi perivaszkuláris makrofágok és az FTY720 vagy Y27632 kimerülésének hatása a CBD-válaszokra HSD-vel táplált egerekben.
A: A PVM klodronát általi kimerülése nem javítja az endotheliális diszfunkciót HSD-diétával táplált egereknél; Diéta: * p 0,05 vs ND; Pofaszakáll, étrend: p = 0,5397, kezelés: p = 0,5804; ND Veh/Y27632 n = 6/6, HSD Veh/Y27632 n = 6/8; Adenozin, diéta: p = 0,5712, kezelés: p = 0,4964; ND Veh/Y27632 n = 6/6, HSD Veh/Y27632 n = 6/7 egér/csoport (kétirányú ANOVA és Tukey-teszt). Az adatokat átlag ± SEM-ben fejezzük ki.
Kiegészítő 9. ábra: Az IL-17 alkalmazásának hatása az eNOS foszforilációjára emberi agyi endothel sejtekben (HBEC.5i).
A: Az IL-17 (1-10 ng/ml) növeli az eNOS foszforilációját a Thr495-en, ezt a hatást a ROCK inhibitor Y27632 (5 μM) beadása elvetette. * p = 0,0026; Vivőanyag: IL-17 0 ng/ml n = 8; IL-17 1 ng/ml n = 7, IL-17 10 ng/ml n = 5; Y27632: IL-17 0-10 ng/ml n = 4 független kísérlet/csoport (egyirányú ANOVA és Tukey-teszt). B-D: A HSD növeli az eNOS gátló foszforilációját a Thr495-nél WT egerekből izolált izolált pial mikrovaszkuláris készítményekben és IgG kontroll antitesttel vagy hordozóval injektált egerekben. WT: * p = 0,0380 vs ND; ND/HSD n = 3/6; IgG: * p = 0,0272 vs ND; ND/HSD n = 5/6; Veh: * p = 0,0177 vs ND; ND/HSD n = 3/4 egér/csoport (páros t-teszt, kétfarkú). Az adatokat átlag ± SEM-ben fejezzük ki. Az A, B, C és D immunblotokat levágják. Az immunblotok teljes gélképeit a 14. kiegészítő ábra mutatja.
Kiegészítő 10. ábra Az IL-17 és TNF-α adagolásának hatása a proinflammatorikus mediátorok mRNS szintjére az agy endothelsejtjeiben (bEnd.3).
A sejteket FSC-SSC kapuzással megkülönböztettük, majd CD45 + CD4 + TCRγ-IL17 + (Th17 sejtek) vagy CD45 + CD4-TCRyδ + IL17 + (IL17 + γδ T sejtek) kapukra kaptuk.
Kiegészítő információk
Kiegészítő szöveg és ábrák
Kiegészítő 1–15. Ábra és 1. és 2. táblázat
- Diétás sóbevitel és mortalitás 2-es típusú cukorbetegségben szenvedő betegeknél
- Diétás só, a néma gyilkos Mennyi az sok
- Diétás só, magas vérnyomás és egyéb egészségre káros hatások - ScienceDirect
- Az étrendi só aktiválja az endoteliális prolinban gazdag tirozin kináz 2c-Src foszfatidil-inozitolt
- Az étrendi sókiegészítés hatása a tilápia növekedésére, túlélésére és takarmány-felhasználására The Fish