Indol-3-karbinol: növényi hormon a rák ellen
Katz Ella
1 Növénytudományi és élelmezésbiztonsági iskola, Tel-Avivi Egyetem, Tel-Aviv, Izrael
2 Növénytudományi Tanszék, Kaliforniai Egyetem, Davis, USA
Sophia Nisani
1 Növénytudományi és élelmezésbiztonsági iskola, Tel-Avivi Egyetem, Tel-Aviv, Izrael
Daniel A. Chamovitz
1 Növénytudományi és élelmezésbiztonsági iskola, Tel-Avivi Egyetem, Tel-Aviv, Izrael
Absztrakt
A keresztesvirágú zöldségekben, például a karfiolban, a brokkoliban és a káposztában gazdag étrendet már régóta egészségesnek tekintik, és számos epidemiológiai tanulmány szerint a keresztesvirágú zöldségek fogyasztása hozzájárul a rákvédő étrendhez. Míg ezek a zöldségek rengeteg fitokemikálist tartalmaznak, a mechanizmus, amellyel ezek a zöldségek ellensúlyozzák a rákot, még mindig nagy részben megoldatlan. Számos in situ vizsgálat az indol-3-karbinolt, a glükozinolát-indol-3-il-metil-glükozinolát bomlástermékét vonta be a rákellenes tulajdonságokkal rendelkező fitokémiai anyagok közé. Az indol-3-karbinol számos sejtes folyamatot befolyásol, de lassan kiderülnek azok a mechanizmusok, amelyek révén a rákos sejtekre hat. Az indol-3-karbinol Arabidopsisban betöltött szerepéről szóló legújabb tanulmányok megnyitják az ajtót a több ország közötti összehasonlítások előtt, amelyek segíthetnek megérteni ennek a fontos fitohormonnak a növénybiológiában és a rák elleni küzdelemben betöltött szerepét.
Bevezetés
A keresztesvirágú zöldségekben, például a karfiolban, a brokkoliban és a káposztában gazdag étrendet régóta egészségesnek tekintik. Még az ókorban úgy gondolták, hogy ezekből a zöldségekből készült kivonatok gyógyászati és gyógyító tulajdonságokkal bírnak, és Pitagorasz és Hippokratész egyaránt megértette a mustárkivonatok gyógyászati tulajdonságait A 20. században epidemiológiai vizsgálatok kezdtek felhalmozni a rákvédő étrendben a keresztesvirágú zöldségek védő tulajdonságait 2. Az Európában 18 éven át végzett vizsgálatok metaanalízise fordított összefüggést tárt fel a keresztesvirágú zöldségek heti fogyasztása és számos gyakori rák között, beleértve a vastagbél-, emlő-, vese- és felső emésztőrendszeri rákot 3. Míg ezek a zöldségek rengeteg fitokémiai anyagot tartalmaznak 4, az a mechanizmus, amellyel ezek a zöldségek ellensúlyozzák a rákot, még mindig nagy részben megoldatlan.
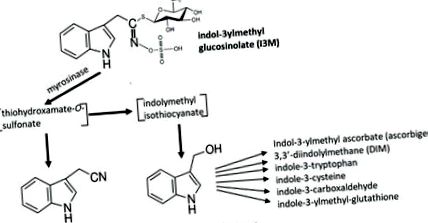
Az egyik legelterjedtebb glükozinolát, az indol-3-il-metil-glükozinolát (I3M-GS) bomlása indol-3-acetonitril (I3N) és indol-3-karbinol (I3C) kialakulásához vezet (1. ábra) 13. Az I3C viszont reagálhat önmagával és számos más növényi anyagcseretermékkel konjugátumokat képezve, amelyek közül néhányat az 1. ábra mutat be. Ezen I3C konjugátumok többségének még ismeretlen funkciói vannak a növények anyagcseréjében, bár érdekes módon a glükozinolát bomlástermékeinek egy másik feladata a további növényvédelmi reakciók jelzése lehet 14. Ezért lehetséges, hogy az I3M-GS lebontása más downstream reakciókat is kivált Arabidopsisban és más keresztes keresztekben.
1.ábra.
Az I3M-GS mirozináz által katalizált bomlása instabil köztitermékek, majd indol-3-acetonitril (I3N) és indol-3-karbionol (I3C) képződéséhez vezet. Az I3C önmagával és más növényi metabolitokkal reagálva számos konjugátumot képez, amelyek közül néhányat bemutatunk.
Diétás szempontból a zöldségek főzése befolyásolja a glükozinolát bomlási profilját 15. A forralás a mirozináz enzim inaktiválódásához vezet, de az I3M-GS nem enzimatikus lebomlásához I3C-hez és I3N16-hoz is vezethet. Ezenkívül az emberi bélmikrobák glükozinolát lebontásához vezethetnek 17 .
Indol-3-karbinol és rák
A glükozinolát bomlástermékei az ép glükozinolátok helyett elsősorban hozzájárulnak a káposzta, a brokkoli és a kapcsolódó zöldségek fogyasztásának rákellenes hatásához 11, 12, 18. Az I3C-t régóta tanulmányozták a rákkezelésben betöltött lehetséges szerepek tekintetében 19, 20, és számos tanulmány kimutatta, hogy az I3C elnyomja a különféle rákos sejtvonalak szaporodását, beleértve az emlő-, a vastagbél-, a prosztata- és az endometrium rákos sejteket (áttekintve 19, 21). Proliferatív tulajdonságainak egyik példája egy nem tumorigénes és tumorigén emlő hámsejteken (MCF10A és MCF10CA1a) végzett kutatásból származik, amely azt mutatta, hogy az I3C apoptózist indukált az emlőrák sejtjeiben, de a nem tumorigén emlő hámban nem. sejtek 22. Az I3C és annak egyik reakcióterméke, a diindolil-metán (DIM) szerepet játszik az 1. fázisú méregtelenítő enzimek indukciójában, ami más étrendi rákkeltők lebomlását eredményezheti. Mind az in situ, mind az in vivo vizsgálatok rámutatnak az I3C mint kemoprotektív szer szerepére az emlő- és prosztatarákban 23 .
Az in vivo vizsgálatok azt mutatták, hogy az I3C több állatban gátolja a különböző rákos megbetegedések kialakulását, ha karcinogén előtt vagy azzal párhuzamosan adják. Amikor azonban a karcinogén után I3C-t adtak az állatoknak, az I3C elősegítette a karcinogenezist 48. Ez az aggodalom az I3C kezelés hosszú távú hatásaival kapcsolatban az emberek rákkockázatára némi óvatosságot eredményezett az I3C étrend-kiegészítőként történő alkalmazásában a rákkezelési protokollokban 49, 50 .
Az I3C hatásának tulajdonított emlős sejtes folyamatok ugyanolyan változatosak, mint a sok vizsgált rák által bemutatott különböző fenotípusok. Valójában az I3C egy rákfajtára (pl. Emlőrák) gyakorolt hatásainak összpontosítása több molekuláris célpontra (51-ben áttekintve) jelenthet pleiotróp hatást az I3C-re, amelyek különbözhetnek a másik ráktípusban bemutatottaktól. Noha nem gyakran gondolják el, az I3C sejtekben kifejtett működésének más perspektívájának megismerése érdekében tanulságos lehet tanulni az I3C növényekben végzett tevékenységéből.
Indol-3-karbinol és növények
Az Arabidopsis thaliana mintanövény kiváló rendszert nyújt az I3C működésében szerepet játszó molekuláris mechanizmusok felderítéséhez, mivel 1) az I3C-t endogén módon állítja elő a növényevő növények után, 2) kis mennyiségű I3C termelődik konstitutív módon a gyökerekben, utalva az endogén szerepre a homeosztázis fenntartásában. és 3) rövid életciklusa és kicsi termete, fejlett rendelkezésre álló genetikai és genomi erőforrásokkal párosulva az Arabidopsis nemcsak a növénybiológia, hanem általában az eukarióta kutatások számára is kiváló modellrendszer 52 .
Míg az I3C szerepe a növényevők elrettentésében jól tanulmányozott 53, ugyanúgy, mint az I3C 13 termeléséhez vezető biokémiai út, a növényekben az I3C által kiváltott másodlagos válaszok csak most derülnek ki. Legfrissebb tanulmányaink kiemelik, hogy az I3C nemcsak védekező vegyi anyag, amely a növényevőkre irányul, hanem egy jelző molekula is, amely különböző sejt- és fejlődési utakat modulál.
Az Arabidopsis mint modellrendszer alkalmazásával kimutattuk, hogy az exogén módon alkalmazott I3C dózisfüggő módon gyorsan és reverzibilisen gátolta a gyökér megnyúlását 54. Ezt a gátlást három I3C által kiváltott válasz kísérte, amelyek relevánsak ahhoz, hogy megértsük az I3C aktivitását a rák gátlásában.
Először az I3C alkalmazása a sejtosztódás leállításához vezetett a gyökérmerisztémában (2A. Ábra). Míg általában a gyökérmerisztémában számos CycB1-expresszáló sejt látható, az I3C-kezelést követően egyetlen CycB1-tartalmú sejtet sem sikerült kimutatni, ami a sejtosztódás megszűnésére utal. Ezt a következtetést támasztják alá transzkripciós profilálási eredmények, amelyek a sejtciklus gének szabályozását mutatják be hat órával az I3C 55-nek való kitettség után. .
A gyökércsúcsokból izolált sejtmagok fluoreszcenciával aktivált sejtválogatási (FACS) elemzése a sejtciklus leállítását is jelzi. Amint a 2B. Ábrán látható, a kezeletlen gyökerekben három különálló magpopulációt detektálunk, ami megfelel a 2n, 4n és 8n magoknak. Az I3C-vel végzett kezelést követően azonban a 4n és 8n populációk progresszív vesztesége következik be, a sejtek egyidejű növekedésével, megnövekedett oldalsó szóródással (B populáció).
2. ábra.
A. A konfokális képalkotás a Cyclin B – GFP-t expresszáló sejtek hiányát tárja fel az I3C kezelést követően. A Cyclin B – GFP-t expresszáló palántákat Murashige és Skoog (MS) táptalajon növesztettük 4 napig, MS-vel (bal oldali panel) vagy 500 μm I3C-tal (jobb oldali panel) kezeltük 6 órán keresztül, és konfokális mikroszkóppal készítettük őket. A sejtfalakat propidium-jodid alkalmazásával festettük. B. A fluoreszcenciával aktivált sejtek szortírozásának (FACS) elemzése feltárja a mag bonyolultságának változását az I3C kezelést követően. A magokat izoláltuk MS vagy MS plusz I3C-vel kezelt Arabidopsis gyökerekből a megjelölt időtartamok között 0 és 15 óra között, majd FACS-mal elemeztük a DNS-tartalmat (FL2-A = propidium-jodid fluoreszcencia) és a mag komplexitását (SCC-H = fényoldali szórás). . A zöld, lila és kék négyzetek a nukleáris tartalom, a 2n, 4n és az endoreplication populáció (8n) szerint különböznek a populációktól. A piros négyzetek az atommag két populációját jelölik (" A"és" B"), amelyek az oldalsó szórás szerint különböznek.
Másodszor, az I3C alkalmazása az auxin (indol-3-ecetsav [IAA]) aktivitásának elvesztéséhez vezetett az 54 gyökérmerisztémában. Az auxin a legközpontosabb növényi hormon, amely a növény növekedésének és fejlődésének szinte minden szempontját ellenőrzi 56. Az I3C az auxin szignalizáció közvetlen modulálásával befolyásolja a növény növekedését és fejlődését. Az I3C számos auxin által indukált növekedési fenotípust antagonizált, beleértve a gyökér megnyúlásának gátlását, a gyökérszőrzet képződését és a gyökér másodlagos elágazását. Az I3C közvetlenül zavarja az auxin-receptor transzportgátló válasz (TIR1) auxin-függő megkötését két szubsztrátjával 54. A TIR1 auxin receptor az SCF (Skp, Cullin, F-box) E3 ubiquitin ligáz komplex F-boxot tartalmazó alegysége. Az auxin kötődése az SCF TIR1/AFB-hez elősegíti az auxin/indol-3-ecetsav (Aux/IAA) transzkripciós represszorok lebontását, és ezen keresztül szabályozza az auxin által indukált gének transzkripcióját 57. Az I3C gátolja a receptor szubsztrátjaival auxin-függő dimerizálódását azáltal, hogy versenyez az auxinnal ugyanazon kötési helyért a TIR1-ben.
A harmadik I3C-indukált válasz, amely releváns ahhoz, hogy megértsük az I3C aktivitását a rák gátlásában, az autofágia. Az Arabidopsis gyökereinek I3C-nek való kitettsége autofágia kiváltásához vezet 58. Ez az autofágia nem általános, az általános citoplazmatikus tartalom tömeges lebontására irányul újrafeldolgozás céljából, például éhezési körülmények között, hanem inkább specifikus. A specifikus autofágia a károsodott fehérjéket és más sejtkomponenseket célozza meg a lebontáshoz 59, és a GFP-AtATG8A és mCherry-AtNBR1 marker fehérjék együttes lokalizációjában figyelhető meg autofagosómákban az I3C-kezelést követően. Az I3C által kiváltott autofágia megcélozza a TIR1 auxin receptort, összekapcsolva ezzel az auxin jelzés 55 I3C-függő gátlását és az autofágia I3C indukcióját 58 .
Ezt a két I3C-függő folyamatot a gyökerekben nem csak exogén módon alkalmazott I3C-vel való közvetlen expozíció után, hanem a levelek I3C-val történő kezelését követően is kimutatták. Ami a legfontosabb, hogy a levélsebesítés autofágiát is indukált és gátolta a gyökérben az auxin választ, és a sebzésnek ez a hatása elveszett a glükozinolát-hiányos mutánsokban. Ez azt jelzi, hogy egy I3C-függő jel a levelekből a gyökérmerisztémába kerül, ahol az auxin szignalizáció gátolt és autofágia indukálódik. Így az I3C nemcsak egy védekező anyagcseretermék, amely taszítja a rovarokat, hanem részt vesz a távolsági kommunikációban is, amely szabályozza a növények növekedését és fejlődését.
Indol-3-karbinol, autofágia és fehérjeforgalom
Az I3C és az autofágia közötti kapcsolat meglehetősen érdekes, mivel ez a kapcsolat számos emberi rákos sejtben is megtalálható volt, amint azt korábban leírták 35, 36. Az autofágia folyamata a felesleges vagy diszfunkcionális sejtkomponensek lebontását foglalja magában lizoszómák (emlősökben) vagy vakuolák (növényekben) hatására. Ez a folyamat evolúciós szempontból konzervált az eukarióták körében, és mechanizmusa jól ismert, 60, 61. A rák összefüggésében az autofágia „kétélű kardként” tekinthető. Az autofágia aktiválása tumorszuppresszorként működhet (a defektív organellák és sejtkomponens lebontásával), vagy a rákos sejtek felhasználhatják tápanyagok és energia előállítására az éhezés időszakában .
Noha az I3C által kiváltott autofágia mind növényekben, mind állatokban kimutatható volt, a közvetlen jelátviteli mechanizmust még nem sikerült tisztázni. Ez azonban utalhat mind a növények, mind az emberek közös jelzési mechanizmusára. Így nemcsak a rákbiológusoknak tanulságos, hogy tanuljanak az I3C növényekben végzett tevékenységéből, hanem a növénybiológusoknak is sokat nyerhetnek a rákbiológusok mechanisztikus tanulmányainak közelebbi megértéséből.
A mai napig csak néhány I3C-kötő fehérjét azonosítottak. Az emberi sejtekben az elasztáz enzim, amely közvetíti a ciklin E átalakulását a rákos sejtek proliferációjával járó nagyobb molekulatömegű formából alacsonyabb molekulatömegű formába, az első azonosított I3C 63 specifikus célfehérje. Az I3C kezelések gátolták egy további szubsztrát, a membránhoz társuló CD40 elasztázfüggő hasítását is, amely a tumor nekrózis faktor (TNF) receptor szupercsalád 64 tagja. Így az I3C – elasztáz nexus segíthet az emberi emlőrák célzott terápiáinak kialakításában, ahol a magas elasztázszint korrelál a rossz prognózissal.
Az egyetlen, a növényekben eddig azonosított I3C-kötő fehérje a TIR1 F-box fehérje. Míg az auxin növényspecifikus hormon, az SCF komplexek emlősökben is léteznek, és fontos szerepet játszanak számos emlős funkcióban 65. A TIR1 rokon az emberi SKP2 66 fehérjével, így elképzelhető, hogy az I3C az emlősökben is szabályozhatja a fehérjeforgalmat. Ezt a sejtést alátámasztják olyan vizsgálatok, amelyek azt mutatták, hogy az I3C egy másik E3 ubiquitin ligázt, az NEDD4-1-et (fejlesztési szempontból Down-szabályozott 4-1-es gént expresszáló neurális prekurzor sejt) gátolja és gátolja a humán melanoma sejtekben 67, 68. Így egy I3C-hez kötött, gátolt NEDD4-et el kell távolítani a sejtből, és elképzelhető, hogy ez specifikus autofágia útján történhet, ahogyan az I3C-hez kötött, gátolt TIR1 is a növényi gyökerekben van megcélozva, hogy specifikus autofágia tisztuljon. Mivel a NEDD4 gyakran túlzottan expresszálódik az emberi rák különböző típusaiban 69, az I3C potenciális terápiás szer lehet, amely gátolja a túlzottan felhalmozódott E3 ligáz aktivitását.
Míg a növényeknél nem alakul ki áttétes rák, mint emlősöknél, a növényeknél tumorok is kialakulhatnak. A növények és állatok számos úton és jelátviteli kaszkáddal rendelkeznek, és a rákban érintett gének körülbelül 70% -a rendelkezik homológokkal az Arabidopsis thaliana genomban, hasonlóan az emberi rákos gének százalékos arányához más kialakult rendszerekben, például a Drosophila melanogaster, a Caenorhabditis elegans és Saccharomyces cerevisiae 52. Továbbá, míg a növények és az állatok nyilvánvalóan független hormonális szabályozó mechanizmusokkal rendelkeznek, a királyságok között van némi hasonlóság és keresztreaktivitás. A növények fitoösztrogéneket és más szteroid hormonokat termelnek, amelyek szintén befolyásolják az emberi hormon jelátvitelt, valamint számos feltételezett szteroid hormont kötő fehérjét (71–75). Így az I3C növényeken végzett vizsgálatának közvetlen következményei lehetnek az I3C szerepének további megértésére és talán az emberekben a rák kezelésére.
Megjegyzések
[1. verzió; játékvezetők: 2 jóváhagyott]
Finanszírozási nyilatkozat
Az I3C Arabidopsisban betöltött szerepével kapcsolatos kutatásainkat a Binacionális Mezőgazdasági Kutatási és Fejlesztési Alap (BARD, IS-4505-12R és US-4846-15C) támogatásai finanszírozzák.
A finanszírozóknak nem volt szerepük a tanulmányok tervezésében, adatgyűjtésben és elemzésben, a közzétételre vonatkozó döntésben vagy a kézirat elkészítésében.
Megjegyzések
Szerkesztői megjegyzés a felülvizsgálati folyamatról
Az F1000 kari áttekintéseket a rangos F1000 kar tagjai bízzák meg, és az olvasók szolgálatában szerkesztik. Annak érdekében, hogy ezek az áttekintések a lehető legátfogóbbak és hozzáférhetőbbek legyenek, a játékvezetők a közzététel előtt közreműködnek, és csak a végleges, átdolgozott változat jelenik meg. A végleges verziót jóváhagyó játékvezetők neve és tagsága fel van tüntetve, de a korábbi verziókról szóló beszámolóik nélkül (az esetleges észrevételeket már a közzétett változat is megvitatja).
A játékvezetők, akik jóváhagyták ezt a cikket, a következők:
Juan M. Zapata, Instituto de Investigaciones Biomédicas "Alberto Sols", CSIC-UAM, Madrid, Spanyolország
Gary L. Firestone, Molekuláris és Sejtbiológiai Tanszék és Rákkutató Laboratórium, Kaliforniai Egyetem, Berkeley, Berkely, Kalifornia, USA
- Hormonterápia a mellrákért. American Cancer Society
- Alacsony szénhidráttartalmú, magas fehérjetartalmú étrend pontszám és a rák előfordulásának kockázata; egy prospektív kohorsz vizsgálat
- Hány kivi gyümölcsöt egyek egy nap; Gyógyító növényi élelmiszerek
- Alacsony mikrobiális étrend Emlékhely Sloan Kettering Rákközpont
- Alacsony rosttartalmú étrend Emlékmű Sloan Kettering Rákközpont