Az inkretin és a szigetek hormonális reakciói a zsír- és fehérjebevitelre egészséges férfiaknál
Absztrakt
az élelmiszer lenyelésének integrált endokrin reakciói mind az étkezés méretétől, mind az összetételétől függenek, és magukban foglalják az inkretin hormonok glükagonszerű peptid-1 (GLP-1) és glükózfüggő inzulininotropikus polipeptid (GIP) étkezés utáni felszabadulását, valamint az étkezés utáni felszabadulását. szigeti hormonok inzulin és glükagon (3, 5, 21, 32). A legtöbb tanulmány az orális glükóz tolerancia tesztre adott válaszokra összpontosított, amely után a GIP, a GLP-1 és az inzulin szintje emelkedik, míg a glükagon szint elnyomódik (4, 18, 20, 24). Az is ismert, hogy a zsír- és fehérjebevitel stimulálja a GLP-1 és a GIP szekrécióját (10, 14, 20, 27). Kevésbé ismert azonban az inkretin válaszok és az étkezés utáni inzulin- és glükagonszint változása vagy a nem szénhidrátos makrotápanyagok fogyasztása közötti összefüggésekről.
A GLP-1-t és a GIP-t gyorsan lebontja a dipeptidil-peptidáz-4 (DPP-4), amely lehasítja a peptidek két NH2-terminális aminosavat, így nagyrészt inaktívvá válik (9). Az inkretin hormon szekréciója és a szigeti hormonok közötti kapcsolat pontos becsléséhez ezért meg kell mérni a két inkretin teljes és aktív intakt formáját. Hogy ez hogyan kapcsolódik a makrotápanyagok beviteléhez, nem ismert. Nemrégiben egereken mutattuk ki, hogy a fehérje bevitele növelte az intakt inkretin hormon szintjét a szénhidrát bevitelhez képest, és ez a csökkent bél DPP-4 aktivitással járt (17).
A tanulmány célja annak megvizsgálása volt, hogy az inkretin hormonok hozzájárulnak-e a szigeti hormon szekréciójának megváltozásához az emberek nem szénhidrátos makrotápanyagainak lenyelése után. Ennek érdekében megvizsgáltuk az inkretinek (mind a két inkretin hormon aktív, mind teljes koncentrációja) és a szigeti hormonok közötti kapcsolatot egy 5 órás periódus alatt a tiszta zsír vagy tiszta fehérje, mint szénhidrát nélküli makrotápanyagok bevitele után.
Tárgyak.
Tizenkét egészséges, 20–25 éves férfit [átlagéletkor: 22,0 ± 1,8 (SD) év] bevontak a vizsgálatba. Mindannyian nem voltak elhízottak [testtömeg-index (BMI) 20–25 kg/m 2, átlagos BMI 22,3 ± 1,2 kg/m 2] normál éhomi glükózzal (4,6 ± 0,2 mmol/l), személyes vagy családi kórtörténetében nem volt cukorbetegség vagy gasztrointesztinális betegség, és nem szedtek semmilyen gyógyszert. A svédországi Lundban hirdetések útján toborozták őket. Valamennyi alany orális glükóz-tolerancia teszten (2 g/kg glükóz) esett át a glükóz intolerancia kizárása érdekében (az éhomi glükóz 4,6 ± 0,2 mmol/l volt, 3,7–5,4 mmol/l tartományban volt; a 2 órás glükózérték 5,2 ± 0,2 mmol/l volt); 4,1–6,6 mmol/l tartomány). A tanulmányt a svéd Lund Egyetem etikai bizottsága hagyta jóvá, és minden alany írásos tájékozott beleegyezést adott a vizsgálatba való belépés előtt.
Tanulmányi protokoll.
Három alkalommal, legalább négy, maximum nyolc héten át elválasztva, egy éjszakán át éheztetett alanyokat antecubitalis véna katéterrel láttak el. Két kiindulási minta után −5 és −2 percen át orális izokalorikus (560 kcal), izovolémiás (400 ml) 1) olajsav (0,88 g/testtömeg-kg; az olaj után vizet fogyasztottak, hogy elérjék a 400 ml-t; Casa Oilio Sperlonga, Priverna, Olaszország); 2) vízben oldott fehérje [Promax protein 85 R (Global, Rødovre, Dánia); 2 g/testtömeg-kg, amely tejből és tojásfehérjéből áll; 4,4% szénhidrát és 2% zsír] vagy; 3) tiszta vizet (400 ml) 5 perc alatt elfogyasztunk. Az összes teszt előtt 30 perccel paracetamolt (1 g; GlaxoSmithKline, Mölndal, Svédország) adtunk be a gyomorürülés közvetett meghatározására; ez a módszer jó összefüggést mutatott, ha a nyomjelző technikákkal validálták (22). A teszteket randomizált módon végezték. Vérmintákat vettek egy 300 perces vizsgálati periódus alatt.
Elemzések.
Statisztika.
A ± SE jelzés látható, hacsak másként nem jelezzük. A görbék alatti területeket (AUC) a trapézszabály alapján kiszámítottuk az inzulin, a glukagon, az intakt és az összes GLP-1, valamint a GIP szuprabazális válaszaira a korai (0–30 perc) és a késői (30–300 perc) időszakban, míg a paracetamol AUC-ját 0 és 120 perc közötti időtartamra számították ki. A Tukey-féle post hoc teszttel végzett ANOVA-t alkalmazták a zsír, fehérje és víz elfogyasztása során kapott változók közötti szignifikancia vizsgálatához. A lineáris vagy kvadratikus korreláció becsléséhez Pearson szorzat-pillanat korrelációs együtthatóit kaptuk. Spearman-korrelációt végeztünk a korai glükagon és a korai intakt GIP válaszok, valamint a korai inzulin és a korán intakt GIP válaszok között.
Glükóz, inzulin és glükagon válaszok a zsír, fehérje és víz kihívására.
Az éhomi glükózszint 4,6 ± 0,2 mmol/l volt, és a glükózszint egyik vizsgálatban sem változott szignifikánsan. Az éhomi inzulinszint 55 ± 3 pmol/l volt. Az inzulin szintje a víz bevétele után nem változott, míg a zsír és a fehérje bevitele után emelkedett. A megemelkedett plazma inzulin koncentráció a zsír bevétele után 30 és 240 perc között volt megfigyelhető (P = 0,031 a vízhez viszonyítva) és 15 és 240 perc között a fehérje lenyelése után (P = 0,018 vs. víz). A vízfogyasztással összehasonlítva a zsír- és fehérjebevitel egyaránt jelentősen megnövelte a korai és a késői inzulinválaszokat (1. táblázat). Ezek a válaszok a fehérje után kifejezettebbek voltak, mint a zsír bevitele után (P 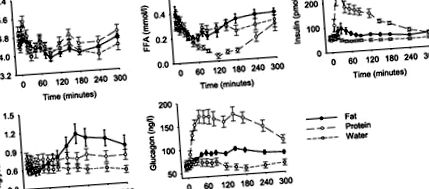
1. ábra.A glükóz, az inzulin, a glükagon, a szabad zsírsav (FFA) és a trigliceridek plazmaszintje egészséges önkénteseknél zsír, fehérje vagy víz bevétele előtt és után 300 perccel (n = 12). Jelenti a ± SE-t.
Asztal 1. Korai (0–30 perc) és késői (40–300 perc) inzulin, intakt glükagon és teljes GLP-1, valamint egészséges, önkéntesekben a víz, zsír vagy fehérje bevitelére adott intakt és teljes GIP válaszok
Az értékek átlag ± SE; n = 12 férfi minden csoportban. GLP-1, glukagonszerű peptid-1; GIP, glükózfüggő inzulinotróp polipeptid.
* P † P ‡ P § Nem jelentős, P = 0,66.
FFA és triglicerid válaszok a zsír, fehérje és víz kihívására.
Az éhomi FFA-szint 0,34 ± 0,04 mmol/l volt. A víz vagy a zsír elfogyasztása nem változtatta meg a plazma FFA szintjét, míg a fehérje lenyelése jelentősen csökkentette 60. perc és tovább (P −1 · 120 perc −1 víz bevétele után. Nem befolyásolta szignifikánsan a fehérje lenyelése (11,4 ± 1,1 mmol ± 1-120 perc -1), de alacsonyabb a zsír bevétele után (8,6 ± 0,8 mmol ± 1 -120 perc -1; P = 0,010).
GLP-1 és GIP válaszok a zsír, fehérje és víz kihívására.
Az intakt és a teljes GLP-1 éhomi szintje 3,9 ± 1,4, illetve 14,8 ± 1,4 pmol/l volt, az intakt és a teljes GIP éhomi szintje 15,1 ± 1,1, illetve 16,6 ± 4,3 pmol/l. A vízfogyasztás nem változtatta meg ezeket a szinteket, míg az intakt és az összes GLP-1 és GIP szint arányosan növekedett a zsír és a fehérje bevitele után (P
2. ábra.Az intakt és az összes glukagon-szerű peptid-1 (GLP-1), valamint az intakt és teljes glükózfüggő inzulinotróp polipeptid (GIP) plazmaszintje egészséges önkéntesekben a zsír, fehérje vagy víz bevitele előtt és után 300 perccel (n = 12). Jelenti a ± SE-t.
DPP-4 aktivitás.
Az éhomi plazma DPP-4 aktivitása 555 ± 33 mmol · perc -1,1 mg fehérje -1 volt. A plazma DPP-4 aktivitása nem változott szignifikánsan a víz, zsír és fehérje lenyelése után az 5 órás vizsgálati időszak alatt (2. ábra).
Összefüggés az inkretin és a szigeti hormon válaszok között.
A fehérje elfogyasztására adott korai inzulinválasz korrelált a korai intakt GIP-válasszal (3. ábra). A korai GIP és az inzulinválasz közötti kapcsolat másodfokú regresszió volt (r 2 = 0,86; P 2 = 0,32) (az adatokat nem mutatjuk be). A GLP-1 válaszok és az inzulin vagy glükagon válaszok esetében ilyen összefüggést nem tapasztaltunk.
3. ábra.Másodlagos regresszió az intakt GIP korai (30 perces) növekedése és az inzulin növekedése között az egészséges önkéntes férfi fehérje bevitele után (n = 12).
Az „inkretin” kifejezés egy bélhormonra utal, amelyet orális glükóz szabadít fel, és amely fokozza a glükóz által stimulált inzulinszekréciót (6). Ez a kifejezés azonban általánosabb lehet, és vonatkozhat az endokrin hasnyálmirigyet stimuláló bélfaktorra, még akkor is, ha nincs elsődleges glükózstimuláció. Az ilyen stimuláció tágabbá teheti a szigetek működésének inkretinek általi szabályozás fogalmát. A tanulmány célja az volt, hogy megvizsgálja az inkretin és a szigeti hormonok kapcsolatát a nem szénhidrátos makrotápanyagok bevitele után.
Számos módszertani óvintézkedést alkalmaztak ebben a vizsgálatban, hogy megpróbálják tisztázni a feltörekvő adatok értelmezését. Először is, a vízfogyasztás a gyomorfeszülés miatti változások és a vizsgálati időszakban az időtől függő változások kontrolljaként szolgált. Másodszor, a glikémia nem változott a zsír vagy a fehérje elfogyasztása után, ami lehetővé tette az inkretin-szigetek tengelyének glükózfüggetlen hatásainak értékelését, bár a jelen vizsgálat korlátja az volt, hogy csak a vénás glükózszintet határoztuk meg. Ezért nem zárhatjuk ki az artériás glikémiában bekövetkezett változást. Harmadszor, a vérmintákat 5 órán át folytatták a hosszú távú hatások összehasonlítása céljából, vagyis sokkal hosszabb ideig, mint a korábbi vizsgálatokban (14, 27). A legtöbb mért paraméter esetében ennek az 5 órás megfigyelési periódusnak a használata lehetővé tette számunkra, hogy megfigyeljük a makrotápanyagok bevitelére vonatkozó teljes endokrin választ. Negyedszer, mind a GIP, mind a GLP-1 intakt és teljes szintjét meghatároztuk. Ez azért fontos, ha figyelembe vesszük, hogy az inkretinek teljes szintje a hormonok szekrécióját tükrözi, míg az intakt szintek a GLP-1 és a GIP aktív formáját tükrözik (8).
Meghatároztuk a plazma DPP-4 aktivitását is, mivel ez az enzim releváns az inkretin hormonok fiziológiájában (10). Figyelemre méltó megfigyelés ebből a tanulmányból tehát az, hogy a plazma DPP-4 aktivitása nem változott az 5 órás vizsgálatok során sem a víz, sem a fehérje, sem a zsír hatására. Az a tény, hogy a plazma DPP-4 aktivitása hosszú ideig stabil az embereknél, fontos megállapítás, figyelembe véve a DPP-4 fontosságát az inkretin fiziológia, a szigetecske funkció és a glükóz tolerancia szabályozójaként, valamint központi szerepét az új gyógyszerek kifejlesztésében. cukorbetegség (7). Egy korábbi, egereken végzett vizsgálatban kimutattuk a fehérje bevitele utáni GLP-1 válasz különbségeit a zsír és a zsír elfogyasztása után, mivel a fehérje bevitele a csökkent bél DPP-4 aktivitással és az aktív GLP-1 fokozott válaszaival társult, míg a plazma DPP -4 aktivitása nem változott (17). Meg kell vizsgálni, hogy vannak-e hasonló különbségek emberben, mivel ebben a vizsgálatban a plazma és nem a bél DPP-4 aktivitását határoztuk meg.
A glükagon szekrécióját fokozta a zsír bevitele. Ez az új megállapítás azt sugallja, hogy a lipidek stimulálják a glükagon szekrécióját. Valójában a glükagonszint a zsír bevitele után hosszabb ideig magas maradt, mint az inzulinszint. Ez támogatná az inkretinek szerepét az euglikémia fenntartásában nem szénhidrát-közvetített inzulin felszabadulás jelenlétében. A későbbi időpontban a GIP nagymértékű növekedése szerepet játszhat ebben a hatásban, mivel a GIP kimutatták, hogy stimulálja a glükagon szekrécióját (23). A GLP-1 szerepet játszhat modulációs tényezőként, mivel a GLP-1 gátolja a glükagon szekrécióját (23).
Az inzulin és a glükagon szekrécióját a fehérje fokozta a plazma FFA-szintjének mélyreható csökkenésével együtt, ami az inzulin antilipolitikus hatását tükrözi. A GIP és a GLP-1 szintjét a fehérje is növelte, ami arra utal, hogy az inkretinek hozzájárulhatnak a szigetek zsír- és fehérjebevitelre adott válaszához. Ezt támasztja alá az intakt GIP-szint korai növekedése és az inzulin korai növekedése közötti szoros összefüggés. Ez az összefüggés, bár érdekes, nem hoz létre alkalmi kapcsolatot és további vizsgálatot igényel. Mindazonáltal azt a következtetést, hogy a megemelt GIP hozzájárulhat a megemelkedett inzulinhoz a fehérje bevitele után, in vitro vizsgálatok támasztják alá, amelyek bizonyítják, hogy a GIP fokozza az aminosavak által stimulált inzulin szekréciót (16). Bár a GIP-ről beszámoltak arról, hogy hozzájárul az orális fehérjére adott glukagon-válaszhoz (23), a jelen vizsgálatban nem tapasztaltak ilyen összefüggést e két folyamat között. Ismételten elmondhatjuk, hogy a GLP-1 moduláló hatása a glükagon szekréciójára csak gátló hatásokra korlátozódik, ha a normoglikémiában valóban fennállnak (13). Lehetséges azonban egy negatív visszacsatolási hurok, amely révén a megemelt glukagon stimulálja a GLP-1 szekréciót; egy ilyen hipotézist részletesebben kell tanulmányozni.
Összefoglalva, ez a tanulmány a GIP és a GLP-1 válaszok, valamint az inzulin és a glükagon reakcióinak kapcsolatáról az emberek zsír- és fehérjefogyasztását követően azt mutatta, hogy 1) a zsír és fehérje lenyelése stimulálja az inzulin, a glükagon, a GIP és a GLP-1 szekrécióját, függetlenül a glükóz vagy a lipidek változásától, 2) a fehérje lenyelésére adott korai GIP válasz kifejezettebb, mint a zsír elfogyasztására adott korai GIP válasz, míg a GLP-1 válaszok hasonlóak a zsír és a fehérje elfogyasztása után, 3) a GIP felszabadulása, de nem a GLP-1, korrelál az inzulin és a glükagon felszabadulásával a fehérje (de nem a zsír után) lenyelés után, és 4) a plazma DPP-4 aktivitása változatlan a zsír vagy fehérje bevitele után. Ezen megállapítások alapján arra a következtetésre jutunk, hogy a GIP, a GLP-1 és a szigeti hormon szekréció plazmaszintjei közötti kapcsolat a makrotápanyagok lenyelését követően összetett, ezért a GLP-1 és a GIP elsődleges szerepe az inzulin felszabadulás mediátoraként kérdéses a tiszta zsír- és fehérjebevitel után.
A tanulmányt a Novo Nordisk, a Svéd Kutatási Tanács (támogatásszám: 6834), a Skåne régió és az Orvostudományi Kar támogatása támogatta.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Hálásak vagyunk Gustav Dahl kutatónővérnek, valamint Kristina Andersson, Lilian Bengtsson, Lena Kvist és Sofie Pilgaard laboratóriumi technikusoknak a szakértői segítségért. Köszönjük Dr. Debora Williams-Hermannak a kézirathoz adott hasznos megjegyzéseket.
R. D. Carr jelenlegi címe: Merck, Sharp és Dohme, DK-2600 Glostrup, Dánia.
- Mennyit nyerhet hetente, ha fehérjét iszogat, az egészséges táplálkozáshoz vezet az SF kapu
- Mennyi fehérje csirkében; Gombóc egészséges táplálkozás SF kapu
- Egészséges-e enni egy fehérjetartót minden nap harapnivalóra?
- Egészséges-e fehérje turmixokat inni ahelyett, hogy állandóan étkeznénk? Egészséges táplálkozás SF kapu
- A juharszirup egészséges vagy egészségtelen-e a fehérje