Az öregedés közegészségügyi perspektívája: a hiper-gyulladásos szindrómák, például a COVID-19, a SARS, az ARDS, a citokin-vihar szindróma és az ICU utáni szindróma felgyorsítják-e a rövid és hosszú távú gyulladásokat?
Arsun Bektas
1 Translational Gerontology Branch, National Institute on Aging, National Institutes of Health, 251 Bayview Blvd, Baltimore, MD 21224 USA
H. Schurman juhász
2 Klinikai kutatási részleg, Országos Környezet-egészségügyi Tudományok Intézete, Országos Egészségügyi Intézetek, 111 TW Alexander Dr, Research Triangle Park, NC 27709 USA
Claudio Franceschi
3 Alma Mater Studiorum University of Bologna, Bologna, Olaszország
4 Az egészséges öregedés rendszerbiológiájának laboratóriuma és az alkalmazott matematika tanszék, Lobacsevszkij Állami Egyetem, Nyizsnyij Novgorod, Oroszország
Luigi Ferrucci
1 Translational Gerontology Branch, National Institute on Aging, National Institutes of Health, 251 Bayview Blvd, Baltimore, MD 21224 USA
Társított adatok
Absztrakt
Mivel a világ a COVID-19 járvánnyal foglalkozik, központi klinikai kérdés az, hogy milyen hosszú távú következményekkel járnak azok az egyének milliói, akik felépülnek a COVID-19-et jellemző hipergyulladásos állapotból, és különösen azoknak a százezreknek, akik eléggé betegek. kórházi kezelésre és különösen az intenzív osztályon történő ellátásra szorul Még akkor is, ha a pandémiát végre kontrollálják, vajon a COVID-19 túlélők eltúlzott belső gyulladásos folyamatokkal, súlyosbodó társbetegségekkel és az öregedéssel összefüggő betegségek iránti fokozott fogékonysággal fognak szembenézni? A COVID-19 utáni betegek történéseire utaló jelek előidézhetők azok közül, akik felépültek más olyan állapotokból, amelyek hasonló hipergyulladásos állapotokhoz vezetnek, mint például súlyos akut légzőszervi szindróma (SARS), akut légzőszervi betegség szindróma (ARDS), citokin vihar szindróma, és az ICU utáni szindróma. A fenti állapotok gyógyulását követő rövid és hosszú távú következmények arra utalnak, hogy ezek a szindrómák a krónikus szubklinikai szisztémás gyulladás felgyorsult állapotához vezetnek, amelyet gyakran az öregedés során észlelnek (gyulladásnak neveznek), ami az életkorral kapcsolatos állapotok, beleértve a gyengeséget is, fokozott és súlyosbodása fiatalabb egyének.
Háttér
A COVID-19-et, a súlyos, akut légzőszervi szindróma koronavírus 2 (SARS-CoV-2) fertőzést követő enyhe vagy súlyos légúti szindrómát először 2019 decemberében, Kínában, Wuhanban azonosították, és gyorsan emberek millióit sújtó járvány lett, ami jelentős halandóság az egész világon. A SARS-CoV-2-vel fertőzött személyek többségénél influenzaszerű, enyhe klinikai szindróma (nem tüdőgyulladás vagy enyhe atipikus tüdőgyulladás) alakul ki, és ennek jelentős része (
20%) kórházi kezelést igényelnek (nehézlégzés, alacsony oxigéntelítettség), jelentős részük kritikus betegséghez (légzési elégtelenség, szeptikus sokk és/vagy többszörös szervi diszfunkció) és halálhoz vezet [1, 2].
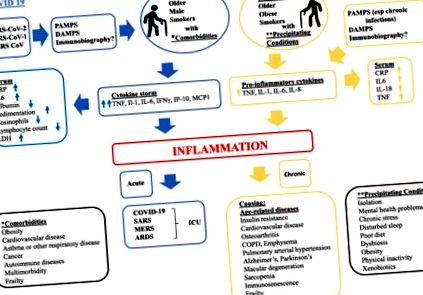
Míg a mechanizmus, amellyel csak néhány egyénnél alakul ki súlyos légúti patológia, még mindig nem teljesen tisztázott, számos tanulmány kimutatta, hogy a betegek, akik elég betegek ahhoz, hogy kórházi ápolásra szoruljanak, általában idősebbek, akiket multimorbiditás, köztük magas vérnyomás, cukorbetegség és/vagy elhízás [3]. A kórházi betegek súlyosságát nyilvánvaló gyulladásos reakcióval járó súlyos tüdőgyulladás jellemzi, amelyet magas C-reaktív fehérje (CRP) és interleukin-6 (IL-6), alacsony albumin, magas ülepedési arány, alacsony eozinofilek és limfopénia jellemez. A kórházi személyeknél megnövekedett a laktát-dehidrogenáz (LDH), amely a sejthalál markere, gyakran társul a megváltozott koagulációval [4, 5]. A magas LDH, alacsony limfocitaszám és a magas érzékenységű CRP magas szintje előre jelzi az egyes betegek halálozását több mint 10 nappal korábban, 90% -nál nagyobb pontossággal [6]. Számos metaanalízis az IL-6 szintet is összekapcsolta a COVID-19 szindróma súlyosságával [7–9].
Így az elmúlt hónapokban közzétett tanulmányok rendkívüli szaporodása azt sugallja, hogy a SARS-CoV-2 fertőzés erőteljes és látszólag kontrollálatlan gyulladásos reakciót szabadít fel, amely nagy valószínűséggel hozzájárul a vírusfertőzés által már okozott szövetkárosodáshoz a COVID-19 irányába patológia. A pro-gyulladásos mediátorok magas koncentrációja, amelyet „citokin-viharnak” neveznek, károsítja a szív-, a máj- és a veserendszert, ami tumor nekrózis faktor (TNF) által közvetített többszerves rendszer meghibásodásához és/vagy halálhoz vezet [10]. . A SARS-CoV-2 leginkább befolyásolja a T helper 1 (TH1) sejtválaszra jellemző gyulladásgátló citokinek/kemokinek szintjét, mint például az IL-6, IFNγ, IP-10 és MCP1 [11, 12], amelyek vonzzák a monocitákat és a T sejtek a fertőzött helyre [13, 14], ami valószínűleg hozzájárul a limfopéniához és a megnövekedett neutrofil – limfocita arányhoz
A betegek 80% -a [15, 16]. Figyelemre méltó, hogy míg a súlyos COVID-19 aránytalanul idősebb embereket érint, a SARS-CoV-2 okozta szisztémás gyulladást minden korcsoportban észlelik, beleértve a súlyos multisystem gyulladásos szindrómát, amelynél a közelmúltban gyermekeknél azonosították a Kawasaki-kór jellemzőit [17, 18].
COVID-19 és gyulladás
A fentiekben vázolt mechanizmusok mindegyike lehetséges magyarázat lehet arra, hogy a bakteriális vagy vírusfertőzés miként válthat ki gyulladásos választ, és hogyan módosíthatja az öregedésbiológia már veszélyeztetett mechanizmusai az ilyen válasz súlyosságát és következményeit. Még relevánsabb az egyre növekvő bizonyíték arra vonatkozóan, hogy az immunobiográfia, az egyén bizonyos mikroorganizmusokkal (pl. HIV és CMV) vagy antigénekkel való expozíciója feltételezheti a különféle ingerekre adott jelenlegi gyulladásos válasz mértékét és jellemzőit [24, 32–34]. Az alapfolyamat, amelynek során a gyulladásos rohamok korábbi expozícióinak memóriája modulálja az új antigén-expozíció veleszületett reakcióját, nem ismert, de az ilyen memória meglétét epidemiológiai vizsgálatok igazolták, és epigenetikus természetűnek tekintik. Valójában az immunobiográfia lehet az a mechanizmus, amely révén az elhízás és a metabolikus szindróma - mindkettőt krónikus gyulladással és a citokinek (TNF, IL-1 és IL-6) rendellenes termelődésével és az immun T-sejtek megváltozott reakciójával jellemezhető - jelennek meg. növeli a fertőzés kockázatát, valamint annak súlyosságát és következményeit, különösen a COVID-19-hez kapcsolódó eredmények tekintetében [35, 36].
Rejtélyes lehetőség, hogy a COVID-19 fertőzés hajlamosíthatja az egyéneket a veleszületett immunológiai memórián keresztüli gyulladásra, még akkor is, ha az akut klinikai szindróma enyhe, és néhány nap alatt klinikailag megszűnik, nyilvánvaló közvetlen következmények nélkül. Valójában erős indoklás van annak a hipotézisnek az alátámasztására, miszerint az akut SARS-Cov-2 fertőzés szubklinikai károsodás felhalmozódást indukál, amely egyrészt hajlamosítja az egyént egy krónikus gyulladásgátló állapotra, másrészt csökkenti annak képességét, hogy teljes mértékben kihasználhassa erős immunválasz fertőzés vagy trauma kapcsán. A jelenlegi szakaszban nem gyűlt össze elegendő adat a kérdés megválaszolásához, de minden bizonnyal, mivel az adatok halmozódnak, nagyobb egyértelműség fog kialakulni ebben a kérdésben. Itt felvázolunk néhány hipotetikus mechanizmust, amely ezt a nézetet alátámasztja, és felvázolunk egy jövőbeni kutatási menetrendet, amely közvetlenül kezelheti ezt a kérdést longitudinális adatok összegyűjtésével azon betegek csoportjában, akiknél a COVID-19 széles súlyosságú tartományban alakult ki.
Tanulság az ARDS, a SARS, a citokin vihar szindróma hosszú távú következményeiből: az ICU utáni szindróma
Bizonyíték van arra, hogy a súlyos fertőzéseket hosszú távú káros következmények követik, ideértve a megemelkedett citokinek szintjét és felgyorsult a funkcionális képességek csökkenését, hasonlóan az öregedésnél tapasztaltakhoz, mint például a hosszú távú fizikai, kognitív és pszichés károsodások, még azoknál a betegeknél is, akik úgy tűnik, hogy felépült az első sértésből, például a tüdőfunkció elvesztéséből akut légúti betegség szindrómában (ARDS).
Az ARDS összefüggésében a CSS tekinthető kritikus eseménynek, amely elindítja ezt a folyamatot. A CSS-t a SARS-ban és a közel-keleti légzőszervi szindrómában (MERS) is megfigyelték, melyeket szintén koronavírusok okoztak, és a COVID-19-hez hasonlóan magas szintű gyulladásgátló citokint eredményez. SARS-ban a súlyos betegségben szenvedő betegeknél magas volt a szérum pro-gyulladásos citokinek (IFN-γ, IL-1, IL-6, IL-12 és TGFβ) és kemokinek (CCL2, CXCL10, CXCL9 és IL-8) szintje az enyhe betegségben szenvedőkhöz képest [40]. MERS-ben a súlyos betegségben szenvedő betegeknél magas volt a szérum gyulladásgátló citokinek (IL-6 és IFN-α) és kemokinek (IL-8, CXCL-10 és CCL5) szintje az enyhe vagy közepesen súlyos betegséghez képest [41]. A gyulladásra jellemző gyulladásgátló háttér jelenléte valószínűleg súlyosbítja a CSS súlyosságát. Például egérmodellben a gyulladás jelenléte növelte a citokin vihar előfordulását és letalitását a szisztémás immunterápiával történő indukciót követően [42].
Sok súlyos és elhúzódó betegségben szenvedő intenzív osztályon szenvedő beteg szenved kognitív, pszichés és fizikai fogyatékosságként megnyilvánuló poszt-intenzív terápiás szindrómában (PICS), és nagy részük soha nem állítja helyre teljesen jólétét és funkcionális állapotát [43]. A PICS fizikai károsodása gyakran izomgyengeséggel, extrém kimerültséggel, hangulati rendellenességekkel, polineuropátiával és a dekondíció tüneteivel jár, amelyek csak enyhén reagálnak az edzésprogramokra [44]. Érdekes módon ezek a klinikai jellemzők hasonlítanak azokhoz, amelyeket idősek tapasztalnak gyulladásos és gyengeséggel kapcsolatos szarkopéniában [34, 45]. Valójában a SARS, az ARDS, a CSS és a PICS túlélői mind fizikai és kognitív hiányokat váltanak ki, amelyek gyorsított gyulladásként jellemezhetők, felvetve annak lehetőségét, hogy a COVID-19 túlélők is felgyorsult gyulladással szembesülhessenek, jelentős hosszú távú következményekkel a kútjukon. -lény. A COVID-19 tapasztalatai szerint az egészségi állapotra és a funkcionális állapotra gyakorolt hosszú távú hatásokat tovább súlyosbíthatja a társadalmi távolságtartás, a társadalmi-gazdasági stressz és az elszigeteltség megvalósulása, amelyre a világtörténelemben nem volt példa, és amelynek hosszú távú következményei vannak az egyénekre és a társadalomra. az elkövetkező években intenzív kutatás tárgya lesz.
A COVID-19 és az idősek gyulladásának mechanizmusai
A PAMP-k és a DAMP-k kölcsönhatásba lépnek a sejtfelszínen expresszált PPR szenzorokkal és számos immunsejt-típus citoplazmájában, ezáltal gyulladásos reakciókat váltanak ki, amelyek hozzájárulnak a gyulladás kialakulásához. A tüdő- és felső légúti szöveti patológiai vizsgálatok kimutatták, hogy a SARS-CoV-2 fertőzés súlyos helyi szövetkárosodást eredményez [53, 54]. A sejtek töredezése felszabadítja a PAMP-kat és a DAMP-kat, és helyi sejteken keresztül aktiválja a gyulladást, beleértve a tüdő esetében az alveoláris hámsejteket és az alveoláris makrofágokat, amelyek felszabadítják a gyulladásgátló citokineket és kemokineket, amelyek vonzzák az immunsejteket, beleértve a monocitákat és a T-sejteket [10]. A SARS-CoV-2 esetében, hasonlóan a SARS-CoV-1-hez és a MERS-CoV-hoz, az adaptív mechanizmusok elkerülik a veleszületett érzékelést, amelyet a PPR-rel való kapcsolat és a következményes citokin-szekréció és az IFN-jelátvitel vált ki. Ezek a kijátszási mechanizmusok magukban foglalják a dsRNS membránhoz kötött rekeszekkel történő árnyékolását, guanozin-fedést és CoV-k nem strukturális fehérjéinek metilezését, valamint az NSP15 kódolását, egy endoribonukleázt, amely hasítja a vírus replikációja során keletkező 5'-poliuridinokat, amelyeket az MDA5 detektál a citozol [55]. A veleszületett érzékelés elkerülése érdekében a védekezés ellenére a SARS-CoV-2 által kiváltott citokin-vihar valószínűleg még mindig a vírusos PAMP-k és a gazda-DAMP-k kombinációjával kezdődik [55].
A SARS-CoV-2 által kiváltott CSS során felszabaduló pro-gyulladásos citokinek blokkolásának közvetlen kísérleteit vizsgálják, mivel kimutatták, hogy súlyossága korrelál a COVID-19 morbiditásával és mortalitásával. Különösen az IL-6 jelátviteli út elleni monoklonális antitesteket javasoltak [56]. Az anti-IL-6R antitesteket, a tocilizumabot és a sarilumabot, valamint az anti-IL-6 antitestet, a siltuximabot, jelenleg 13 klinikai vizsgálatban tesztelik a COVID-19 CSS és a tüdőgyulladás kezelésének hatékonysága szempontjából [55]. Noha egyesek, ha ezek a tanulmányok pozitív választ találtak valamilyen biomarker és klinikai értékben, még mindig túl korai megmondani, hogy befolyásolják-e jelentősen a klinikai eredményeket, és különösen, hogy csökkentik-e a gyulladás lehetséges hosszú távú következményeinek kockázatát az ICU-betegeknél.
A gyulladással metsző lehetséges COVID-19 kezelésekkel kapcsolatban az Egyesült Királyságban több mint 11 500 betegen végzett, a RECOVERY (Randomized Evaluation of COVid-19 thERapY) randomizált klinikai vizsgálat érdekes eredményei arról számoltak be, hogy az alacsony dózisú dexametazon (6 mg naponta egyszer, legfeljebb tíz napig, szájon át vagy intravénás injekció formájában)
2100 beteg csökkentette a mortalitást a szellőztetett betegeknél 29% -kal, a többi, csak oxigént kapó betegeknél 11% -kal, semmilyen előny nem jár azok számára, akiknek nem volt szükségük légzési támogatásra [68]. A kortikoszteroidokat fel lehet használni a CSS csillapítására, bár használatuk nem mutatott korábbi túlélési hasznot MERS és ARDS esetén, valószínűleg azért, mert a kortikoszteroidok késleltették a vírus kiürülését [69]. A COVID-19 és más CSS esetén a kortikoszteroidok előnyei az adagolás idejétől függhetnek. A hatás valószínűleg a citokin-vihar teljes kifejlődése előtt maximális [70]. A korral járó betegségek gyulladásának kezeléséhez szükség lehet a gyulladáscsökkentő terápiák, beleértve a szteroidokat vagy más immunmoduláló módszert is, adagolásának és időzítésének egyensúlyára.
A COVID-19 idősebb betegek nyomon követése: közegészségügyi stratégia
Az irodalom áttekintése alapján azt jósoljuk, hogy a COVID-19-ből felépült idős embereknél nagyobb valószínűséggel alakul ki gyulladás és annak következményei a túlzott morbiditás, fogyatékosság és gyengeség szempontjából. Ezenkívül ezek az egyének nagyobb valószínűséggel tapasztalják meggyorsult immunszenszcenciát, és ezért fogékonyabbak a fertőzésekre. Ha ez a hipotézis igaz, fontos lenne a COVID-19 betegek longitudinális nyomon követése annak érdekében, hogy azonosítsuk azokat az alanyokat, akiknél nagyobb az életkorral összefüggő betegségek kialakulásának kockázata, és fel kell készülni a korai beavatkozásokra, amelyek csökkenthetik a hosszú távú az akut COVID-19 hosszú távú hatásai. Ez a széles körű kutatási menetrend számos fontos intézkedést foglalhat magában:
Hozzon létre országos nyilvántartást azokról az idősebb betegekről (> 60 év), akik a COVID-19 fertőzést sokféle súlyosságban túlélték. Az alapvető demográfiai adatok mellett a nyilvántartásnak információkat kell gyűjtenie a következőkről: 1) az akut esemény, valamint a rövid és hosszú távú szövődmények súlyosságáról és klinikai lefolyásáról; 2) Kiterjedt információ az öregedés biológiai, fiziológiai és funkcionális biomarkereiről, beleértve mind a fizikai, mind a kognitív szempontokat; 3) A prevalens krónikus betegségek standard mértéke, beleértve a multimorbiditás validált mértékét; 4) információk a kockázati tényezőkről, beleértve a környezeti viselkedési és társadalmi kockázati tényezőket.
A nyilvántartást ki kell egészíteni egy NEMZETI BIOBANK-nal, amely tartalmazza a nyilvántartásban szereplő alanyok biológiai mintáit (vérszármazékok, de egyéb biofolyadékok is).
A nyilvántartásnak és a biobanknak kell alapulnia a COVID-19 fertőzést túlélő betegek ORSZÁGOS HOSSZÚ KÖVETÉSÉNEK. A nyomon követés során információkat kell gyűjteni a hosszú távú légzési, neurológiai és anyagcsere-kóros eredményekről, valamint a fizikai és kognitív funkcióról. Ennek az adatbázisnak az elemzésének lehetővé kell tennie a káros egészségügyi kimenetelekkel összefüggő egyének jellemzőinek jobb azonosítását.
Ezen adatsor felhasználásával lehetővé kell tenni annak a hipotézisnek a tesztelését is, hogy a COVID-19 fertőzés, hasonlóan a súlyos típusú fertőzésekhez, felgyorsult biológiai öregedéshez és annak következményeihez vezet.
Következtetések
A szerzők hozzájárulása
A projektet az LF kezdeményezte. Minden szerző hozzájárult a darab megírásához. A szerző (k) elolvasta és jóváhagyta a végleges kéziratot.
Finanszírozás
Ezt a munkát az Országos Egészségügyi Intézetek (NIH), az Országos Öregedési Intézet és az Országos Környezetegészségügyi Intézet intramurális kutatási programja támogatta.
- 4 módszer az SMS használatára az alkalmazottak egészségének és produktivitásának megőrzéséhez közegészségügyi vészhelyzet esetén
- Konstruktív kritika a közegészségügyi érvekről az elhízás elleni szóda-adók és az élelmiszeradók vonatkozásában
- Ízületi gyulladás-gyermek diéta, amely megállítja az éjszakai árnyékokat, az egészséget, az öregedést és a rövidebb életet
- Hólyagegészség idősebb felnőtteknek Országos Öregedési Intézet
- Alkohol, dohány, elhízás és az új közegészségügy Critical Public Health 21. kötet, 1. sz