Bélmikrobiota és krónikus székrekedés: felülvizsgálat és frissítés
Toshifumi Ohkusa
1 Mikrobiota Kutatási Osztály, Juntendo University Graduate School of Medicine, Tokió, Japán
2 Gasztroenterológiai és Hepatológiai Tanszék, Jikei Egyetem Kashiwa Kórház, Kashiwa, Japán
Shigeo Koido
2 Gasztroenterológiai és Hepatológiai Tanszék, Jikei Egyetem Kashiwa Kórház, Kashiwa, Japán
Yuriko Nishikawa
1 Mikrobiota Kutatási Osztály, Juntendo University Graduate School of Medicine, Tokió, Japán
Nobuhiro Sato
1 Microbiota Research Department, Juntendo University Graduate School of Medicine, Tokió, Japán
Társított adatok
Absztrakt
Háttér: A krónikus székrekedés, beleértve a funkcionális székrekedést és a székrekedés típusú irritábilis bél szindrómát, elterjedt, multifaktoriális gyomor-bélrendszeri rendellenesség, etiológiája és patofiziológiája továbbra sem ismert. A közelmúltban végzett 16S rRNS-alapú mikrobiota profilozással végzett vizsgálatok kimutatták, hogy krónikus székrekedésben a bél mikrobiota diszbiózisa.
Célok: Áttekintést nyújtani a krónikus székrekedésben szenvedő mikrobiotával és a krónikus székrekedés kezelésével kapcsolatos legújabb vizsgálatokról probiotikumok, prebiotikumok, szinbiotikumok, antibiotikumok és a széklet mikrobiota transzplantációja (FMT) segítségével.
Mód: A PubMed kereséseket 2018. augusztus 1-ig végezték kulcsszavak használatával: „IBS”, „IBS-C”, „irritábilis bél szindróma”, „irritábilis bél szindróma székrekedéssel”, „funkcionális székrekedés”, „krónikus székrekedés” és „bél” kombinációban. mikrobiota, „diszbiózis”, „bél mikroflóra” krónikus székrekedésben szenvedő mikrobiotára, valamint „probiotikumokkal”, „prebiotikumokkal”, „szinbiotikumokkal”, „antibiotikumokkal” és „székletmikrobiota transzplantációval” kombinálva.
Eredmények: A bél mikrobiota megállapításai a funkcionális székrekedésben következetlenek, és jelenleg nincs konszenzus. Bár nincs egyértelmű konszenzus, az egészséges alanyokhoz képest az IBS-C betegek székletmintáiban alacsonyabb az Actinobacteriumok, köztük a Bifidobacteriumok szintje, és a nyálkahártyájukban magasabb a Bacteroidetes szint. A legtöbb randomizált, kontrollált és párhuzamos csoportos vizsgálatban a probiotikumok, a prebiotikumok, a szinbiotikumok, az antibiotikumok és a krónikus székrekedés elleni FMT-terápia kevés mellékhatással voltak hatékonyak. Ugyanakkor sok tanulmány létezik kis számban, és a probiotikumok típusai eltérnek, nehéz értékelni a hatást.
Következtetések: A bizonyítékok azt mutatják, hogy a bél mikrobiota diszbiózisa hozzájárulhat a funkcionális székrekedéshez és a székrekedés típusú irritábilis bél szindrómához. A székrekedés dysbiosisának célzott kezelése probiotikumok, prebiotikumok, szinbiotikumok, antibiotikumok és FMT segítségével új lehetőség lehet, különösen a hagyományos terápiák refrakter székrekedése esetén.
Bevezetés
A közelmúltban a tenyésztési módszerek helyett a 16S rDNS génszekvencián alapuló molekuláris megközelítések használták a bél mikrobiotájának elemzését. A kultúrától független technológiák fejlődése megmutatta az emberi mikrobiom óriási változatosságát, funkcionális kapacitását és az életkorral összefüggő dinamikáját. A disztális gyomor-bél traktusban számos különféle mikrobiális faj található, és a bél mikrobiota dysbiosis - ezen bélmikrobák összetételének és működésének egyensúlyhiánya - a lokalizált gasztroenterológiai rendellenességektől kezdve a székrekedésen át a pszichoneurotikus, légzőszervi, anyagcsere, máj, és szív- és érrendszeri betegségek (1, 2).
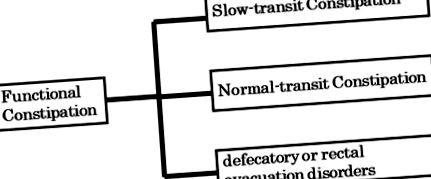
A funkcionális székrekedést (FC: Roma II-IV osztályozás) tipikusan normális tranzit székrekedés (NTC), lassú tranzit székrekedés (STC) és ürítési vagy végbélkiürítési rendellenességek közé sorolják, olyan specifikus tesztek alapján, mint a vastagbél átmeneti ideje, a manometria értékelése és a defekográfia. ( 1.ábra ). A székletürítési vagy végbélkiürítési rendellenességeket a medencefenék diszinergiája, valamint az intraabdominális nyomás csökkenése (a lehordás aktusa), a végbél szenzoros észlelése és a végbél összehúzódása okozza, ami arra utal, hogy ez a fajta FC nem kapcsolódik a bél mikrobiotájához. Ezzel szemben az NTC és az STC a bél mikrobiotájához kapcsolódik. Érdekes módon a nyugati országok legtöbb irodalma az STC és a bél mikrobiota közötti összefüggésről számol be (3). A krónikus székrekedés, amelyet hasi fájdalom kísér, székrekedéssel járó irritábilis bél szindrómának minősül (IBS-C: Roma II-IV. Osztály). A bélmikrobiota bizonyítottan szerepet játszik az IBS-C-ben.
A funkcionális székrekedés három tág kategóriája.
Egészen a közelmúltig a székrekedést tanulmányozták a bélműködés szempontjából, azonban számos tanulmány kimutatta a bél mikrobiota diszbiózisát székrekedésben szenvedő betegeknél az egészséges kontrollokhoz képest. Ebben az áttekintésben összefoglaljuk azokat a jelenlegi bizonyítékokat, amelyek alátámasztják a bél mikrobiota szerepét a bél mikrobiota dysbiosisára irányuló krónikus székrekedés patogenezisében és kezelésében.
Bél mikrobiota a funkcionális székrekedésben
2. táblázat
Dysbiosis irritábilis bél szindrómában székrekedéssel.
| Malinenet al. (10) | Kvantitatív RT-PCR | Ürülék | IBS-C (n = 9) (átlagéletkor 46,5 év) | HC (n = 22) (átlagéletkor 45 év) | IBS-C: Veillonella spp |
| Maukonen és mtsai. (11) | DGGE és kvantitatív RT-PCR | Ürülék | IBS-C (n = 6) (átlagéletkor 45 év) | HC (n = 16) (átlagéletkor 45 év) | IBS-C: Clostridium coccoides-E. végbélcsoport ↓ |
| Rajilić-Stojanović et al. (12) | Filogenetikus 16S rRNS mikroarray és kvantitatív RT-PCR | Ürülék | IBS-C (n = 18) (átlagéletkor 49 év) | HC (n = 46) (átlagéletkor 45 év) | IBS-C: Firmicutes (Clostridium) ↑ Bacteroidetes ↓ Aktinobaktériumok ↓, |
| Chassard és mtsai. (13) | Kultúra | Ürülék | IBS-C nőstény (n = 14) (48 éves átlagéletkor) | HC nőstény (n = 12) (átlagos életkor: 30 év) | IBS-C: Enterobacteriaceae ↑ Szulfát-redukáló baktériumok ↑ Bifidobaktériumok ↓ Lactobacillusok ↓ |
| Durbán és mtsai. (14) | 16S rRNS gén szekvenálás (V1 – V2) | Mucosa | IBS-C (n = 3) (ND átlagéletkor) | HC (n = 9) (ND átlagéletkor) | IBS-C: Bacteroidetes ↑ Enterobacteriaceae ↑ |
| Parkes és mtsai. (15) | HAL | Mucosa | IBS-C (n = 20) (átlagéletkor 32,4 év) | HC (n = 26) (átlagéletkor 46,1 év) | IBS-C: Bacteroidetes ↑ Bifidobaktériumok ↑ C. coccoides-Eubacterium rectale ↑ |
IBS-C, székrekedés domináns irritábilis bél szindróma; HC, egészséges kontroll; RT-PCR, valós idejű PCR; DGGE, denaturáló gradiens gélelektroforézis elemzés; FISH, fluoreszcens in situ hibridizáció; ÉN, nincs leírás.
Baktériumtenyésztési tesztek alkalmazásával Malinen és mtsai. (10) kimutatták, hogy az IBS-C-ben szenvedő betegeknél a Veillonella fajok szintje szignifikánsan megemelkedett az egészséges kontrollokhoz képest (p 2. ábra). Az a megfigyelés, miszerint a Bacteroidetes szint magas volt a vastagbél nyálkahártyájában, összhangban áll Parthasarathy és munkatársai korábbi tanulmányával. (8), amely FC betegeknél megvizsgálta a nyálkahártya mikrobiotáját. A vastagbél nyálkahártyájához kapcsolódó bélbaktériumok a közvetlenül vagy általuk termelt metabolitok révén elnyomhatják a bélmozgást.
Dysbiosis IBS-C betegekben.
Krónikus székrekedés kezelése probiotikumok, prebiotikumok és szinbiotikumok alkalmazásával
A prebiotikumok emészthetetlen szénhidrátok, például oligoszacharid és inulin, amelyek növelik a probiotikumok, például a Bifidobacteriumok és a Lactobacillus mennyiségét, amelyek általában jelen vannak az emberekben. Az áttekintésben szereplő tanulmányok algoritmusát a 3. kiegészítő ábra mutatja be. A 3. táblázat összefoglalja az RCT-ket, amelyek ezen prebiotikumok, probiotikumok és szinbiotikumok hatásait vizsgálták (16–37).
3. táblázat
Prebiotikumok, probiotikumok és szinbiotikumok randomizált, kontrollált és párhuzamos csoportos vizsgálata krónikus székrekedés esetén.
| PREBIOTIKA | |||||
| Bouhniket al. (16) | 33 (átlagéletkor 59 év) | 32 (átlagéletkor 57 év) | Laktulóz | Polietilén glikol | Nincs jelentős különbség |
| Linetzky Waitzberg és mtsai. (17) | 28 nő (átlagéletkor 36,1 év) | 32 nő (átlagéletkor 40,2 év) | Inulin | Maltodextrin | Nincs jelentős különbség |
| PROBIOTIKA | |||||
| Koebnick és mtsai. (18) | 35 (átlagéletkor 43,3 év) | 35 (átlagéletkor 44,6 év) | L. casei Shirota | Ital probiotikumok nélkül | Székletürítési gyakoriság ↑ (p = 0,004) Kemény széklet ↓ (p 3. táblázat, minden felnőtt vizsgálata jelezte a probiotikumok hatékonyságát a székrekedés kezelésében. Ishizuka és mtsai keresztezett vizsgálatot végeztek vagy 10 10 cfu/100 ml B. lactis GCL2505 vagy baktérium nélküli tejtermék beadásával. placebó 17 székrekedésben szenvedő betegnél. Két héttel az alkalmazás után a B. lactis-t kapó betegeknél jelentősen megnőtt a székletürítés gyakorisága és a széklet mennyisége (19). Mivel a betegek székletében nagyobb volt a B. lactis mennyisége, A szerzők arra a következtetésre jutottak, hogy a baktériumok szaporodása hozzájárulhat a székrekedés tüneteinek javulásához. Nemrégiben Yoon és munkatársai RCT-t végeztek 3,0 × 108 CFU/g Streptococcus thermophilus MG510 és 1,0 × 108 CFU/g Lactobacillus plantarum LRCC5193 adagolásával, 171 esetben sok esetben (26). Arra a következtetésre jutottak, hogy a probiotikumok jelentősen javították a széklet konzisztenciáját krónikus székrekedésben szenvedő betegeknél. Ezenkívül a L. plantarum jótékony hatása a széklet konzisztenciája megmaradt a probiotikus kiegészítés abbahagyása után. Gyermekeknél a székrekedés klinikailag jelentős probléma, és sok RCT-t végeznek probiotikumok beadásával. Bu és mtsai. értékelje a probiotikumok (Lactobacillus casei rhamnosus, Lcr35) hatékonyságát krónikus székrekedésben szenvedő gyermekek kezelésében, és hasonlítsa össze annak hatását a magnézium-oxiddal (MgO) és a placebóval (27). Beszámoltak arról, hogy az Lcr35 hatékony volt krónikus székrekedésben szenvedő gyermekek kezelésében. Az MgO és az Lcr35 között nincs statisztikailag szignifikáns különbség a hatásosságban, de kevesebb hasi fájdalom fordult elő az Lcr35 alkalmazásakor. A Tabbers et al. (30) és Wojtyniak et al. (31) nem számolt be a Bifidobacterium lactis és az Lcr35 jelentős hatásáról a funkcionális székrekedésre a placebóval összehasonlítva. |
Kevés olyan mellékhatást jelentettek, mint hasi fájdalom, hasi duzzanat, hányás (16, 30, 32) a fent leírt vizsgálatokban, jelezve, hogy ezeknek a szereknek az alkalmazása biztonságos. Ezért a probiotikumok, a prebiotikumok és a szinbiotikumok hatékony kezelési lehetőségek lehetnek a székrekedés esetén. Mivel kis számú tanulmány van, és a probiotikumok típusai különböznek, nehéz értékelni a hatást. Ezért szükség lesz számos vizsgálat elvégzésére specifikus probiotikumokkal kapcsolatban.
Krónikus székrekedés kezelése antimikrobiális szerekkel
Korábbi tanulmányok összefüggést javasoltak a székrekedés és a metanogén baktériumok között azzal a hipotézissel, hogy a metanogén bél mikrobiota a székrekedés kialakulásához vezet a bélmozgás csökkentésével (38). Vizsgálatok kimutatták, hogy a krónikus székrekedésben szenvedő betegeknél több metanogén baktérium van, mint egészséges egyéneknél (39, 40).
Low és mtsai tanulmányában. (41), az IBS-C-ben szenvedő,> 3 ppm metántermelésben szenvedő betegeket rifaximinnal és neomicinnel kezelték 10 napig, a tünetek és a lélegzetvizsgálati eredmények változását laktulóz-lélegzetvizsgálattal vizsgálták. A betegek neomicint és rifaximint (n = 27), csak neomicint (n = 8) vagy önmagában rifaximint (n = 39) kaptak. A tünetek a betegek 85, 63, illetve 56% -án javultak, ami szignifikáns javulást mutat a neomicin + rifaximin csoportban a csak rifaximin csoporthoz képest (p = 0,01). Továbbá a neomicin + rifaximin kezelésben részesülő betegeknél a metanogén baktériumok szintje jelentősen csökkent. A betegek 87 százalékának metántermelési szintje volt. A 4. táblázat összefoglalja a refrakter székrekedés székletmikrobiota transzplantációval (FMT) történő kezelésére vonatkozó vizsgálatokat (42–47). Borody és mtsai. (42) 4 krónikus székrekedésben szenvedő betegnél végzett FMT-t, és azonnali javulást mutatott a tünetekben, mint például a hasi fájdalom, a korai jóllakottság és az émelygés, valamint a székletürítés gyakoriságának jelentős javulása naponta egyszer vagy kétszer. Továbbá a refrakter székrekedésben szenvedő beteg esettanulmányában a szerzők kimutatták, hogy az FMT 2-3 nappal a transzplantáció után hatékonyan indukálta a székletürítést, naponta egyszer vagy kétszer ürítési gyakorisággal (43). Ge és mtsai. (44) 6 STC-ben szenvedő betegnél végzett FMT-t, és a székletürítés gyakoriságának szignifikáns növekedését mutatta, az előkezelés heti heti 1,6 ± 0,2-ről a kezelés utáni 12 héten heti 5,0 ± 0,4-re (p (75K, jpg)
- HCG 1234 Review (UPDATE 2020); 8 dolog, amit nem tettél; t Tudd
- Gyerekek krónikus székrekedés tünetei; Kezelések - CHOC Gyermekek
- Piaci frissítés 2017-ben - a vagyon ápolása
- Irritálható bél szindróma Felülvizsgálat és frissítés
- Green Magic koncentrált táplálkozási áttekintés (UPDATE 2020); 8 dolog, amit nem tettél; t Tudd