Fehérjehiány
A fehérjehiány csökkentette a lipáz szövettartalmát és az acináris sejtek lipázszekréciós képességét, ezáltal védőhatásra utalhat az etanol okozta hasnyálmirigy-gyulladás ellen.
Kapcsolódó kifejezések:
- Nagy sűrűségű lipoprotein
- Krónikus vesebetegség
- Értelmi fogyatékosság
- Fehérje
- Fenotípus
- Mutáció
- Alultápláltság
- Koleszterin-észter transzfer fehérje
- Elhízottság
Letöltés PDF formátumban
Erről az oldalról
Fehérjehiány
A „fehérjehiány” kifejezés a testfehérjék vagy egy vagy több esszenciális aminosav relatív vagy abszolút hiányának állapotát jelenti. A „fehérjeforgalom” tükrözi a fehérje lebomlásának és újraszintézisének egyensúlyát. A szintézisnél több bontás anabolikus állapotot jelez, amely sovány szöveteket épít, több lebontás, mint a szintézis, azt, hogy katabolikus állapot égeti a sovány szöveteket. A keringő aminosavkoncentrációk és katabolizmusuk aránya között a kvantitatív kapcsolat nem egyenletes, sem az egyének, sem az étrend között. A tartósan magas vagy alacsony fehérjebevitel az aminosav katabolizmusának általános növekedéséhez vagy csökkenéséhez vezet, amely részben független a keringő aminosav koncentrációtól. Bár a fehérjehiány fő oka a fehérjehiányos étrend, a rendellenesség általában különféle kóros állapotokban fordulhat elő. A fehérjehiány diétás kezelése a hiány okától függ, és a mögöttes rendellenesség alapos megértésétől kell függenie, és a kezelés fő támasza magában foglalja az egyensúlyi energia-fehérje és mikroelem-kiegészítést.
Lipoprotein és lipid anyagcsere
96.7.1.1. Klinikai jellemzők
A CETP-hiány a CE-gazdag nagy HDL plazmában történő felhalmozódásához vezet, amelynek következtében emelkedik a HDL-koleszterin és az apo A-I plazmakoncentrációja, valamint csökken a plazma LDL-koleszterin és az apo B koncentrációja (17). A CETP hiányához nincsenek társítva specifikus fizikai megnyilvánulások. A genetikai CETP-hiány CVD-kockázatra gyakorolt hatása ellentmondásos, különösen azt követően, hogy a CETP-gátló torcetrapibdal végzett klinikai vizsgálat váratlan növekedést okozott a szívhalálokban (109). A CETP-hiány a károsodott RCT állapot lehet, amely ateroszklerózishoz vezethet a magas plazma HDL-koleszterinszint ellenére (110) .
FEHÉRJE | Hiány
Kezelés
A fehérjehiány diétás kezelése a hiány okától függ. Nephrotikus szindrómában szenvedő betegeknél, akiket az albumin vizeletbe történő jelentős elvesztése jellemez, a fehérjebevitelt felnőttek számára napi 90–120 g-ra kell növelni, amikor az albumin májszintézise részben kompenzálhatja a vizeletvesztést. (Lásd: KWASHIORKOR; MARASMUS.)
Akut veseelégtelenség esetén a fehérje bevitele csak napi 20 g lehet. Ez csökkenti a fehérje anyagcserét és a karbamid termelését. Májcirrózisban szenvedő betegeknél a fehérjebevitelt is csökkenteni kell, mert a magas fehérjetartalmú étrend kiválthatja a máj encephalopathiáját.
Speciális etetési módszerek
A fehérjehiány kezelhető tubusos etetéssel, intravénás táplálással vagy kiegészítő etetéssel. A csövek etetése súlyos alultápláltságban szenvedő betegek számára javasolt, akik nem tudnak enni. A parenterális táplálás elengedhetetlen, ha a vékonybél nem képes megemészteni és felszívni a tápanyagokat, vagy súlyos sérülések, például égési sérülések után.
Enyhe fehérjehiányok esetén a fokozott orális fehérjebevitel elegendő az étrendi igények kielégítésére. Számos magas fehérjetartalmú speciális készítmény kapható a piacon.
Bonyodalmak
Mivel a fehérjehiányt gyakran fertőzések, kiszáradás, valamint a vitaminok és elektrolitok hiánya kíséri, ezekre az állapotokra különös figyelmet kell fordítani. A súlyos fehérjehiány legtöbb esetben ezért a kezelést folyadékpótlással kell kezdeni, és ha indokolt, antibiotikum-terápiával kell kezdeni.
Lipoprotein rendellenességek
Koleszteril-észter transzfer fehérje (CETP) hiánya
A lipidszint-csökkentő terápiák genomikája és farmakogenomikája
CETP hiány
A CETP hiányosság autoszomális recesszív módon öröklődik, amelynek során az érintett egyéneknél a CETP gén mindkét példányában a funkcióvesztés mutációi vannak. Ez megnövekedett HDL-C-szintet és alacsony LDL-C-szintet eredményez a CETP által vezérelt koleszterin-észterek HDL-ből apo B-tartalmú lipoproteinekbe, például VLDL, IDL és LDL-be történő átvitele miatt. Számos mutációt azonosítottak, és az adatok arra utalnak, hogy ez a genetikai rendellenesség leginkább a japán populációban fordul elő [41]. A két leggyakoribb mutáció a G> A a 14. intron +1 pozíciójában és a D> G szubsztitúció a 15. exon 442 pozíciójában (D442G), amelyek a japán populáció körülbelül 2, illetve 7% -ában vannak jelen. Tekintettel arra, hogy a CETP-aktivitás gátlása alacsonyabb atherogén lipoproteinek termelést eredményez, felvetésre került, hogy a CETP-hiány alacsonyabb CVD-kockázattal jár [42]. A bizonyítékok a mai napig ellentmondásosak, egyes tanulmányok a CETP-hiányhoz kapcsolódó alacsony CVD-kockázatra utalnak, mások pedig egyértelmű eredményeket mutatnak. Ezt a kérdést tovább bonyolítja az a tény, hogy a CETP farmakológiai gátlása jelenleg nem jár előnyös a kardiovaszkuláris kimenetellel szemben.
Fehérjehiány és alkohol: kölcsönhatások és szervi hatások
A fehérjehiány hatása a májra
A fehérjehiány májváltozásokkal jár, beleértve a máj steatosisát, a májsejtekrózist és a fokozott rostos szöveti lerakódást (Webber és Freiman, 1974). Ezek a változások hasonlóak az alkoholos májkárosodásnál megfigyeltekhez. Valójában mind az etanol-, mind a fehérjehiány kölcsönhatásba léphet, ami súlyosabb anyagcserezavarhoz és májelváltozáshoz vezet. Az etanol bizonyos körülmények között gátolhatja a fehérjeszintézist, ezt a hatást osztja a fehérje éhezés (Rothschild et al., 1974). A fehérjehiány rontja az etanol anyagcserét, csökkentve a máj etanol clearance-ét, a májalkohol dehidrogenáz és a mikroszomális etanol oxidáló rendszer (MEOS) aktivitását, bár az előbbi redukciója kevésbé volt észrevehető, és a MEOS aktivitása még fokozódott is, ha a fehérjehiány etanolfogyasztással járt ( Wilson és mtsai., 1986).
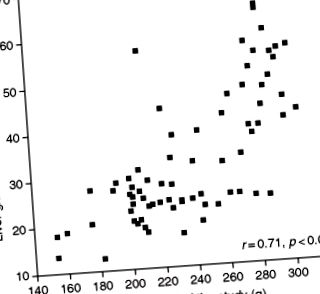
1.ábra . Kapcsolat a máj glutation-peroxidáz és a patkányok súlya között egy vizsgálat végén, amelyben az állatokat etanollal és fehérjehiányos táplálékkal etették 5 hét alatt (González-Reimers és mtsai., Publikálatlan eredmények).
Asztal 1 . A máj és az izom glutation-peroxidáz (GPX, mU/mg-ban) és a szuperoxid-diszmutáz (SOD, lU/mg-ban) és malondialdehid (MDH, nmol/mg szövetben) koncentrációban táplált patkányokban, izokalorikusan, 18% fehérje- és 2 % fehérjetartalmú étrend
| Máj GPX | 54,9 ± 5,4 | 26,1 ± 3,8 | p 2. táblázat). A máj GPX aktivitásának helyreállítása helyreállíthatja az antioxidáns kapacitást, és kevesebb rostos szövet lerakódásával jár. A szelén a GPX kofaktoraként működik, ennek az enzimnek a aktivitása drámai módon függ a szelén koncentrációjától. A szelén metabolizmusa alkoholos májbetegségben és a szelénhiány relatív súlya a lipidperoxidáción azonban nem ismert. |
2. táblázat Hisztomorfometriásan meghatározott májzsír és fibrózis, valamint a máj vastartalma (atomi abszorpciós spektrofotometriával) etanollal és alacsony fehérjetartalmú étrenddel kezelt patkányokban, Lieber-DeCarli modellt követve
Etanol + 2% fehérje (8)
Megjegyzések: A csoportok közötti különbségeket a Student's-Newmann-Keuls (SNK) teszt segítségével értékelték. A zárójelben szereplő ábrák az esetek számát mutatják (González-Reimers et al., Nem publikált adatok).
A vasfelhalmozódás kedvez a lipidperoxidációnak, és összefügg a máj steatosisával. Az etanol és a fehérjeszegény étrend közötti szinergista kölcsönhatást a máj vasfelhalmozódása tekintetében leírták patkányokban Lieber – DeCarli kísérleti modell alkalmazásával (Conde-Martel és mtsai, 1992a). Vas túlterhelést figyeltek meg a fehérje-kalória alultápláltság egyéb helyzeteiben (Jackson, 1986). Egy csoportunk által 76 patkányon végzett, a Lieber – DeCarli kísérleti modellt követő 5 héten át végzett vizsgálatban szignifikáns összefüggést figyeltek meg a májvas és a fogyás között (2. ábra). Érdekes, hogy a vas a Kupffer-sejteket előkészíti a nukleáris faktor kappa B aktiválására, legalábbis alkoholos májkárosodás esetén (Tsukamoto et al., 1999), és a megnövekedett transzferrin-telítettség összefügg a májfibrózissal alkoholmentes steatohepatitisben (Angulo et al., 1999) - bár ez az összefüggés egy többváltozós elemzésben még mindig nem volt nyilvánvaló - míg a májbiopsziában a festhető vas a fibrózis rizikófaktora az alkoholos májbetegségben (Raynard et al., 2002). George és mtsai. (1998) 51 nem alkoholos steatohepatitisben szenvedő beteg sorozatában, amelyek 31% -a heterozigóta vagy homozigóta volt a hemochromatosis gén mutációja miatt, összefüggést talált a májvas és a májfibrózis súlyossága között.
2. ábra . A májvas és a patkányok súlya közötti kapcsolat egy olyan vizsgálat végén, amelyben az állatokat etanollal és fehérjehiányos táplálékkal etették 6 hét alatt (González-Reimers és mtsai., Publikálatlan eredmények).
Így az etanol májfehérje-anyagcserére kifejtett hatásain és a fehérjehiány etanol-anyagcserére gyakorolt csökkentő hatásain kívül kapcsolat állhat fenn a fehérjehiány és az etanol között a májkárosodás patogenetikai mechanizmusát illetően. Mindkét esetben fokozott lipidperoxidáció és megváltozott vasraktár figyelhető meg.
A szisztémás betegség hematológiai megnyilvánulásai
Fehérje-kalória alultápláltság
Megfelelő szénhidrát-kalóriabevitel (kwashiorkor) jelenlétében fellépő fehérjehiány az enyhe normokróm, normocita vérszegénységgel jár együtt, amely a normális vagy megnövekedett vörösvértest-termelés, valamint a vörösvértest-túlélés ellenére is csökken. A fehérje kalória alultápláltság a leukocita funkció károsodásával is jár.
Skorbut
Gyakori az enyhe vérszegénység. Vérzési hajlam jelentkezik az érrendszer integritásának elvesztése miatt, ami petechiákat, subperiostealis, orbitális vagy subduralis vérzéseket okozhat. Hematuria és melena fordulhat elő.
Anorexia Nervosa
A következő hematológiai változásokat fejlettebb szakaszokban hozza létre:
A csontvelő zselatin változásai, amelyek súlyosan hipoplasztikussá válhatnak
Enyhe vérszegénység (makrocita), neutropenia és thrombocytopenia
A neutropeniával járó fertőzésre való hajlam
Szabálytalanul összehúzódó vörösvértestek láthatók (mint a hypothyreosisban) a membrán lipidek összetételének zavara miatt.
A szisztémás betegség hematológiai megnyilvánulásai
Táplálkozási rendellenességek
Fehérje-kalória alultápláltság
Megfelelő szénhidrát-kalóriabevitel (kwashiorkor) jelenlétében fellépő fehérjehiány az enyhe normokróm, normocita vérszegénységgel jár együtt, amely a normális vagy megnövekedett vörösvértest-termelés, valamint a vörösvértest-túlélés ellenére is csökken. A fehérje-kalória alultápláltság a leukocita funkció károsodásával is jár.
Skorbut
Gyakori az enyhe vérszegénység. Vérzési hajlam jelentkezik az érrendszer integritásának elvesztése miatt, ami petechiákat, subperiostealis, orbitális vagy subduralis vérzéseket okozhat. Hematuria és melena fordulhat elő.
Anorexia Nervosa
Az anorexia nervosa hematológiai változásokkal társul, amelyek hasznosak lehetnek a diagnózisban:
A vörösvértest-morfológia feltűnő az acanthocytosis szokatlan morfológiája szempontjából. Ez a táplálékhiány miatt másodlagos szerzett hipobetalipoproteinémia miatt következik be
Enyhe vérszegénység (macrocytás), neutropenia és thrombocytopenia
Enyhe hajlam a neutropeniával járó fertőzésre
A csontvelő zselatin változásai, amelyek súlyosan hipoplasztikussá válhatnak.
Az X-kapcsolt limfoproliferatív szindrómák
Kim E. Nichols, Rebecca A. Marsh, Stiehm Immunhiányai című művében, 2014
XLP1/SAP hiányosság
Bár az SAP hiányban nincsenek ismert genotípus – fenotípus összefüggések, a betegség kialakulására való hajlam összefüggésben lehet az SAP fehérje szintjével és a teljes limfociták funkcionális képességével. Ezt bizonyítja, hogy az SAP-hiányos ikerfiúk, akik egy splice-site mutációt hordoznak az SH2D1A-ban, amely lehetővé teszi a perifériás vér limfocitáiban bizonyos maradék SAP-expressziót, felnőttként is egészségesek maradtak. 12 Ezenkívül a vad típusú SAP expressziója a limfociták csak kis százalékában lehet elegendő a betegség megnyilvánulásainak megelőzésére. Ennek az elképzelésnek az alátámasztására az SH2D1A mutációk női hordozóinak, akiknél a véletlen X-kromoszóma inaktiválás miatt a T és NK sejtek körülbelül felében hiányzik az SAP fehérje expresszió, nincsenek nyilvánvaló XLP1 tünetei. Bár a betegség kialakulásának elméleti kockázata továbbra is fennáll, ha a lyonizációban súlyos torzulás következik be az SAP-expresszió hiányában szenvedő sejtek javára, tudomásunk szerint ezt még nem írták le. Végül nemrégiben beszámoltak arról, hogy az SH2D1A mutáció szomatikus reverzióval történő korrekciója a perifériás vér T-sejtjeinek csupán 1-2% -ában a funkcionális SAP új expresszióját eredményezi, és hozzájárulhat az EBV-fertőzést követő hosszabb túléléshez. 16.
- Nephrolithiasis - áttekintés a ScienceDirect témákról
- Nephrosclerosis - áttekintés a ScienceDirect témákról
- Skinfold - áttekintés a ScienceDirect témákról
- Nátriummérleg - áttekintés a ScienceDirect témákról
- Pihenő energiaköltségek - áttekintés a ScienceDirect témákról