Fehérjeszűkítés, epigenetikus étrend, szakaszos éhgyomor, mint új megközelítés az életkorral összefüggő betegségek megelőzésében
Nazanin Asghari Hanjani
Táplálkozási Tanszék, Közegészségügyi Iskola, Iráni Orvostudományi Egyetem, Teherán, Irán
Mohammadreza Vafa
Táplálkozási Tanszék, Közegészségügyi Iskola, Iráni Orvostudományi Egyetem, Teherán, Irán
Absztrakt
Bevezetés
Manapság az elhízás az egyik olyan kérdés, amellyel a társadalmak világszerte szembesülnek. Az elhízás a genetikai és környezeti tényezők komplex kölcsönhatásaként ismert, amelyet időnként a morbiditás és a mortalitás alakít ki. A túlsúly és az elhízás számos egészségügyi probléma eredete vagy kiváltója lehet, függetlenül és egy másik betegséggel együtt. Az élelmiszer-fogyasztásnak két szélsősége van: (i) elég alacsony ahhoz, hogy éhen haljon, és (ii) elég magas ahhoz, hogy elhízáshoz vezessen. A kalória-korlátozás (CR) e két véglet között helyezkedik el. A CR rendszert általában a kalóriabevitel csökkentésével hajtják végre az ad libitum (AL) akár 20–40% -ával, miközben a megfelelő tápanyag-bevitel megmarad.
1917-ben először Osborne és munkatársai [3] számoltak be arról, hogy az ételbevitel korlátozása lelassíthatja a növekedést és növelheti az élet hosszú életét. A módszertani hibák miatt azonban nem keltett nagy figyelmet. Ezt követően, 1935-ben, MacCay [4] publikált egy cikket, amely azt mutatta, hogy a patkányokban előforduló alultápláltság nélküli CR növelheti az élet átlagos és maximális hosszát. [5] Világszerte számos kutató megerősítette ezt a megfigyelést, és kimutatta, hogy a CR a leghatékonyabb nongenetikus stratégia az élet meghosszabbítására más modell organizmusokban, beleértve az élesztőket, gyümölcslegyeket, halakat és majmokat. A patkányok élettartamának növekedését figyelték meg, amikor a tápanyagok hozzáférhetősége a faj normál kalóriabevitelének 30–75% -a közé csökken. Nemcsak a kalóriatartalmú rágcsálók éltek tovább, mint az AL-al táplált társaik, hanem jelentős részük (kb. 30%) elhalt minden nyilvánvaló patológia nélkül, felvetve annak a szembeszökő lehetőségét, hogy az öregedés nem feltétlenül szorosan kapcsolódik költséges kórképekhez. [6,7, 8,9]
Másrészt a történelemnek számos példája van arról, hogy a CR az élelmiszerhiány miatt az emberi egészség előnyére vált. A második világháború csökkentette sok Európában élő ember táplálékfelvételét, ami öregedésgátló előnyökhöz vezetett. Ezáltal kevesebb szívbetegségről, magas vérnyomásról és cukorbetegségről számoltak be [1]. Ezenkívül a rák előfordulása a vártnál alacsonyabb volt azoknál a norvég nőknél, akik pubertást éltek át a második világháború élelmiszerhiánya alatt. [10]
Néhány tanulmány kimutatta a CR rákellenes hatásait; azonban nem meggyőzőek. [11,12,13] A javasolt mechanizmus az, hogy a CR hosszú távú kitettsége számos citokin, növekedési faktor és hormon keringési szintjének csökkenéséhez vezethet, a növekedési faktor csökkenésével együtt jelzés, percenkénti vascularis zavarok és gyulladás. Ezek a CR által okozott változások egyidejűleg csökkentik a rák kockázatát és a progressziót. [14] Konkrétan a testtömeg 20% -os vagy annál nagyobb csökkenését, a szérum inzulinszerű 1-es növekedési faktort (IGF-1) legfeljebb 75% -kal és a glükózt legfeljebb 70% -kal jelentették egerekben rövid távú éhezés után. Ilyen körülmények között az élesztőhöz hasonló állatok nagyon stresszállóvá válnak. Továbbá az IGF-1 szintjének csökkentése a normál sejtekben és egerekben fokozza a kemoterápiától függő károsodásokkal szembeni ellenálló képességüket, miközben a daganatok nagy számát egyszerre érzékenyíti a kemo- és sugárterápiára. [15,16] Morbid elhízott betegeknél végzett klinikai vizsgálatok azt mutatták, hogy 1 400 kcal/nap vagy 3 hét 500 kcal/nap nagyon alacsony kalóriatartalmú étrend (VLCD) hétén javult az inzulinszekréció. [17]
Az egereknek az apolipoprotein E gén (ApoE -/-) homozigóta kiiktatásában korlátozott kalóriatartalmú (az összes kalória 60% -a) alkalmazásakor viszonylag korai stádiumban kevesebb volt az ateroszklerotikus elváltozások képződése az AL csoporthoz képest. [18] Az elhízás miatti endotheliális diszfunkciót és vaszkuláris oxidatív stresszt a CR megfordította C57Bl/6 egerekben. [19] Az emberi és nem emberi főemlősök vizsgálatának eredményei azt mutatták, hogy a CR csökkentheti a triglicerideket, a vérnyomást és növelheti a nagy sűrűségű lipoprotein szintet. [20] A ciklofoszfamidhoz hasonlóan a CR késleltetheti az autoimmun betegségek kialakulását azáltal, hogy csökkenti a B-sejtek arányát, megőrzi a natív T-sejtek nagy számát és immunreakciójukat. [21]
A klinikai és az alapkutatások bizonyítékai rámutatnak az agy működésének csökkenése és az öregedés alatti metabolikus rendellenesség közötti mély kapcsolatra. A túl sok tápanyag rendelkezésre állása káros lehet az agyműködésre. Ezzel ellentétben megállapították, hogy a kalória bevitel 30% -os csökkentése 3 hónapig javítja az idősek memóriateljesítményét. Ezektől a megfigyelésektől eltekintve, a rhesus majmokon eddig három folyamatban lévő CR-vizsgálat eredményei azt mutatták, hogy az öregedő CR-vel kezelt majmok kevésbé súlyos agysorvadást szenvednek (az öregedő agy jellemzője), mint a kontrollal táplált AL. [22] Ezenkívül bebizonyosodott, hogy a CR az agyi eredetű neurotróf faktor (BDNF) up-szabályozásához vezethet, amely összefügg az idegsejtek plaszticitásával és a neurogenezissel. [23]
A CR jótékony és jövedelmező hatása ellenére Giller és mtsai. számoltak be arról, hogy egy 6 hónapos étrendi korlátozás után az újratáplálási időszak megközelítőleg megszünteti a korlátozási periódusban elért összes pozitív változást. [24] Másrészről, egy 6 hónapos étrendi korlátozás csökkentette a fő vizeletfehérjét (Mup5) a hím C57BL6 egerekben, amelyek felelősek a kommunikációért és a nemi működésért. Ezt követően az etetési időszakban a Mup5 csökkenő áramlása megfordult. [25]
Mód
Az adatok a CR-re, az általa működtetett mechanizmusra és a CR-szerű hatásokat utánzó beavatkozásokra vonatkozó eredeti és áttekintő cikkek eredményein alapulnak. Erre a célra elsősorban a PubMed online adatbázisát használtuk. A következő kulcsszavakat kerestük: CR, mechanizmus, fehérjeszűkítés, intermittáló éhgyomorra (IF) és epigenetikus étrendre. Ezután kiválasztottuk a legrelevánsabb teljes szövegeket, és áttekintettük a cikkeket. Áttekintésünk állat- és emberkutatásokat egyaránt tartalmaz.
Alapvető mechanizmus
A másik elmélet magában foglalja a CR pozitív hatását a rapamicin (TOR) és az Akt célpontjának elnyomására. Medvedik és mtsai. számoltak be arról, hogy a TOR gátlása az CRC-vel megegyező mechanizmussal meghosszabbítja az élettartamot, vagyis stabilizálhatja az rDNS-lokuszt és növelheti a Sir2p-aktivitást. [30,31] Az emlős TOR (mTOR) útvonala szerepet játszik az emlődaganatok fejlődésében. Ezért alegységének eltávolítása az életkorral összefüggő betegségek, például immun- és motoros diszfunkció, csontbetegség és inzulinérzékenység előfordulásának csökkentésével jár. [32,33]
A CR miatt kialakuló adaptációk együttesen az inzulin/IGF útvonal (azaz PI3K/Akt/mTOR) lefelé történő szabályozása, valamint két energiaérzékeny út (azaz a sirtuin [SIRT] és az aktivált protein kináz [ AMPK]), amelyek aktiválják az O villásfejet (FOXO). A FOXO-t az autofágia gének, a DNS-javító gén és a sejtproliferációt szabályozó gének lefelé történő szabályozásával alakítják ki [34]. A FOXO apoptózis-elősegítésre gyakorolt hatásaitól eltérően a reaktív oxigénfajták (ROS) -detoxikáló enzimeket, például a katalázt és a szuperoxid-diszmutáz 2-t (SOD2/MnSOD) transzaktiválják. Ezért az intracelluláris oxidatív stressz csökkenti a sejtek túlélését. [35,36] Ezért a FOXO szerepe az apoptózisban és a sejtek túlélésében olyan, mint egy kétélű kard.
Alacsony energetikai sejtszinten az AMPK aktiválódik, amelyet az mTOR lefelé történő szabályozása kísér. [37] Az AMPK-nak fő szerepe van a lipid metabolizmusban és a mitokondriális biogenezisben. A mitokondriális biogenezist koordináló PGC-1α transzkripciós szabályozót a megfelelő működés érdekében a nikotinamid-adenin-dinukleotid (NAD +) függő dezacetiláz SIRT1-nek alacsony acetilezéssel kell ellátnia. A maradékát azonban az AMPK-nak foszforileznie kell, hogy felismerje és kölcsönhatásba lépjen a SIRT1-gyel. Az AMPK mellett növeli az intracelluláris NAD + szintet és javítja a SIRT1 aktivitást. [38]
A másik mechanizmus, amely szerepet játszik a CR által közvetített öregedésgátló előnyökben, az autofágia. A makromolekulák és az organellumok oxidatív károsodása a normális anyagcsere révén következik be. Ha ezeket a károsodott molekulákat az autofágia nem távolítja el, akkor a szabad gyökök termelésének forrásává válnak, amely oxidatív stresszhez, gyulladáshoz és súlyos betegségekhez vezet. Az autofágia védőmechanizmusként működik, amely eltávolítja a sérült vagy elöregedett organellákat, hogy megvédje a sejteket a további oxidatív stressztől, diszfunkciótól és sejthaláltól. Az adatok arra utalnak, hogy az aminosavak CR által okozott csökkenése serkenti az autofágia és a lizoszomális proteolízis aktivitását. [39] Ezenkívül különféle eukarióta fajokon végzett vizsgálatok azt mutatják, hogy a CR a legerősebb autofágia-induktor, és megelőzheti az életkorral összefüggő betegségeket. [40] A CR eredő TOR-gátlás és AMPK-aktiváció aktiválhatja az autofágia-elősegítő Unc-51-hez hasonló autofágia-aktiváló kináz-1 komplexet párhuzamosan az autofágia szempontjából szükséges mikrotrigális transzportmechanizmust stimuláló Mec-17 acetil-transzferázzal. Ezenkívül az autofág fehérjék dezacetilezéssel aktiválódnak a SIRT1 által, amelyet maga a CR aktivál. [41]
Kimutatták azt is, hogy a CR csökkenti a ROS termelést azáltal, hogy a NADPH oxidázt szabályozza. Másrészt nyilvánvaló, hogy a nukleáris faktor-erythroid 2 (Nrf2) kulcsszerepet játszik az érvédelemben és az öregedési folyamat szabályozásában a sejtek oxidatív stresszre adott transzkripciós reakciójának összehangolásával. A CR helyreállítja az Nrf2 expresszióját és aktivitását az idős agyi mikrovaszkuláris endothel sejtekben. [42] Ezenkívül a CR csillapítja az öregedéssel járó telomer eróziót, és a telomeráz túlexpressziója révén csökkenti a rák előfordulását. [43] A kappa B (NFκ-B) nukleáris faktor szintén egy redox-érzékeny transzkripciós faktor, amely a sejtproliferációban és a gyulladásban szerepet játszó gének expresszióját indukálja. Felvetődött, hogy a CR növeli az IkkB citoplazmatikus szintjét, ami megakadályozza az NFκ-B transzlokációját a sejtmagba. [44]
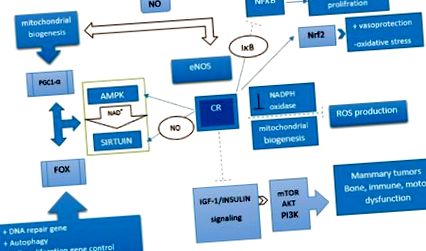
A CR indukálja az endotheliális nitrogén-oxid szintetázt, és a mitokondriális biogenezis növekedését eredményezi. Hasonlóképpen, a NOS aktiválja a SIRT1 gént in vivo és in vitro. Az emlősök a Sir2, SIRT1–7 élesztő hét homológját tartalmazzák, amelyeknek számos üdvös és öregedésgátló hatása van. [45] Közülük a SIRT1-et vizsgálták a legszélesebb körben. Képes összekapcsolni az anyagcsere állapotát a transzkripciós kimenetekkel, így kulcsszerepet játszik az energia hemosztázisában. Szabályozhatja a stressz glükóz által stimulált inzulin szekrécióját a hasnyálmirigy β-sejtjeiben, és elősegítheti a hasnyálmirigy β-sejtjeinek túlélését az oxidatív stressz és a glükoneogenezis során. [45] A SIRT-nek tucatnyi szubsztrátja van, amelyek között vannak életkorszabályozók, például a FOXO transzkripciós faktorok családja. [46] A SIRT1 hatása a FOXO-k működésére összetett és nagymértékben függ a FOXO célgénjeitől. A SIRT1 csökkenti az apoptózisban részt vevő gének transzkripcióját, miközben elősegíti a stresszrezisztenciában részt vevő FOXO célgének expresszióját. [36] Ezenkívül jelezzük, hogy a CR fokozza a SIRT3 expresszióját. A SIRT3 aktiválása a CR alatt csökkenti az oxidatív stresszt azáltal, hogy aktiválja a mitokondriális antioxidáns enzimet, az SOD2-t [1. ábra]. [47]
A kalóriakorlátozó hatásban szerepet játszó mechanizmus útja. A kalória-korlátozás szabályozza az aktivált protein-kináz és a sirtuin útjait, és szabályozza az inzulinszerű növekedési faktor 1/inzulin útvonalát. Általában a kalória-korlátozás aktivál egy utat, amely csökkenti a gyulladást, a reaktív oxigénfajok termelését és az oxidatív stresszt azáltal, hogy javítja a mitokondriális biogenezist és méregteleníti az enzimaktivitást. Sőt, a sejtproliferációt és a differenciálódást a nukleáris tényezők szabályozásával szabályozhatja: indukálhatja: --->, gátolja: --- |
Az öregedés során a kromatin integritása és a hemosztázis képessége csökken az aberrált génexpresszió miatt. A DNS-metilezés fontos szerepet játszik a DNS-stabilitás és integritás fenntartásában. Ezenkívül számos biológiai folyamatban képes szabályozni a génexpressziót. Az öregedés progressziója során két fő változás következik be a DNS-metilációban. Ezek a változások globálisan csökkent, de lokálisan megnövekedett DNS-metilációs állapotokhoz vezetnek. Érdekes módon a CR képes korrigálni ezt az öregedés által kiváltott helytelen DNS-metilációs mintát. A hiszton-acetilezési és dezacetilezési folyamatokat specifikus enzimek, ún. Hiszton-acetil-transzferázok, illetve hiszton-dezacetiláz (HDAC) katalizálják. Általánosságban elmondható, hogy minél acetilezettebbé válnak a hiszton-amino-farkak, annál valószínűbb, hogy a hisztonokat tartalmazó gén-promoter régió megnövekedett transzkripciós aktivitással rendelkezik. A HDAC-k megnövekedett aktivitása tumorgenezishez vezethet az epigenetikus gén expressziójára gyakorolt hatásokon keresztül, ami a HDAC túlzott expresszióját a rákos sejtek nagyon gyakori jellemzőjévé teszi. Beszámoltak arról, hogy a HDAC aktivitása növekszik a CR során, ami arra utal, hogy a globális deacetilezésnek védő szerepe lehet a táplálkozási stressz ellen, és hatással lehet az öregedési folyamatokra. [48,49]
Böjt időszak
Az organizmus viselkedése és fiziológiája mind összhangban van a 24 órás világos/sötét (LD) ciklusokkal, amelyeket evolúciósan konzervált természetes cirkadián oszcillátorok vezérelnek. Emlősökben az LD-ciklusok jelei stimulálják és szabályozzák a központi cirkadián órát, amely a hipotalamusz suprachiasmaticus magjában található, ami végül környezeti adaptációt eredményez. [50]
Feltételezték, hogy a pihenés ideje alatt a megnövekedett aktivitás a premodern világban, az alvás megzavarásával párosulva, a rákos megbetegedések és a gyulladásos rendellenességek mellett a szív- és érrendszeri betegségek, a cukorbetegség és az elhízás gyakoribb előfordulásával jár [51]. Másrészt Puttonen és mtsai. számoltak be arról, hogy a 2 és 3 éjszakás műszakok fokozott szisztémás gyulladással járnak. [52]
A nyomozók időbeli korlátozással történő etetést (tRF) hasonlítottak össze az AL-hozzáféréssel, mind egerekben a magas zsírtartalmú étrendben (HFD). Látták, hogy „a tRF alatti egerek egyenértékű kalóriákat fogyasztanak a HFD-ből, mint az AL hozzáféréssel rendelkezők. Az előbbi azonban védett az elhízás, a hiperinsulinémia, a máj steatosis és a gyulladások ellen, valamint javította a motoros koordinációt. " Ezért arra a következtetésre jutottak, hogy a tRF-rend javította a CREB, mTOR és AMPK útvonal funkcióit és a cirkadián óra oszcillációit. [53] Sőt, Zarrinpar et al. kimutatták, hogy a patkányok HFD-k során megnedvesített bélmikrobiota tRF-rel helyreállítható. Mivel a bél mikrobiota befolyásolja a gazda anyagcseréjét, fontos stratégia az elhízás és más betegségek ellen. [54]
Ha az egerekben agyi ischaemia után az agyban és a perifériában csökkent az előgyulladásos fehérjék, például az NLRP1 és az NLRP3, az NF-κB, az IL-1 β és az IL-18 [55]. Az étrendre hiányos választ mutató gyermekeknél az IF ketogén étrenddel (KD) kombinálva a vizsgálatban szereplő hat gyermek közül négynél mérsékelt vagy átmeneti javulást mutatott a rohamkontrollban, és az IF neuroprotektív hatásainak tulajdonították. [56] Továbbá beszámoltak arról, hogy az IF enyhíti a kognitív deficitet a szepszis patkánymodelljében olyan mechanizmus révén, amely magában foglalja a gyulladásgátló citokinek szuppresszióját, az NFκB aktiválását és a neurotróf támogatás fokozását. Ezenkívül csökkenti a lipopoliszacharidok által kiváltott interleukin (IL) -1α, IL-1β és a tumor nekrózis faktor alfa szintjének emelkedését, és megakadályozza a lipopoliszacharid által kiváltott (BDNF) szint csökkenését a hippokampuszban. [57] Patkányokkal és egerekkel végzett vizsgálatok kimutatták, hogy a futókerék gyakorlása és az IF növeli a BDNF expresszióját az agy több régiójában, és javítja a szinaptikus plaszticitást és a neurogenezist.
Mind az egereknél, mind az embereknél a 2 vagy 5 napos éhezés a glükóz 30% -os vagy annál nagyobb csökkenését, az IGF-I több mint 50% -os csökkenését és az IGF-1 kötő fehérje 5-10-szeres növekedését okozza. [ 58] IF patkányokban csökkenti a pulzusszámot, a vérnyomást és az inzulinszintet, amely hasonló vagy annál nagyobb, mint a rendszeres testmozgás során, stresszválaszokat magában foglaló mechanizmus révén (a plazma adrenokortikotropin és kortikoszteron növelése). Mivel az inzulinszerű jelátviteli utak lefelé szabályozzák a sejtek stresszre adott válaszát, ez ellentétes cselekedeteik másik oka. [59] Az étkezési gyakoriság és a gyulladásos biomarkerek közötti kapcsolat vizsgálatában beszámoltak arról, hogy azok a nők, akik 20% kalóriát fogyasztottak fehérjéből, szemben Jain S, Singh SN-vel. A kalória-korlátozás - az elhízás kezelésének megközelítése. J Nutr Disord Ther. 2015; 1: 2161–0509. [Google ösztöndíjas]
- A súlycsökkentő diétás társaságok rangsorolása a fogyás elvesztésének szakaszos böjtjének legjobb módja 2019 Dan
- Második napja 16 8 szakaszos böjt (Súlyfigyelők, turmix, szénhidrátok, fontok) - Fogyókúra és
- A testzsír időszakos böjt (akció) Nrg fogyókúra rangsorolása A legjobb online edzők a fogyásért
- Új étrend trend Amerikában szakaszos böjt
- Fehérje kímélő módosított böjt a gyors fogyáshoz Az étrend étkezési tervem