Gangrenous cholecystitis: Néma, de lehetséges halálos betegség diabéteszes neuropathiában szenvedő betegeknél. Esettanulmány
Melorin Mehrzad
Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok
Charles C Jehle
Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok
Lauren O Roussel
Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok
Raman Mehrzad
Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok. moc.liamtoh@1m_namar
Levelezés: Raman Mehrzad, MD, tudományos munkatárs, személyzeti orvos, MD, MHL, Rhode Island Kórház Plasztikai és Rekonstruktív Sebészeti Osztálya, Brown University, 235 Plain St., Providence, RI 02903, Egyesült Államok. moc.liamtoh@1m_namar
Absztrakt
A gangrenous cholecystitis (GC) az akut cholecystitis súlyos és potenciálisan halálos szövődménye. Bemutatunk egy 83 éves urat, akinek korábbi kórtörténetében 2-es típusú cukorbetegség és jelentős kapcsolódó neuropathia szerepel, és egy nagyvárosi közösségi kórháznak mutat be 10 napos hányingert és jóindulatú hasi vizsgálatot. Míg a beteget hiperglikémia miatt vették fel, később súlyos GC-ben állapították meg, amely sürgős műtéti beavatkozást igényelt.
Alap tipp: Bemutatunk egy 83 éves, 2-es típusú diabetes mellitusban és kapcsolódó neuropátiában szenvedő urat, akiről kiderült, hogy súlyos gangrenos cholecystitis (GC) van, amely sürgős műtéti beavatkozást igényel, de a GC egyik központi tünete nélkül.
BEVEZETÉS
A cukorbetegség (DM) egy krónikus betegség, amelyet a hasnyálmirigy vagy az előállított inzulin termelésének hiánya okoz. Ez később megnövekedett glükózkoncentrációhoz vezet a vérben [1]. A DM előfordulása az elmúlt évtizedekben jelentősen megnőtt, és világszerte közel 300 millió ember szenved ebben a betegségben [2]. A DM maga az anyagcsere-rendellenességek specifikus csoportja, amelyek a hiperglikémia közös fenotípusával rendelkeznek. A DM két tág kategóriáját vagy típusát az alapul szolgáló patogén folyamat osztályozza, amely magas vércukorszinthez vezet. Az 1-es típusú DM szinte teljes inzulinhiányt mutat, míg a 2-es típusú DM a patológia bonyolult konstellációja, ideértve az inzulinrezisztenciát, a megnövekedett glükóztermelést és az inzulinszekréció károsodását [3]. A DM fontos szövődményei közé tartozik a szív- és érrendszeri betegségek, agyvérzés, a cukorbetegség retinopathia, a veseelégtelenség és a neuropathia [4].
A gangrenos cholecystitis (GC) az akut cholecystitis súlyos és potenciálisan halálos progressziója, amely az esetek 30% -ában fordul elő [5]. A tartós és súlyos gyulladás végeredménye, ahol az epehólyag olyan jelentősen megnyúl, hogy a fal iszkémiássá válik [6]. A kockázati tényezők közé tartozik a férfi nem, az életkor> 45 év, a cukorbetegség és a szívbetegség kórtörténete [7]. Bár a peritonitis klinikai tünetei néha hiányoznak, ezeknél a betegeknél általában a következő tünetek közül legalább egy vagy több jelentkezik: a jobb felső negyed hasi fájdalma, étvágytalanság, sárgaság és/vagy láz [8]. Ezek a betegek szinte minden esetben átesnek kolecisztektómián, hogy elkerüljék a végzetes szövődményeket [6].
A diabéteszes neuropathia a DM leggyakoribb szövődményei közé tartozik, és klinikailag fontos, mert csökkentheti az életveszélyes tüneteket, például a szívizom ischaemia [9]. Bemutatunk egy 83 éves urat, akit hiperglikémia miatt vettek fel, de később súlyos GC-t találtak nála, anélkül, hogy a hasüreggyulladást vizsgálták volna. Tudomásunk szerint ez a negyedik eset, amikor GC-t jelentettek DM-ben szenvedő betegeknél, akiknek nem specifikus hasi tünetei voltak és megnyugtató fizikai vizsga volt [10-12].
ESETBEMUTATÁS
Egy 83 éves, 20 éves anamnézissel rendelkező 2-es típusú DM, előrehaladott diabéteszes neuropathiában, magas vérnyomásban és hiperlipidémiában szenvedő férfi 10 napig hányinger, hányás és hasmenés miatt panaszkodott főorvosának. Az ellátás helyén végzett glükózmonitor a beteg vércukorszintjét> 600 mg/dl-nél mutatta, és a beteget a társult közösségi kórház sürgősségi osztályára (ED) helyezték át.
A beteg az émelygést és a hányást egy marhahús szendvicsnek tulajdonította, amelyet négy nappal a tünetek előtt evett. Nem volt képes elviselni az ételt, és nagyon korlátozott mennyiségű folyadékfogyasztást jelentett. Ezenkívül a páciens naponta három laza barna bélmozgást állapított meg, durva vér vagy melena nélkül, amelyek a felvétel előtt három nappal megszűntek. A beteg tagadta a hasi fájdalmat, a vérképződést, a mellkasi fájdalmat, a légszomjat vagy bármely más kapcsolódó tünetet. A rendszerek teljes áttekintése egyébként negatív volt.
A betegnek erős családi kórtörténete volt mind az 1., mind a 2. típusú DM-ben, beleértve az édesanyját, két testvérét és más távoli rokonokat. A beteg szociális története jelentős volt havonta 2-3 sör alkalmi alkoholfogyasztása szempontjából. A beteg tagadta a dohányzást és az illegális drogfogyasztást. A beteg otthoni gyógyszerei a Pravastatin 20 mg PO napi, a Glyburide 1,25 mg PO napi, a Lisinopril 10 mg PO napi és az Omeprazole 20 mg PO napi.
Az ED-ben létfontosságú jelei 98,2 F hőmérséklet, 89/perc pulzus, 18/perc légzési sebesség, 147/79 Hgmm vérnyomás és pulzus oximetriával telített oxigéntelítettség 93% volt a szoba levegőjén. A laboratóriumi eredmények szignifikánsak voltak a fehérvérsejtszám (WBC) esetében: 16,5 k/uL, nátrium 132 mmol/l, klorid 93 mmol/l, glükóz 598 mg/dl, AST 49 U/L, alkáli-foszfatáz 196 U/L, albumin 3,1 g/dl, Albumin/Globulin Ratio 0,6 L. Más laboratóriumok a normál határokon belül voltak, és a vizeletvizsgálat negatív volt a ketonok esetében.
A fizikai vizsgálatot a szokásos módon dokumentálták. A beteg éber volt, és személyhez, időhöz és helyhez igazodott. A légzésvizsgálat kétoldalú volt a hallásig. A szív- és érrendszeri vizsgálat rendszeres sebességet és ritmust mutatott ki, zörej, dörzsölés és vágtatás nélkül. A has puha, nem gyengéd, nem feszült, normális bélhangokkal, organomegalia nélkül. A neurológiai vizsgálat ép koponyaidegeket mutatott 2-12, a reflexek 2+ és szimmetrikusak voltak a bicepsznél, a tricepsznél, a térdnél és a bokánál. A flexor, a könnyű tapintás, a tűszúrás, a helyzetérzékelés és a rezgésérzékelés plantáris reakciója károsodott az ujjakban és a lábujjakban, a gyors váltakozó mozgások és a finom ujjmozgások érintetlenek. Az ujj-orr és a sarok-térd sípcsontnál nem volt diszmetria. Nem voltak rendellenes vagy idegen mozgások. Romberg hiányzott. A bőr meleg, száraz volt, nem volt kimutatható kiütés. Az ED-ben történő képalkotás a mellkas egy sima filmjére korlátozódott, amely az atelectasist és a hegesedést mutatta a bal oldali bal alapon, infiltrátumok nélkül.
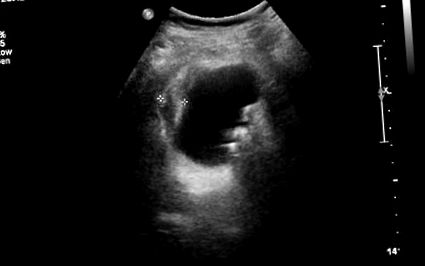
A beteget hiperglikémia kezelésére felvették az általános orvosi osztályra. Kezdetben egyszer 0,2 egység/kg Lantus-t kapott, majd 6 óránként vércukorszint-méréssel csúsztatta az inzulin skálát. A második hasi vizsgálatot a befogadás után néhány órával az emelkedett alkalikus foszfatáz miatt végezték el, anélkül, hogy bármilyen megállapítással rendelkeznének. Ezenkívül hasi ultrahangot hajtottak végre, amely hepatomegalia-t mutatott ki, a máj 18 cm hosszú volt. Míg az ultrahangon nem észleltek máj epeutak elzáródását, epehólyagjának megvastagodott fala volt, pericholecystás folyadékkal és többszörös hiperechoikus kalkulummal (1. ábra). Ezek a megállapítások erősen érintették az akut kolecisztitist.
Ultrahangos kép, amely kifejezett epehólyag falvastagodást és köveket mutat, összhangban az akut kolecisztitissel.
A beteget 6 óránként 3,375 g Piperacillin/Tazobactam adagolásával kezdtük meg. A beteg állapota a kórház második napjára összességében javult. Tagadta az émelygést, a hányást és a hasi fájdalmat. A rendellenes ultrahanggal szemben megnyugtató injekciós üvegeket, vizsgálatot és tüneteket figyelembe véve HIDA-vizsgálatot végeztek, amely szintén akut kolecisztitist sugallt (ábra (2. ábra).
A HIDA képe az epehólyag nem láthatóvá tételét mutatja egy órával a radiotracer injekció után, összhangban a cisztás csatornaelzáródással.
Nem sokkal ezután a betegnek alacsony fokú, 100,4 F-os láza volt, hidegrázással és szigorúsággal. Vérkultúrák készletét kapták, és konzultáltak az általános műtéttel. Javasolták az IV-es antibiotikumok folytatását és a műtétre való felkészülést. Demerolt (Meperidin) és Tylenolt (acetaminofen) adtak hozzá láz és fájdalom esetén.
A beteg ezt követően laparoszkópos kolecisztektómián esett át. A megállapítások szigorúan gangrenos epehólyagra vonatkoztak, bőséges gennyes elvezetéssel az epehólyagból, a subhepatikus tályogból és a kolelithiasisból, és ezt a műtét utáni hisztopatológia is megerősítette. Az eljárás során a beteg hasát bőven öntözték. Perioperatív szövődmények nem voltak.
A következő kórházi napon a beteg jól érezte magát panaszok nélkül, beleértve a hasi fájdalmat, a lázakat, a keménységet és a hidegrázást. A hasi vizsgálat továbbra is jóindulatú volt, és a műtéti seb jól megközelített. A WBC a normál határokig mozog. Az alkalikus foszfatáz csökkenése 196 U/L-ről csökkent, amikor a műtét utáni 127 U/L-be került. A páciens étrendje a rendszeres cukorbeteg diétává vált, amit jól tolerált, később hazaengedték.
Az ebben a páciensben tapasztalt hiperglikémia valószínűleg multifaktoriális volt, a cukorbetegség kezelésében alkalmazott gyógyszerek és étrend krónikus gyengesége, valamint az akut fertőzés miatt. A páciens HbA1c-értéke 10,5% volt ebben a kórházi kezelés során, és endokrinológust konzultáltak, aki inzulin-kezelést indított a páciensnek a mentesítés során, rendszeres nyomon követéssel.
ZÁRÓ DIAGNÓZIS
KEZELÉS
EREDMÉNY ÉS KÖVETÉS
Klinika nyomon követése.
VITA
Ez az eset jól illusztrálja az alapbetegségek azonosításának olykor nehéz jellegét súlyos cukorbetegségben és kapcsolódó szövődményekben szenvedő betegeknél. Ennek a betegnek magas volt az alkalikus foszfatáz-szintje és enyhe leukocitózisa volt hányinger és hányás esetén. Ez további vizsgálatokat indított orvosi képalkotás formájában a jóindulatú hasi vizsgálat ellenére, ami végül gangrenous epehólyaggal járó akut kolecystitis diagnosztizálásához vezetett. Ez csatlakozik három hasonló eset sorához, amelyekről az irodalomban beszámoltak, mindezek DM-vel rendelkeznek [10-12].
Fagan és mtsai [13] azt állították, hogy számos változó, köztük a WBC> 15000, a cukorbetegség kórelőzménye, afroamerikai faj, rendellenes májfunkciós tesztek (emelkedett ALT, AST, ALP, lipázszint) és a pericholecystás folyadék társultak a GC-hez. Egy több tanulmány többváltozós elemzés után azt találta, hogy kolecisztitiszben szenvedő betegeknél a cukorbetegségben és a leukocitózisban szenvedőknél szignifikánsan nagyobb volt a gangrenous epehólyag. Végül Contini és munkatársai [7] arra utaltak, hogy a WBC-szám volt a legerősebb előrejelző a gangréna jelenlétére. A jelek szerint a beteg alátámasztja ezeket a megállapításokat, tekintettel a cukorbetegség, valamint a leukocytosis és a megemelkedett alkalikus foszfatáz szintjére.
Fontos felismerni a GC természettörténetét és életveszélyes szövődményeit. A gangrenos epehólyag szinte mindig perforálódik, és miután gangrenos, a teljes szövődmény mértéke megközelíti a 25% -ot. A perforáció tályogképződéshez és peritonitishez vezethet. Végül a GC halálozási aránya 22% -nak felel meg [7,14]. Ennek megfelelően a korai diagnózis és a műtéti kezelés kritikus fontosságú a súlyos szövődmények, köztük e betegek halálozásának enyhítésében [7,14].
Ennek a betegnek az alattomos jellege oka feltehetően neuropátiája volt. A neuropátia számos következményhez vezet, beleértve az intrabdominális megnyilvánulásokat, például a gyomor motilitásának romlását és a hasi fájdalom megbecsülésének képtelenségét. Bár a cukorbetegek nem teljesen ismertek, az anyagcsere, az érrendszer és a hormonális tényezők összetett változásokat mutatnak be, amelyek mind növelik az idegrost károsodását, mind pedig csökkentik a test képességét ezen idegek helyreállítására [15,16]. Úgy gondolják, hogy az ischaemia okozta idegkárosodás hozzájárul a diabéteszes neuropathia kialakulásához. A diabéteszes neuropátiában szenvedő betegek boncolása során általában megvastagodott endoneuronalis érfalak és érelzáródások találhatók [17]. Ezt támasztja alá az endoneurinalis oxigénfeszültség csökkenése is, amelyet az előrehaladott polyneuropathiában szenvedő betegek surális idegeiben mértek [18].
Úgy gondolják, hogy a károsodott idegsejtek javulása hozzájárul a diabéteszes neuropathiához is [19,20]. Ennek oka részben az idegek fenntartását, helyreállítását és regenerálódását közvetítő neurotróf peptidek csökkenése lehet. Pontosabban, az idegnövekedési faktor, az agyból származó neurotróf faktor, a neurotrofin-3, az inzulinszerű növekedési faktorok és az érrendszeri endothel növekedési faktor mind megállapították, hogy hozzájárulnak az idegek egészségéhez [20]. Ezenkívül maga az inzulin fontos szerepet játszik a perifériás idegsejtek neurotróf faktoraként; és az 1-es típusú cukorbetegségben jelen lévő alacsony inzulinállapot különösen káros lehet az idegek egészségi állapotára [15,21].
Összefoglalva: ez az eset egy életveszélyes műtéti betegség alattomos bemutatását szemlélteti a hiperglikémia orvosi kezelésére felvett páciensnél. A gangrenous epehólyag az akut cholecystitis súlyos szövődménye, amelyet nagyrészt jóindulatú hasi vizsgálat leplezett súlyos diabéteszes neuropathiában szenvedő betegeknél. Ez hasonló a „csendes” akut koszorúér-szindrómában szenvedő diabéteszes betegekhez. Összegzésképpen fontos, hogy azoknál a betegeknél, akiknek kórtörténetében rosszul kontrollált cukorbetegség szerepel, magasabb gyanú indexet kell felvetni a súlyos intraabdominális patológia miatt, még jóindulatú hasi vizsga esetén is.
TAPASZTALATOK ÉS Leckék
A GC az akut cholecystitis súlyos és potenciálisan életveszélyes szövődménye, amely az esetek 30% -ában fordul elő. A GC kockázati tényezői közé tartozik a férfi nem, az életkor> 45 év, a cukorbetegség és a szívbetegség kórtörténete. A GC tünetmentes lehet DM-ben szenvedő betegeknél. A leukocytosisban és/vagy kóros májfunkciós tesztekben szenvedő betegeket, akiknek anamnézisében DM volt, mérlegelni kell a további munka érdekében, tekintet nélkül a tünetekre vagy a fizikai vizsgálatra.
Lábjegyzetek
Tájékozott beleegyezési nyilatkozat: A beteg az aláírt beleegyezést megszerezte és elmentette ehhez az esetjelentéshez a szokásos intézményi beleegyezési dokumentumon keresztül, és az intézmény elmentette. A legfontosabb, hogy az eseten vagy a képeken nincsenek beteg azonosítók. Amerikai intézményekben a beteg orvosi dokumentuma nem nyomtatható ki és adható át másnak. Ez a HIPPA törvénye szerint történik. Megint nincs betegazonosító az egész esetben, így ez a beteg teljesen névtelen.
Összeférhetetlenségi nyilatkozat: Nincs mit közölni.
CARE Checklist (2013) nyilatkozat: A CARE Checklist (2013) irányelveit elfogadták.
Kézirat forrása: Meghívott kézirat
A szakértői értékelés megkezdődött: 2018. szeptember 19
Első döntés: 2018. október 4
Cikk a sajtóban: 2018. november 15
Specialitás típusa: Orvostudomány, kutatás és kísérlet
Származási ország: Egyesült Államok
Peer-review jelentés osztályozása
A osztály (Kiváló): 0
B osztály (nagyon jó): B
P- Ellenőr: Avtanski D, Sahoo J, Saisho Y S- Szerkesztő: Ji FF L- Szerkesztő: A E- Szerkesztő: Wu YXJ
Közreműködői információk
Melorin Mehrzad, Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok.
Charles C Jehle, Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok.
Lauren O Roussel, Plasztikai és Rekonstruktív Sebészeti Osztály, Rhode Island Kórház, Brown Egyetem, Providence, RI 02903, Egyesült Államok.
- A divatos diéták hozzájárulhatnak az úgynevezett májbetegségek kialakulásához; csendes gyilkos; Keck Orvostudományi Kar
- A cukorbetegek térd alatti amputációját követő élettartamot befolyásoló tényezők - ScienceDirect
- A lisztérzékenységben szenvedő betegek életminőségének különböző jellemzői - PubMed
- Kolecisztitisz-betegség útmutató
- A krónikus vesebetegségben szenvedő betegeknek tanácsot kell kapniuk az étrendről, a gyógyszergyártás témájáról