Genetikai tényezők hozzájárulása a vesekárosodáshoz a stroke-ra hajlamos spontán magas vérnyomású patkányokban
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Istituto Neurologico Mediterraneo „Neuromed” (B.G., S.R., R.S., A.L., M.V.), Pozzilli (Is); a Patológiai Szekció, Biokémiai és Biofizikai Tanszék „F. Cedrangolo, ”Nápolyi Második Egyetem (A.B., F.B.), Nápoly, Olaszország; valamint a La Sapienza Egyetem (S. R., M. V.) Patológiai és Kísérleti Orvostudományi Tanszéke, Róma, Olaszország.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
A stroke-ra hajlamos spontán magas vérnyomású patkány (SHRSP) törzs súlyos hipertónia kialakul, és a sérülések gyakoriságát a különböző érágyakban mutatja. Különösen a vese érrendszerében és a parenchyma szövettani elváltozásai figyelhetők meg ebben az állatmodellben, míg a szorosan kapcsolódó patkánytörzsben, a stroke-rezisztens spontán hipertóniás patkányban (SHR), amelyből az SHRSP levezetésre került. 3
Valójában súlyos veseelégtelenséget nem figyelnek állandóan az SHRSP-ben, valószínűleg azért, mert ennek a törzsnek a kialakulása során ez a további tulajdonság az erőnlét elviselhetetlen csökkenését eredményezte volna. 3 Másrészt a korábbi vizsgálatok azt mutatják, hogy a veseelváltozások kialakulása megelőzi az agyi érrendszeri elváltozásokat, és arra utalnak, hogy ebben a modellben részt vesznek a stroke patogenezisében. 2,4 Ez utóbbi szempontból a magas vérnyomásszintet, a renin-angiotenzin rendszer rendellenességeit és a megnövekedett sóbevitelt fontos tényezőként ismerték fel ebben a törzsben az agyi és a vese érrendszeri elváltozások patogenezisében. 2,5 Újabban azonban a veseátültetés elegáns kísérletei rámutattak a genetikai tényezők központi szerepére a vese károsodásának előfordulásában az SHRSP-ben. 6.
A csoportunk által végzett kísérletek korábban megvizsgálták a genetikai tényezők szerepét a 7-es stroke és az endotheliális diszfunkció 8 patogenezisében az SHRSP-ben ezen két tulajdonság genotípus/fenotípus kozegregációs elemzésén keresztül egy SHRSP/SHR F2 keresztezésben. Ebben a keresztezésben az emelkedett vérnyomásszint nem szegregálódik, míg a 7,9 stroke késleltetése és az endotheliális funkció károsodása 8,9 szegregál, valamint a magas sótartalmú és alacsony káliumtartalmú étrendre való hajlam.
A jelenlegi vizsgálat célja a genetikai tényezők potenciális szerepének vizsgálata volt a vese szövettani elváltozások iránti fogékonyságban az SHRSP/SHR F2 intercrossban, nagy polimorf markerek panel használatával a két szülői törzs között. 10.
Mód
Állatok
154 F2-hibrid patkány (79 hím, 75 nőstény) kohorszát vizsgálták az eredeti SHR és SHRSP kolóniákból, amelyeket Japánban hoztak létre 1974-ben 3 intézményünk állatkísérleti irányelveinek megfelelően.
A patkányokat állandó hőmérsékleten tartottuk, 12 órás nappali-éjszakai ciklus mellett, szabad hozzáféréssel a rendszeres chow-hoz és vízhez. 6 hetes korukban a patkányokat átengedték a stroke-ot megengedő étrendre (japán stílusú étrend) (Laboratori Dottori Piccioni), megváltozott nátrium/kálium aránysal, alacsony fehérjetartalommal és 1% NaCl-pótlással az ivóvízben 4 hétig. hétig. Ekkor a szisztolés vérnyomást (SBP) nem invazívan mérték a tudatos visszatartott patkányoknál farok-mandzsetta vérnyomásméréssel (PE-300, Narco Biosystem Inc.). A technika változékonyságának minimalizálása érdekében több (n = 5) mérést végeztek minden patkányon, miután megszokták az eszközt. Annak elkerülése érdekében, hogy a japán étrend több hetes expozíciója után előfordulhat a stroke és a halál kiszámítható megjelenésének zavaró hatása, a patkányokat ebben a szakaszban leölték.
Szövettan és fenotípus meghatározása
1.ábra. Különböző fokú vesekárosodás a stroke-ra hajlamos SHR-ben. A, 0 fokozatú Ematossilin-eozin festés (vese elváltozások hiánya). B, 1. fokozatú Ematossilin-eozin festés, SMC-k ritkítása és az érfal hyalinosisa (pontozott nyíl) parenchymás károsodás jelei nélkül. C, Ematossilin-van Gieson 2. fokozatú hyalinosis és arteriolák nekrózisának festése (pontozott nyilak) fokális másodlagos tubuláris károsodással (csillag). D, Ematossilin-eozin festés az artériák és arteriolák 3. fokozatú kiterjedt nekrózisában a glomerulusok fokális infarktusaival (egyenes nyíl).
1. TÁBLÁZAT Az F2 kohortos vesékben észlelt vaszkuláris és parenchymás elváltozások különböző mértékű
A vese elváltozásainak osztályozását 2 vesepatológus végezte függetlenül. A 2 megfigyelő közötti megegyezés százalékában kifejezve a konkordancia szintje 91% volt (a 154 mintából 140). A fennmaradó példányokban a pontszámokat kollegiális felülvizsgálat és egyetértés után adták.
Genotipizálás és összekapcsolás elemzése
Véletlenszerű marker genom-szűrést végeztünk 274 SSLP-ből álló panel segítségével, amelyről kiderült, hogy polimorf a 2 szülői törzs között. 10 SSLP-t nyertek különböző forrásokból: markerekként azonosított markerek DxMghy, DxMity, és DxRaty a Research Genetics Inc-től származnak; a következőként definiáltak DxWoxy a Wellcome Humángenetikai Intézet munkatársai voltak; és a közzétett szekvenciákból kifejlesztett markerek a GenBank locus nevükkel vannak jelentve (http://www.ncbi.nlm.nih.gov).
Valamennyi markert PCR-rel megvizsgáltuk és 7% poliakrilamid-gélen oldottuk fel, a közzétett protokollok alapján. 7 Összekapcsolási genetikai térképet fejlesztettek ki a MAPMAKER/EXP3.0 számítógépes csomaggal. 11.
Meghatároztuk a genotípus markerek és a vesebetegség mértékét, 4X3 kontingenciatáblázat és χ 2 teszt 6-os csoporttal csoportosítva a szövettani elváltozások súlyos pontszámával rendelkező, 2. és 3. fokozatú szövettani elváltozásokat. df. Kísérletenként a kapcsolódás deklarálásához szükséges 12-es küszöbszintet QTL 13,14 térképész kiszámította az egyes genotípus-markerek 1000 permutációjából az egész populációban, valamint a férfiak és a nők külön-külön a fenotípushoz viszonyítva. Az összekapcsolást akkor jelentettük jelentősnek, ha a marker χ 2 statisztikája nagyobb volt, mint a kritikus érték α = 0,05-nél, és szuggesztív, ha nagyobb, mint a kritikus érték α = 0,10-nél. 15
Statisztikai analízis
Az SBP-t átlag ± SEM-ben fejezzük ki. Az SBP és a vesepatológia mértéke közötti korrelációt Spearman-teszt segítségével kiszámítottuk a ρ együtthatót. A vesebetegség nemi megoszlásának különbségét az F2 kohorszban 2-vel 2-vel teszteltük df.
Eredmények
A diétás kezelés végén az SBP az F2 kohorsz patkányaiban átlagosan 188 ± 2,3 mm Hg volt (hím patkányokban 189 ± 3,6, nőstény patkányokban 187 ± 3,8). Az SBP szintek és a vesekárosodás mértékének korrelációjának elemzése ebben az keresztezésben nem érte el a szignifikancia szintjét (ρ együttható, 0.201; P= NS). Ha a hím és nőstény patkányokat külön elemeztük, egyik csoportban sem találtak összefüggést (ρ együttható, 0,154; P= 0,302, hím patkányok esetében; ρ együttható = 0,222; P= 0,134 nőstény patkányok esetében).
A vese elváltozások gyakoriságát a teljes F2 populációban az 1. táblázat mutatja. A 2. és 3. fokozatú elváltozásokat gyakrabban figyelték meg hímekben, mint nőstény patkányokban (19,7% vs. 9,3%; χ 2 = 7,95, P= 0,01).
A véletlenszerű marker genomszűrést 274 genetikai markerből álló panel segítségével végeztük, amely polimorf a 2 szülői törzs között. Genetikai összekapcsolási térkép készült 7 kcM átlagos intermarker távolsággal a jelenlegi keresztezéshez. Amint a 2. ábra mutatja, 2 terület középpontjában az 1. kromoszóma D1Rat238 jelzője (χ 2 = 13,9) és az inzulinszerű növekedési faktor receptor 4-es protein-kötő 4 (Rbp4g) génben lévő mikroszatellit marker található a 10. kromoszómán (χ 2 = 20,9) szignifikánsan kapcsolódtak a vesekárosodás mértékéhez (2. táblázat) a populáció egészében, az SHR és az SHRSP allélok védő hatást gyakoroltak a D1Rat238 és az Rbp4g lokuszon (kísérleti küszöbszint, χ 2 = 12,1, a = 0,05 esetén. Két további lókusz, nevezetesen a kallikrein (χ 2 = 10,5) az 1. kromoszómán és a névtelen D4Mgh7 (χ 2 = 11) marker a 4. kromoszómán szuggesztív kapcsolatot mutatott a vesebetegséggel, az SHR allél pedig védő hatást fejtett ki (kísérletileg küszöbszint, χ 2 = 10 α = 0,10 esetén). 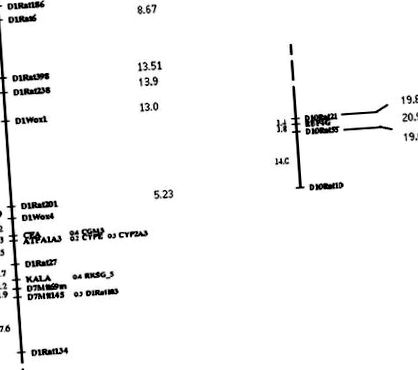
2. ábra. Az 1. (balra) és a 10. (jobbra) kromoszómán található 2 régió összekapcsolódási genetikai térképei, ahol szignifikáns összefüggést találtak a veseelváltozások mértékével. Az egyes kapcsolási térképek jobb oldalán minden egyes markerhez χ 2 értéket adunk.
2. TÁBLÁZAT Jelölő lókuszok, amelyek szignifikáns összefüggést mutatnak a veseér- és parenhimális elváltozások mértékével az F2 populációban egészben, D1 Rat238 és Rbp4g, valamint csak férfiaknál D16Mit2
A hím és nőstény patkányokon végzett összekapcsolási elemzés külön azonosított egy lokuszt a 16. kromoszómán, a D16Mit2-t, ahol az SHRSP allél szignifikánsan társult egy súlyosabb vesebetegséggel (χ 2 = 13,8; kísérleti küszöbszint hím χ 2 = 12,2 esetén, α = 0,05 esetén).
Az SHR és az SHRSP szülőtörzsek szövettani vizsgálata rendkívül szignifikáns különbséget mutatott a veseműködés kialakulásában a stroke-permisszív étrendnek való kitettség során. Részletesen, SHR-ben 4 hét, vagy a japán stílusú étrend hosszabb ideig tartó (> 12 hét) expozíciója után nem találtak kimutatható vaszkuláris vagy parenchimális elváltozásokat a vese szakaszain. Az SHRSP progresszív és markáns vese hisztopatológiai elváltozásokat mutatott a japán stílusú étrend expozíciója alatt. 4 hetes diéta után az SHRSP minimális vagy közepesen súlyos elváltozásokat mutatott (0,5–1. Fokozat), míg 8–12 hét után súlyosabb elváltozásokat figyeltek meg (1. – 3. Fokozat).
Vita
Jelen tanulmányban az ér- és parenhimális vese károsodásának alapjául szolgáló genetikai tényezőket vizsgáltuk az SHRSP-ben, a genetikailag terjedő stroke állatmodelljében, amely szintén nagy érzékenységet mutat a vese elváltozások kialakulása előtt az agyi érrendszeri elváltozások megjelenése előtt. 2 Az SHRSP és a szorosan kapcsolódó patkány SHR 10 törzs közötti polimorf markerekből álló panel kihasználásával, 10 amely nagyon ellenálló az agyi érrendszeri és a vese elváltozások kialakulásával szemben, 1,2,6-ot genotípus/fenotípus kozegregációs vizsgálattal végeztünk. hibrid SHRSP/SHR F2 kohorsz.
Eredményeink azt mutatják, hogy legalább 2 anonim marker, a D1Rat238, az 1-es kromoszómán és az inzulinszerű növekedési faktor receptor-kötő 4-es fehérje (Rbp4g) középpontjában a 10-es kromoszómán található terület szignifikáns összefüggést mutat és ellentétes hatást mutat a vesekárosodás. Különösen a D1Rat238 marker SHR allélja és az Rbp4g lokusz SHRSP allélja mutat védőhatást a súlyos vaszkuláris és parenchymás vesekárosodás kialakulásában. Kísérleti modellünkben a mérsékelt vagy súlyos veseelváltozásokat gyakrabban észlelték hímeknél, mint nőstény patkányoknál. Amikor hím patkányokon és nőstény patkányokon külön összekapcsolódási elemzéseket végeztek, a 16. kromoszómán egy további lókuszt, a D16Mit2-t azonosítottunk, ahol az SHR allél csak hím patkányokban gyakorolt védő hatást a súlyos veseelváltozások kialakulására.
A szérum inzulinszerű növekedési faktor receptor kötő fehérjék krónikus veseelégtelenségben megemelkedtek, és az érintett gyermekek növekedési retardációjának egyik lehetséges mediátoraként javasolták őket. 16 Valójában nagyobb affinitással kötik meg az inzulinszerű növekedési faktort, mint maga a receptor, így potenciálisan csökkentik annak biológiai hatásait. A krónikus urémia kísérleti modelljében az Rbp4g expresszió növekedett a 16 vesében, és gátló hatást mutatott a növekedési porcra. Kísérleti modellünkben az Rbp4g lókuszon található SHRSP allél védőhatást fejt ki a súlyos veseelváltozások kialakulásában. A mutáns gén biológiai aktivitásának specifikus vizsgálata, valamint kongén vonalak létrehozása szükséges annak a hipotézisnek az igazolásához, hogy ebben a kísérleti modellben az Rbp4g jelentheti a vesekárosodás jelölt génjét.
A vesekárosodás kialakulásának genetikai hajlamát különböző patkánymodellekben írták le. A Fawn-Hooded Hypertensive Patkányban, egy olyan patkánytörzsben, amelyben súlyos vesekárosodás alakul ki enyhe magas vérnyomás esetén, az 1. kromoszómán lévő QTL-ről beszámoltak a vérnyomástól független vesekárosodás mértékének meghatározására, 18 és a vesékárosodásokra való nagy hajlam. barna norvég patkányok 1-es kromoszómájának egy szegmensét hordozó SHR-ben figyelték meg a kontrollált mértékű deoxikortikoszteron-acetát-só magas vérnyomásának kiváltását. 19 Újabban 3 QTL-t találtak a megnövekedett vizeletalbumin-kiválasztás magyarázatára a krónikus nephropathia és az enyhe magas vérnyomás modelljének, München Wistar Fromter patkánynak. 20
Ezen QTL-ek egyike sem fedi át az 1. kromoszóma területét, összefüggésben a jelenlegi vizsgálatban azonosított vesekárosodás mértékével. Másrészt ezek az eltérések a genetikai háttér különbségeivel magyarázhatók a vizsgálathoz használt törzsek között és/vagy az egyes kísérleti modellek esetében kapott összekapcsolódási genetikai térképek sűrűségével és végül a célfenotípus meghatározásával. Megjegyzendő, hogy ugyanabban a kísérleti modellben az 1. kromoszómán azonosítottunk egy QTL-t, STR1-t, amely a stroke késleltetéséhez kapcsolódik, 7-et és egy lokuszt, a D1Wox4-et, amely potenciálisan részt vesz az endothelium-függő vazorelaxáció modulációjában. 8 Összességében ezek a megfigyelések arra utalnak, hogy a patkány 1-es kromoszóma több régiója részt vehet az érkárosodás iránti hajlam meghatározásában a különböző érrendszeri ágyakban az SHRSP állatmodellben.
A jelenlegi vizsgálat feltárta a vese sérülés genetikai alapját az SHRSP-ben, célként fenotípusként vaszkuláris és kapcsolódó vese parenchymás elváltozásokat alkalmazva. A vesekárosodás pontszámát korábban SHR és SHRSP hím patkányoknál 2 kaptuk, és a jelenlegi vizsgálatban megismételtük. Noha az SHR patkányoknak 4 hetes étrend után nincs veseműködésük, és valószínűleg nem is lesz veseváltozásuk a japán stílusú étrend hosszabb ideig tartó expozíciója után is, az SHRSP minimális mértékű veseműködést mutatott 4 hetes étrend és a súlyos 2. és 3. fokozatú elváltozások 8 és 12 hetes étrend után, gyakran társítva a stroke kialakulásával. A jelenlegi vizsgálatban az F2 patkányokat csak 4 hét japán étrend után vizsgálták, amikor a stroke és a stroke okozta halálozás előfordulása 1,8% volt az F2 populációban. Ezek a megállapítások magyarázhatják a súlyos 2. és 3. fokozatú veseváltozások alacsony százalékos arányát.
Habár az SBP megemelkedett szintje, valamint a magas sóbevitel elengedhetetlen az agyi érrendszeri és vese elváltozások kialakulásához az SHRSP-ben, 1,2,5,21 genetikai hajlamot ismertek fel a vesekárosodás kialakulására. 6 Valójában az SHRSP vese során átültetett SHRSP vese, magas só bevitel mellett, súlyosabb vesekárosodást szenvedett, mint a natív SHR vese, jelezve, hogy ha ugyanazon vérnyomásszintnek és étrendnek van kitéve, az SHRSP vese természeténél fogva nagyon érzékeny a vesekárosodásra. Ezekkel a megfigyelésekkel összhangban nem találtunk összefüggést az SBP szintje és a vesekárosodás mértéke között a jelenlegi interkrosszban. Az SBP, amely az érrendszeri patofiziológia egyik fő zavaró tényezője, nem különül el az SHRSP/SHR F2 intercrossban. 7–9 Nem zárhatjuk ki azonban, hogy a diasztolés vérnyomás és/vagy az átlagos artériás nyomásértékek, amelyeket a jelenlegi vizsgálatban nem értékeltek, korrelálhatnak a vesekárosodás mértékével.
Összegzésként elmondhatjuk, hogy a jelenlegi eredmények azt mutatják, hogy kísérleti modellünkben több genetikai lokusz is hozzájárul a vesekárosodás kialakulásához. A köztes betegségfenotípusok alapjául szolgáló genetikai tényezők, például az SHRSP-ben a vesebetegség vizsgálata hasznos lehet az érkárosodás iránti fogékonyság alapjául szolgáló genetikai tényezők feldarabolásához és a stroke késleltetésében fennmaradó genetikai variancia teljes magyarázatához ebben a kísérleti modellben. 7 Tekintettel a jelen tanulmányban elemzett célfenotípus diszkrét jellegére, a genetikai tényezők általános hozzájárulására vonatkozóan nem vonhatók le következtetések. 22.
Perspektívák
A veseelváltozások megelőzik a stroke kialakulását az SHRSP-ben, és felvetették, hogy részt vehetnek a stroke patogenezisében, ezáltal potenciális köztes fenotípust képviselnek. A köztes fenotípusokat komplementer fenotípusokként javasolták a gének és a komplex tulajdonságok közötti távolság csökkentésére. Ebben az összefüggésben a vesekárosodás genetikai alapjának boncolása ebben a patkánytörzsben az egyik kísérleti megközelítés lehet a vaszkuláris patológia bonyolultságának megvilágítására ebben a kísérleti modellben, valamint az első lépés a specifikus génfunkció vizsgálatára szelektív SHR vagy SHRSP kromoszóma régiókat hordozó kongén törzsek.
Általánosabb szempontból a hipertónia során a célszerv károsodásának meghatározásában szerepet játszó genetikai tényezők boncolása további betekintést nyerhet a szív- és érrendszeri betegségek természettörténetébe és megelőzésébe, valamint mélyebb ismeretekhez juthat a kardiovaszkuláris homeosztázisban szerepet játszó mechanizmusokról.
- A közös genetikai felépítés és a környezeti kockázati tényezők támasztják alá a szorongásos rendellenességű étkezést
- A genetikai tényezők befolyásolják a köszvény kockázatát, függetlenül az elhízástól és a túlsúly állapottól
- Koronán kívüli lökéshullám-litotripszia a vesemedence-kő kezelésében kórosan
- A nyúl súlycsökkenéséhez hozzájáruló tényezők RabbitsOnline
- Az étrendi betartással járó tényezők a lisztérzékenységben Országos tanulmány - FullText -