A lipid- és lipoprotein-metabolizmus szerepe az alkoholmentes zsírmáj betegségben
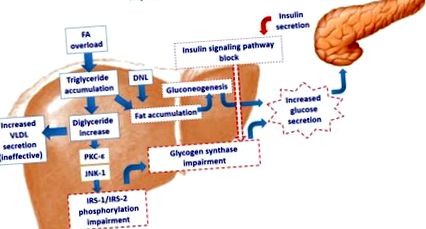
A hepatocita zsírsav-túlterhelése aktiválja a c-epsilon (PKC-e) és/vagy a c-Jun N-terminális kináz (JNK-1) protein kinázt, az inzulinreceptor-szubsztrát (IRS) -1 foszforilációjának későbbi károsodásával. IRS-2. Ez az inzulinjelátviteli út károsodását eredményezi. A csökkent glikogénszintáz inzulinhatás fokozott glükózszekréciót vált ki. Mégis, a zsír felhalmozódása serkenti a neoglukogenezist és tovább növeli a máj glükózszekrécióját. A hepatocita kísérlete a fokozott triglicerid-felhalmozódás megsemmisítésére a fokozott VLDL-szekréció révén hatástalan, és tovább hozzájárul a májzsír felhalmozódásához. DNL: de novo lipogenezis.
A túlzott zsírfelhalmozódás elősegíti a fokozott „de novo lipogenezist” (DNL) és a zsírsav (FA) béta-oxidációt. Ezek a mechanizmusok reaktív oxigénfajok (ROS) keletkezéséhez vezetnek, amelyek oxidatív mitokondriális károsodást és endoplazmatikus retikulum (ER) stresszt váltanak ki. Ezzel párhuzamosan a szabad (nem észterezett) koleszterin és a keramidok felhalmozódása mind a mitokondriális diszfunkciót, mind az ER stresszt fokozza, és a sztellát sejtek, valamint a Kupffer sejtek aktivációját indukálja, elősegítve ezzel a gyulladást és a fibrózist. Ezenkívül a zsírszövetből származó alfa tumor nekrózis faktor alfa (TNFα) és interleukin-6 (IL-6) fokozzák a gyulladásos folyamatot és elősegítik a ceramid felhalmozódását, hozzájárulva az inzulinrezisztenciához különböző utakon keresztül. Végül ezek az események kiváltják a hepatocita apoptotikus utat, ami sejtpusztuláshoz vezet. PKC: protein-kináz; CJNK-IRS: c-Jun N-terminális kináz-inzulin receptor szubsztrát; PP2A: fehérje-foszfatáz 2A.
Absztrakt
A hepatocita zsírsav-túlterhelése aktiválja a c-epsilon (PKC-e) és/vagy a c-Jun N-terminális kináz (JNK-1) protein kinázt, az inzulinreceptor-szubsztrát (IRS) -1 foszforilációjának későbbi károsodásával. IRS-2. Ez az inzulinjelátviteli út károsodását eredményezi. A csökkent glikogénszintáz inzulinhatás fokozott glükózszekréciót vált ki. Mégis, a zsír felhalmozódása serkenti a neoglukogenezist és tovább növeli a máj glükózszekrécióját. A hepatocita kísérlete a fokozott triglicerid-felhalmozódás megsemmisítésére a fokozott VLDL-szekréció révén hatástalan, és tovább hozzájárul a májzsír felhalmozódásához. DNL: de novo lipogenezis.
A túlzott zsírfelhalmozódás elősegíti a fokozott „de novo lipogenezist” (DNL) és a zsírsav (FA) béta-oxidációt. Ezek a mechanizmusok reaktív oxigénfajok (ROS) keletkezéséhez vezetnek, amelyek oxidatív mitokondriális károsodást és endoplazmatikus retikulum (ER) stresszt váltanak ki. Ezzel párhuzamosan a szabad (nem észterezett) koleszterin és a ceramidok felhalmozódása mind a mitokondriális diszfunkciót, mind az ER stresszt fokozza, és a sztellátus sejtek, valamint a Kupffer sejtek aktiválódását indukálja, elősegítve ezzel a gyulladást és a fibrózist. Ezenkívül a zsírszövetből származó alfa tumor nekrózis faktor alfa (TNFa) és interleukin-6 (IL-6) fokozzák a gyulladásos folyamatot és elősegítik a ceramid felhalmozódását, hozzájárulva az inzulinrezisztenciához különböző utakon keresztül. Végül ezek az események kiváltják a hepatocita apoptotikus utat, ami sejtpusztuláshoz vezet. PKC: protein-kináz; CJNK-IRS: c-Jun N-terminális kináz-inzulin receptor szubsztrát; PP2A: fehérje-foszfatáz 2A.
- Gyermekek teljes szövegű gyermekkori zsírmáj és elhízás nem mindig csak alkoholmentesek
- A zsírmáj központi szerepe az elhízott serdülők cukorbetegségének inzulinrezisztenciájának patogenezisében
- A zsírmájbetegség áthallása a lipidfajok között - European Medical Journal
- A lipid- és lipoprotein-anyagcsere zavarai - áttekintés a ScienceDirect témákról
- Zsírmájbetegség központja - NYC ColumbiaDoctors Children s Health