A lipid- és lipoprotein-anyagcsere zavarai
Kapcsolódó kifejezések:
- Lipid
- Fehérje
- Szív-és érrendszeri betegségek
- Koleszterin
- Diszlipidémia
- Myoglobinuria
- A koszorúér-betegség
- Alacsony sűrűségű lipoprotein koleszterin
- Atherosclerosis
Letöltés PDF formátumban
Erről az oldalról
Lipoprotein és lipid anyagcsere
Absztrakt
A lipoprotein és a lipid anyagcsere rendellenességei - diszlipidémiák - az elsődleges biokémiai zavarok alapján osztályozhatók, például alacsony vagy alacsony sűrűségű lipoprotein koleszterin, nagy sűrűségű lipoprotein koleszterin, triglicerid vagy ezek valamilyen kombinációja magas vagy alacsony plazmaszintje alapján. Számos monogén diszlipidémiát, például heterozigóta familiáris hiperkoleszterinémiát határoztak meg molekuláris genetikai szinten. A súlyos szövődmények, különösen a korai szív- és érrendszeri betegségek megelőzése érdekében monogén diszlipidémiák esetén fontos a veszélyeztetett alanyok szűrése. A diagnózis klinikai, biokémiai és genomiális DNS-felmérést igényelhet. A kezelés magában foglalja az étrendet, a testmozgást és a lipidszint-csökkentő gyógyszereket.
Diabéteszes dislipidémia
Absztrakt
Az elhízás, a metabolikus szindróma és a cukorbetegség általában a lipid- és lipoprotein-anyagcsere rendellenességeivel társul. Ezeket a rendellenességeket metabolikus vagy diabéteszes diszlipidémiának nevezik, amelyek elsősorban hipertrigliceridémiából, megnövekedett kis sűrű kis sűrűségű lipoprotein részecskékből és alacsony nagy sűrűségű lipoprotein koleszterinszintekből állnak. Úgy tűnik, hogy a diabéteszes dyslipidaemia mögött álló kulcsmechanizmusok a máj nagyon alacsony sűrűségű lipoproteinek túltermelése az éhgyomri állapotban és a bél chilomicron termelése az étkezés utáni állapotban, ami éhomi és étkezés utáni dyslipidaemiához is vezet. Az aktuális fejezet áttekinti a diabéteszes dyslipidaemia főbb jellemzőit és a metabolikus betegségben a dyslipidaemia ezen egyre gyakoribb formájának kialakulásában szerepet játszó kóros fiziológiai mechanizmusokat.
Metabolomika diszlipidémiában
Hua Chen,. Rui-Chao Lin, a klinikai kémia fejlődésében, 2014
5 Hyperlipidemia
A hiperlipidémia, mint a szívkoszorúér-betegség egyik fő kockázati tényezője, az egyik legfontosabb közegészségügyi probléma [26]. Ezt a lipid anyagcsere rendellenességet a rendellenesen megnövekedett triglicerid (TG), az összkoleszterin (TC), az alacsony sűrűségű lipoprotein koleszterin (LDL-C) és a nagyon alacsony sűrűségű lipoprotein koleszterin (VLDL-C) és a csökkent nagy sűrűségű lipoprotein koleszterin jellemzi. (HDL-C) [27]. A nagy VLDL-C túltermelés ebben a folyamatban alapvető hiba, amely egy sor lipoprotein-változást vált ki, amelyek megnövekedett maradék részecskékhez, kisebb LDL-C-hoz és csökkent HDL-C-hoz vezetnek [28]. Az LDL-C az elsődleges cél a lipidcsökkentő terápiában és a szív- és érrendszeri betegségek megelőzésében. Érdekes módon a hiperlipidémia más kóros állapotokban is szerepet játszhat, ideértve a memóriazavarokat is, és potenciálisan súlyosbíthatja az akut hemorrhagiás nekrotikus hasnyálmirigy-gyulladást [29, 30] .
A keringő TC, TG, HDL-C, LDL-C és lipoprotein (a) jól megalapozott biomarkerek a hiperlipidémia szempontjából [31]. Az anyagcsere alternatív megközelítést kínál e hagyományos repertoár kibővítésére, és potenciálisan azonosítja az új indikátorokat a betegség klinikai megjelenése előtt.
A hiperlipidémia öt típusba sorolható (I, II, III, IV és V) [32]. Egy másik hiperlipidémiás típus, azaz a családi diszlipidémia örökletes. Ez a rendellenesség családos kombinált hiperlipidémiából, családi hiperkoleszterinémiából, családi diszbetalipoproteinémiából, családi lipoprotein lipázhiányból és a lipoprotein anyagcseréjének egyéb genetikai rendellenességeiből áll, az öröklődés sokféle mintája alapján [33]. Az egyszerűség kedvéért a hiperlipidémia a vér lipidjeinek típusa és koncentrációja alapján a hiperkoleszterinémia, a kombinált hiperlipidémia, a hipertrigliceridémia és a HDL hiperlipidémia kategóriába sorolható.
Elsődleges vegyes diszlipidémiák
Meghatározás
Az FDBL széles béta betegségként, xanthoma tuberosumként, maradvány eltávolító betegségként vagy III. Típusú hiperlipoproteinémiaként is ismert a Fredickson klasszikus besorolásában (Fredrickson et al., 1967). Ez egy ritka autoszomális-recesszív öröklődő lipid anyagcsere-rendellenesség, amelyet a megmaradt lipoprotein részecskék (chilomicron maradványok és VLDL maradványok vagy közepes sűrűségű lipoprotein (IDL), más néven β-VLDL) felhalmozódása miatt megemelkedett koleszterin- és triglicerid plazmakoncentrációk jellemeznek. A betegség teljesen kifejlődik felnőttkorban, és gyakoribb a férfiaknál. Az FDBL a korai szívkoszorúér, a perifériás vaszkuláris (intermittáló claudication) és az agyi érrendszeri megbetegedések fokozott kockázatával jár együtt (Carmena és mtsai., 2000; Durrington, 2007b; Stalenhoef, 2011).
A hiperlipidémiák és diszlipidémiák osztályozása
Jesús E. Millán Núñez-Cortes, Joaquín J. Millán Pérez, az Endokrin betegségek enciklopédiája (második kiadás), 2019
Nefrotikus szindróma
Annak ellenére, hogy globális diszlipidémia van, a legjellemzőbb változás a teljes koleszterin és az LDL-C növekedése. Ez elsősorban a fokozott májszintézis és a csökkent plazma clearance konfluencia miatt jelenik meg (Vaziri, 2003). A nefrotikus szindrómában a lipid anyagcsere-rendellenességben szerepet játszó mechanizmusok közül néhány
Az LDL-receptorban szerzett hiány, ennek következtében a koleszterin intracelluláris szintézisének növekedése a HMGCoAR enzim aktivitás növekedése miatt.
A PCSK9 enzim növekedése egy LDL receptor katabolizmussal, ami az emelkedést eredményezi.
A megnövekedett acil-CoA-koleszterin-acil-transzferáz (ACAT-2) májaktivitás katalizálja a szabad koleszterinből származó koleszterin-észterek képződését, ezáltal növeli a koleszterinben gazdag LDL-lipoproteineket.
A proteinuriát kísérő vizeletvesztés a lecitin-koleszterin-acil-transzferázban (LCAT).
Csökken a lipoprotein lipáz (LPL) aktivitása.
A 7-alfa-hidroxiláz enzim és az epesavtermelés csökkenése, koleszterin másodlagos lerakódások felhalmozódása.
Az Lp (a) szintézis növekedése.
A nephrotikus szindrómában a dyslipidaemia plazmatikus profilja ezért nagyon változatos (de Sain-van der Velden et al., 1998):
Hiperkoleszterinémia megnövekedett LDL-C értékkel.
Hipertrigliceridémia megnövekedett VLDL-vel.
A megmaradt lipoproteinek növekedése megnövekedett IDL esetén.
A lipoprotein növekedése (a).
A HDL-C gyakori csökkenése a koleszterin fordított efflux redukciójával.
Kardiovaszkuláris toxikológia
6.16.11 Problémák és buktatók a munkahipotézissel
A „DNS pol-γ hipotézis” (Lewis és Dalakas 1995) egyik problematikus része abban rejlik, hogy a helyettesítő szövetekben az mtDNS-bőség hasznosul a célszövetekben a mitokondriális toxicitás hitelesítésében (Cote et al. 2002). A toxikogenomikára és az antiretrovirális terápiára vonatkozóan rendelkezésre állnak adatok, és néhány elmélet bemutatásra került - különösen a lipodisztrófia és a lipidanyagcsere rendellenességei (Arnedo és mtsai 2007; Tarr és Telenti 2007) és az mtDNS replikációs rendellenességei tekintetében; áttekintve (Tarr és Telenti 2007). Összességében van néhány bizonyíték az NRTI-ket kapó betegek különböző szöveteiben mtDNS-deléciókra (White 2001), például vázizomzatra (Vittecoq és mtsai 2002), de más szövetekben hiányzik, míg néhány tanulmány perifériás vért használt helyettesítő markerként nem észleltek olyan különbségeket, amelyek az mtDNS mutációhoz kapcsolódtak volna (Walker és mtsai 2002). Összességében az mtDNS kimerülésének hipotézise a DNS pol-γ gátlásával kapcsolatban ésszerű; mégis további bizonyítékokra van szükség a klinikai események pontos meghatározásához.
Az elfogadható in vitro diagnosztikai teszt alapvető tulajdonságai
5.1.1.3 A két szabályozási osztály kapcsolata
Az FDA orvostechnikai eszközök adatbázisának áttekintése során úgy tűnik, hogy az eszközök FDA-osztályozása és a bonyolultsági szintek kijelölése nincs összefüggésben, kivéve talán a III. Osztályú IVD-ket, amelyek nagy komplexitású vizsgálatoknak számítanak. Például az azonos indikációjú LDL-C vizsgálati rendszereket, amelyek szerepelnek a jóváhagyási sorrendben vagy a címkén (a lipid- és lipoprotein-anyagcsere-rendellenességek diagnosztizálását és kezelését segítő mérés), az FDA jóváhagyta az I. osztályba tartozó három IVD-szolgáltató számára, de közben, lemondott [15], mérsékelt [16] vagy nagyon összetett [17] besorolású. Érdemes megemlíteni, hogy az első két eszköz ugyanazt az állítmányt, a Roche DL Cholesterol Plus-t használta az 510K jelentős egyenértékűségre vonatkozó beadványokhoz. Egy másik példa: a protrombin idő tesztet II. Osztálynak jelölték, de az eszközöket lemondott [18], mérsékelt [19] vagy nagy komplexitású [20]. Az utolsó két tesztet ugyanarra a vállalatra, a Siemensre hagyták jóvá ugyanazon reagens felhasználásával, ugyanazon az 510K-s beadáson, de a mérsékelt komplexitás automatikus vizsgálat volt, a nagy komplexitás pedig manuális vizsgálat volt.
Izombetegségek
Myoglobinuria
A kezelés célja az izomrombolás (sok esetben pihenés) visszafordítása és a megfelelő vizeletmennyiség fenntartása. A korai, erőteljes folyadék újraélesztés csökkenti a veseelégtelenség előfordulását a mioglobinuria alatt. A mannitot az ozmotikus diurézis elősegítésére és az iszkémiás vese reperfúziója után keletkező szabad oxigéngyökök felszámolására kell beadni. A vizelet nátrium-hidrogén-karbonáttal történő lúgosítása megakadályozhatja a myoglobin-sav hematin kicsapódását a vesetubulusokban, és csökkentheti a veseelégtelenség kockázatát is.
Genomika a koszorúér-betegség kockázatának előrejelzéséhez
Thorsten Kessler,. Heribert Schunkert, Genomic and Precision Medicine (harmadik kiadás), 2018
Bevezetés
Az iszkémiás szívbetegség a vezető halálok a nyugati országokban. Figyelembe véve, hogy az akut miokardiális infarktus és a pangásos szívelégtelenség majdnem elmarad, a koszorúér-érelmeszesedés jelentősége még nyilvánvalóbbá válik.
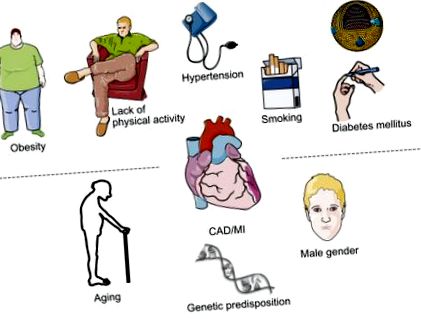
Az érelmeszesedés módosítható kockázati tényezői megkülönböztethetők a nem módosítható kockázati tényezőktől, míg a kockázati tényezőket, például a dohányzást, az artériás hipertóniát és a cukorbetegséget kedvezően befolyásolhatják az életmód módosítása vagy a farmakológiai beavatkozások [1], az életkor és a nem nem módosítható (8.1. Ábra). A lipid anyagcsere-rendellenességek valahogyan sajátosságokat képviselnek, mivel egyrészt módosíthatók a farmakológiai terápiákkal, másrészt gyakran elvileg nem módosítható genetikai alap, például családi hiperkoleszterinémia okozza.
8.1. Ábra Módosítható és nem módosítható kockázati tényezők, amelyek növelik a koszorúér-betegség kockázatát.
A pozitív családtörténet, amely az egyén által hordozott genetikai teher kifejeződése is, egy másik nem módosítható kockázati tényező. Azoknál a személyeknél, akiknek közeli rokona fiatal korban szívizominfarktusban szenved, megnövekedett a koszorúér-betegség (CAD) kockázata, amely a rokonság mértékétől függ (8.2. Ábra). Az elmúlt években a genomra kiterjedő asszociációs vizsgálatok (GWAS) eredményei azt mutatták, hogy ez a genetikai alap messze túlmutat csupán a pozitív családi anamnézisen, és nem redukálható egyetlen érintett génre. Valójában minden egyén, függetlenül a pozitív családtörténettől, nagyszámú genetikai kockázati allélt hordoz. Ezeknek a kockázati alléleknek az összege (vagy interaktív hatása) inkább az ember genetikai kockázatát jelenti.
8.2. Ábra Különböző fokú rokonság hatása a koszorúér-betegség családi kórtörténetében az egyéni kockázatra.
Mayer B, Erdmann J, Schunkert H. után módosítva. A koszorúér-betegség és a miokardiális infarktus genetikája és öröklődése. Clin Res Cardiol. 2007; 96 (1): 1–7 [2] .
A CAD-t okozó genetikai változatok keresése korlátozott számú jelölt génnel kezdődött, majd a technológia fejlődésével az egész genomban folytatott keresésre került. Kezdetben a hagyományos kockázati tényezőket moduláló fehérjéket kódoló gének jelentették a genetikai kockázati tényezők kutatásának fő célpontját, ami a korlátozott technikai lehetőségeknek volt köszönhető. Az ok-okozati részvétel a betegség folyamatában valóban kimutatható volt az alacsony sűrűségű lipoprotein (LDL) koleszterin receptort kódoló géneknél, illetve a lipoprotein (a), az LDLR és az LPA. Sok esetben azonban nem találtak kapcsolatot a genetikai polimorfizmusok és a CAD megnyilvánulása között. A hipotézisektől mentes megközelítés, amely az egész genomban végigváltoztatta a variánsokat, hatékonyabbnak bizonyult. Az emberi genom megfejtésével és az egy nukleotid polimorfizmusok (SNP) annotálásával a koszorúér-betegség kockázatával járó változatok keresése az egész genomban lehetővé vált a GWAS által.
Táplálkozás és táplálék AIDS-betegeknél
Beata Całyniuk,. Małgorzata Muc-Wierzgoń, a HIV-fertőzöttek egészsége, 2015
9.2 Táplálkozás és ART
Az elmúlt évtizedben jelentős előrelépés történt az ART gyógyszerek kifejlesztésében, amelyeket kombinációban használnak a HIV vírus replikációjának csökkentésére és a HIV-fertőzöttek kezelésére. Ezen gyógyszerek miatt sok HIV-fertőzött személy képes kimutathatatlan szintre csökkenteni a vírus szintjét a véráramban. Az antiretrovirális kezelés azért fontos az AIDS-betegek életében, mert egész életük során, akár néhány évtizedig folytatni kell.
A jelenleg ajánlott kombinált antiretrovirális terápia (cART) az antiretrovirális gyógyszerek hat csoportján alapul. Különböző káros hatások kockázata áll fenn. A következő hatásokat figyelik meg fertőzött betegeknél: anyagcsere-változások, például emelkedett triglicerid-, teljes koleszterin- és LDL-szint; HDL-koncentráció csökkenése; szövetek inzulinrezisztenciája és glükóz tolerancia rendellenességek; emelkedett laktátszint; osteopenia és osteoporosis; szív-és érrendszeri betegségek; hematológiai rendellenességek; gyomor tünetei; nephropathiák; és bőrelváltozások. A betegek kb. 40% -ánál a terápia után 3–12 hónapon belül lipodystrophiát vagy lipid-anyagcsere-rendellenességeket észlelnek. A szénhidrát anyagcserezavarai a betegek körülbelül 60% -át érintik [80]. A nephropathiák mind a HIV-fertőzéssel, mind az antiretrovirális gyógyszerek nefrotoxikus hatásával társulnak [81]. Az ilyen rendellenességek kialakulását megfelelő étrend késleltetheti.
A gyógyszerek közötti kölcsönhatások miatt a hipolipidémiás szerek - a sztatinok - használata korlátozott a myopathia valószínűségének növekedése miatt. Ebben az összefüggésben az ellenőrzött zsírbevitelű étrend jelentősvé válik a támogató kezelésben [80,82] .
A proteáz inhibitorok és a protonpumpa és a H2 receptor gátlók közötti kedvezőtlen interakciók (például az atazanavir csökkent felszívódása) korlátozzák ezek használatát a gyomor rendellenességeiben [81,82]. A gyomornedv savasságát csökkentő étrend klinikailag jelentős. Sőt, az ART során ajánlott megszüntetni az alkoholt. A kis mennyiségű alkohol rendszeres fogyasztása függőséghez vezet és reagál a gyógyszerekkel [80]. Ezenkívül a citrusfélék, különösen a grapefruit és az összes grapefruit-tartalmú termék ellenjavallt, mert a citokróm P450 3A4 enzim blokkolásával rontják az antiretrovirális gyógyszerek hatásmechanizmusát.
A terápia megkezdése előtt minden beteget megkérdezünk, teljes fizikális vizsgálatot végezünk, alapos táplálkozási értékelést végezünk, kiértékeljük a bélműködést, és kiszámoljuk a napi kalória- és fehérjeszükségletet. A megfelelő orális, enterális és parenterális étrend kiválasztása döntő fontosságú e betegek sikeres kezelésében. Mivel az ART-t használó minden AIDS-es beteg táplálkozási igénye, étrend-toleranciája és a bélműködési zavar mértéke különbözik, nincs egyetlen táplálkozási terápia, amely alkalmazható lenne ezeknek a betegeknek a kezelésében. Ezért az ART-t alkalmazó AIDS-betegek kezelésében speciális, individualizált orális étrendeket ajánlunk étrend-kiegészítőkkel, valamint enterális és parenterális diétákkal [78]. .
Mindenesetre az egyéneknek be kell tartaniuk azokat az étrendi ajánlásokat, amelyek a terápiához kapcsolódnak, és racionális, egészséges étrendet fogyasztanak a felesleges kalóriák, cukrok és állati zsírok nélkül, valamint zöldségekben és fehérjékben gazdagok. Az étrendet napi négy-hat étkezés formájában kell fogyasztani.
- Rágógumi - áttekintés a ScienceDirect témákról
- Funkcionális ital - áttekintés a ScienceDirect témákról
- Bőr vasculitis - áttekintés a ScienceDirect témákról
- Diétás bevitel - áttekintés a ScienceDirect témákról
- Funkcionális emésztőrendszeri rendellenességek - áttekintés a ScienceDirect témákról