Gyulladás és oxidatív stressz elhízott állapotban és a gallinsav védőhatásai
Phiwayinkosi V. Dludla
1 Élet- és környezettudományi tanszék, Marche Műszaki Egyetem, 60131 Ancona, Olaszország; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
2 Orvosbiológiai Kutatási és Innovációs Platform, Dél-afrikai Orvosi Kutatási Tanács, Tygerberg 7505, Dél-Afrika; [email protected] (B.J.); [email protected] (J. L.); [email protected] (S.E.M.-M.)
Bongani B. Nkambule
3 Laboratóriumi Orvostudományi és Orvostudományi Iskola, Egészségtudományi Főiskola, KwaZulu-Natali Egyetem, Durban 4000, Dél-Afrika; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Babalwa Jack
2 Orvosbiológiai Kutatási és Innovációs Platform, Dél-afrikai Orvosi Kutatási Tanács, Tygerberg 7505, Dél-Afrika; [email protected] (B.J.); [email protected] (J. L.); [email protected] (S.E.M.-M.)
Zibusiso Mkandla
3 Laboratóriumi Orvostudományi és Orvostudományi Iskola, Egészségtudományi Főiskola, KwaZulu-Natali Egyetem, Durban 4000, Dél-Afrika; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Tinashe Mutize
3 Laboratóriumi Orvostudományi és Orvostudományi Iskola, Egészségtudományi Főiskola, KwaZulu-Natali Egyetem, Durban 4000, Dél-Afrika; az.ca.nzku@belubmakn (B.B.N.); az.ca.nzku.uts@621360712 (Z.M.); az.ca.nzku.uts@911360712 (T.M.)
Sonia Silvestri
1 Élet- és környezettudományi tanszék, Marche Műszaki Egyetem, 60131 Ancona, Olaszország; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Patrick Orlando
1 Élet- és környezettudományi tanszék, Marche Műszaki Egyetem, 60131 Ancona, Olaszország; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Luca Tiano
1 Élet- és környezettudományi tanszék, Marche Műszaki Egyetem, 60131 Ancona, Olaszország; [email protected] (S.S.); [email protected] (P.O.); [email protected] (L.T.)
Johan Louw
2 Orvosbiológiai Kutatási és Innovációs Platform, Dél-afrikai Orvosi Kutatási Tanács, Tygerberg 7505, Dél-Afrika; [email protected] (B.J.); [email protected] (J. L.); [email protected] (S.E.M.-M.)
4 Biokémiai és Mikrobiológiai Tanszék, Zululandi Egyetem, KwaDlangezwa 3886, Dél-Afrika
Sithandiwe E. Mazibuko-Mbeje
2 Orvosbiológiai Kutatási és Innovációs Platform, Dél-afrikai Orvosi Kutatási Tanács, Tygerberg 7505, Dél-Afrika; [email protected] (B.J.); [email protected] (J. L.); [email protected] (S.E.M.-M.)
5 Orvosi élettani osztály, Egészségtudományi Kar, Stellenbosch Egyetem, Tygerberg 7505, Dél-Afrika
Absztrakt
1. Bemutatkozás
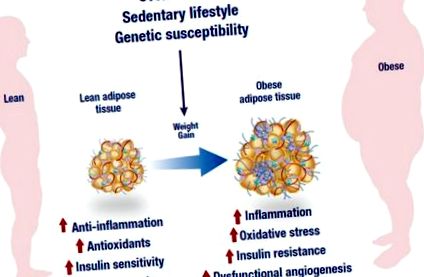
A túl táplálkozás, a mozgásszegény életmód és a genetikai fogékonyság az elhízás kialakulásának fő tényezői. A diszfunkcionális angiogenezis mellett az elhízott állapotot abnormális gyulladásos reakció, alacsony antioxidáns kapacitás és csökkent inzulinérzékenység jellemzi, amely végül gyulladás, oxidatív stressz és inzulinrezisztencia kialakulásához vezethet. Az ábrát a következő webhelyen módosították: https://mexicobariatriccenter.com/improve-adipose-tissue-function/.
2. Gyulladás és inzulinrezisztencia a zsírszövetben
Az elhízott állapot diszfunkcionális lipid-anyagcseréhez kapcsolódik, beleértve a túlzott lipolízist, ami viszont a szabad zsírsavak (FFA-k) termelésének és szekréciójának fokozódásához vezet. A megnövekedett FFA-szint kóros gyulladásgátló választ és később inzulinrezisztencia kialakulást okozhat. Míg a zsírszövet kimerült sejten belüli antioxidáns rendszerei, főként a reaktív oxigénfajok (ROS) megnövekedett termelése miatt, oxidatív stresszt generálhatnak, és ez tovább vezethet az inzulinrezisztencia kialakulásához. NADPH, nikotinamid-adenin-dinukleotid-foszfát.
A zsírszövetbe történő makrofág infiltráció beindíthatja a krónikus immunaktivációt is, ami metabolikus diszregulációhoz és a szív- és érrendszeri betegségek fokozott kockázatához vezethet [42,43]. Úgy gondolják, hogy akár több, akár a zsírszövetben, akár a zsírszövetben lévő endoteliális sejtekből származó tényező indítja el a makrofágok toborzását a zsírszövetbe. Ez egyes immunsejtek, például a neutrofilek és a T-sejtek behatolásához vezet, amely ezt követően hipoxiát és adipocita sejtek pusztulását idézi elő [38]. Az immunsejt-toborzás sorrendje továbbra sem tisztázott, azonban az elhízás során a makrofágok a visceralis és a szubkután zsírszövetben jelenlévő leukocita populáció több mint felét képviselik [30]. Egyes tanulmányok közvetlen összefüggést mutattak ki a zsigeri fehér zsírszövetben található megemelkedett makrofágok és a megnövekedett testtömegindex között [44]. Az étrend által kiváltott elhízás állatmodelljeiben a makrofágok az összes zsírszövet-sejt körülbelül 50% -át teszik ki [30], míg sovány egereknél és embereknél a zsírszöveti sejtek csak 5% -ot tesznek ki a makrofágokból [30]. Valójában a makrofágok beszivárgásának gátlása az 1 monocita kemoattraktáns (MCP-1) blokkolásával enyhíti az inzulinrezisztenciát [45].
Kimutatták, hogy az adipokinek, mint például az adiponektin, gátolják a makrofág funkciót [46,47], és a leptinről kimutatták, hogy a T-limfocita aktiváció és proliferáció előidézésével elősegíti a gyulladást [48]. A lipolízis termékei, például az FFA-k aktiválják a T-limfocitákat, ami megnövekedett zsírtömeget és zsírszöveti gyulladást eredményez. Érdekes módon a T-helper sejt 17 (TH17) citokinszintje gyulladással függ össze a T2D-vel élő elhízott embereknél [49]. A másik oldalon azt tapasztalták, hogy a hiperglikémia a perifériás vérben monociták által expresszált transzmembránreceptor, a monocita sejtfelszín CD33 down-regulációjával indukálja a TNF-α termelését [50]. A CD33 kulcsfontosságú szerepet játszik a citokintermelés gátlásában, és a monocitákban és limfocitákban a CD33 expressziójának csökkenése a gyulladásos citokinek, például a TNF-a és az IL-1 fokozott termelésével jár [50,51]. A TH17 limfociták szekretálják az IL-17-et, amely kiváltja az aktivált B-sejtek magfaktor kappa-könnyűlánc-fokozóját (NF-κB), ami a B-limfociták aktivációjához vezet [52].
3. Oxidatív stressz a zsírszövetben
4. A gallinsav osztályozásának, előfordulásának és biohasznosulásának rövid áttekintése
A gallinsav (PubChem CID: 370) egy 3,4,5-trihidroxi-benzoesav C7H6O5 (MW 170,12 g/mol) molekula képlettel, amely bőségesen megtalálható epemogyoróban, szumacban, boszorkánymogyoróban, tealevelekben, tölgyfakéregben és egyéb növények [77]. A gallinsav a természetben előforduló vegyületek elkülönített csoportjába tartozik, amelyeket fenolsavaknak neveznek, és hagyományosan csersav hidrolízisével állítják elő. Ez a vegyületosztály egyedülállóan tartalmaz egy fenolgyűrűt, amely rendelkezik legalább egy karbonsav funkcióval (3. ábra). A fenolsavakat általában hét szénatomot tartalmazó benzoesavakba (C6-C1) és kilenc szénatomot tartalmazó fahéjsavakba (C6-C3) sorolják [12]. A gallussav túlnyomórészt hidroxi-benzoesavaként létezik [77,78], és észterek és sók különböző formáiban fordul elő, beleértve az epigallokatechin-gallátot (PubChem CID: 65064) [79], etil-gallátot (PubChem CID: 13250) [80], gallokatechint gallát (PubChem CID: 199472) [81], metil-gallát (PubChem CID: 7428) [82], propil-gallát (PubChem CID: 4947) [83], theaflavin-3-gallát (PubChem CID: 169167) [84] és mások (3. ábra).
- A magnéziumhiány és az oxidatív stressz frissítés
- Huminsav felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- Hogyan befolyásolja a stressz a fogyást - HealthifyMe Blog
- Hogyan befolyásolja a stressz a zsírvesztést; Laura Schoenfeld
- Hogyan szabotálja a stressz az izomépítést és a fogyás céljait