Hyperammonemia
A hiperammonémia körülbelül háromszorosára növeli az asztrocita glutaminkészletet, és ennek következtében az agy metabolitjaiba beépített jelölés mennyisége arányosan magasabb.
Kapcsolódó kifejezések:
- Aminosav
- Hipoglikémia
- Ammónium
- Karbamid ciklus rendellenesség
- Enzim
- Fehérje
- Mutáció
- Karbamid ciklus
- Agybetegség
Letöltés PDF formátumban
Erről az oldalról
Hyperammonemia
KLINIKAI ELŐADÁS
A hiperammonémiával társuló tünetek elsősorban az ammónia neurotoxicitását tükrözik; ezért meg kell fontolni a hyperammonemiát azoknál a betegeknél, akiknek megmagyarázhatatlan változása van a mentális állapotban, encephalopathiában vagy a megnövekedett koponyaűri nyomás jeleiben (131-1. táblázat). Újszülötteknél a hyperammonemia tüneteit lehetetlen megkülönböztetni a szepszis tüneteitől; ezek közé tartozik a csökkent aktivitás, a rossz táplálkozás, az encephalopathia és a rohamok. Fontos megkülönböztető jellemző, hogy a hiperammonémiában szenvedő újszülötteknél légzőszervi alkalózis alakulhat ki (átlagos pH 7,5, Pco2 értéke 24), mivel az ammónia stimulálja a hiperventilációt. 2 Ezenkívül ezek a gyermekek általában nem tudnak javulni a folyadék újraélesztése és az antimikrobiális terápia után; ehelyett a neurológiai tünetek előrehaladhatnak, és kómába torkollhatnak. Ilyen esetekben erősen gyanítható az UCD. Idősebb gyermekeknél a hyperammonaemia még nehezebben azonosítható, mert a tünetek vagy nem specifikusak (ciklikus hányás, fejfájás, rossz étvágy), vagy könnyen összekeverhetők olyan gyakoribb problémákkal, mint a kábítószerrel való visszaélés vagy az elsődleges pszichiátriai betegség (akut mentális állapotváltozások, őszinte pszichózis).
Az UCD-vel rendelkező újszülötteknél a hiperammonémia jellemzően egy nem figyelemre méltó terhességi újszülött bemutatása, aki jól van az élet első napjaiban. A progresszív fehérjebevitel azonban nitrogén-egyensúlyhiányhoz és hyperammonemiához vezet, általában az élet első hetében. Az ornitin-transzkarbamoiláz (OTC) hiányban szenvedő 74 csecsemő retrospektív elemzése, a leggyakoribb UCD, a betegség átlagosan 63 órás kezdetét mutatta, 12 és 240 óra közötti tartományban. 2
Az UCD-k többségében szenvedő gyermekek életében fennáll a hyperammonemiás epizódok kockázata, amelyek általában akkor fordulnak elő, ha új nitrogén-egyensúlyhiány lép fel. Ennek oka lehet a megnövekedett étkezési fehérjebevitel vagy a katabolikus stressz okozta izomfehérje-forgalom, amely hosszan tartó koplalás, láz vagy fokozott testmozgás során jelentkezik. A vér ammóniaszintje gyorsan növekedhet ezekben az időszakokban, és kritikus fontosságú az azonnali kezelés. Hasonlóképpen, az UCD-k enyhe formájú gyermekei nem szenvedhetnek kezdeti hiperammonémiás válságot, amíg a csecsemőkorban, vagy még később gyermekkorban vagy serdülőkorban bekövetkező betegségig nem szenvednek, amikor a nitrogén-egyensúlyhiány akut mentális állapotváltozásokat vagy a hyperammonemia egyéb jeleit okozza. Ilyen betegeknél az alapos anamnézis felfedheti az egyensúlyhiány okát, például az étrendi fehérjebevitel hirtelen növekedését vagy a testmozgás drámai növekedését.
Az anyagcsere veleszületett hibái
1.6.1.4 Vér ammóniaszintje
A hiperammonémia életveszélyes állapot, ezért a beavatkozáshoz gyorsan kell fordulni. A hiperammonémiát általában a szellőzés stimulálásából eredő légzőszervi alkalózis kíséri. A plazma ammónia szintjét mindig meg kell vizsgálni olyan betegeknél, akiknél megmagyarázhatatlan hányás, letargia vagy bármilyen típusú encephalopathia van [28]. .
Az ammónia koncentrációja az emberi plazmában mikromoláris, és változó a vénás, artériás vagy kapilláris vérben, valamint az időtől, kortól, vizsgálati módszertől és a mintavétel módjától függően (7. táblázat). A plazma ammónia szintjét egy heparinizált vérminta határozza meg, amelyet jégen kell a laboratóriumba szállítani [29]. .
7. táblázat Normális vér ammóniaszint korcsoportok szerint
| 50–159 | 85–271 |
| 24–48 | 41–82 |
| 11–48 | 19–82 |
| 15–55 | 26–94 |
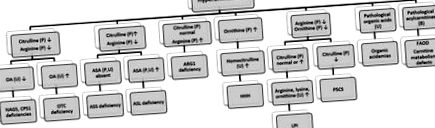
A hiperammonémia általában az UCD-k tüneti tünete, és olyan szerves acidémiákban is megfigyelhető, mint például a propionsav-acidémia, a metilmalon-acidémia, az izovalerinsav és a többszörös karboxiláz-hiány. Az újszülött átmeneti hiperamonémiája olyan állapot, amely általában tüdőbetegségben szenvedő nagy koraszülötteknél (36. terhességi kor körül), súlyos hyperammonemiát okoz. Az újszülöttnél gyakori az enyhe és átmeneti hiperammonémia, a normálérték kétszerese, különösen a koraszülöttnél, amely általában tünetmentes. A hyperammonemia differenciális megközelítését a 7. ábra mutatja [28–30] .
7. ábra A hyperammonemia differenciáldiagnózisa IEM esetén. OA: orotsav, ASA: argininoszukcinsav, ASS: argininoszukcinát-szintetáz, ASL: argininoszukcinát-liáz, ARG: argináz, LPI: lizinur fehérje-intolerancia, HHH: hiperammonémia-hiperornithinémia-homocitrullinuria-szindróma, P5CS: piroxin-szintoxi-oxi-oxi-oxi-oxi-szintoxi-szintoxi-szintoxi-szintoxi-acetát ornitin-transzkarbamiláz, CPS: karbamil-foszfát-szintetáz, NAGS: N-acetil-glutamát-szintetáz, FAOD: zsírsav-oxidációs hibák.
Karbamidciklus és a hyperammonemia egyéb rendellenességei
Absztrakt
A hyperammonemia, amelyet a vér ammóniafeleslege jellemez, életveszélyes állapot lehet. A klinikai tünetek nem specifikusak, és magukban foglalják a rossz táplálkozást, a letargiát, az ingerlékenységet, a tachypnea-t, a görcsrohamokat, az obtundációt és a légzési elégtelenséget. A hiperammonémia oka az ammónia méregtelenítésének vagy túltermelésének hiánya. A karbamidciklus hibái a legsúlyosabb hyperammonemiához vezetnek. A hyperammonemia egyéb okai közé tartoznak a különféle anyagcsere-hibák, mint például bizonyos szerves aciduriák, zsírsav-oxidációs hibák, gyógyszerek és májbetegségek. A hyperammonemia diagnosztizálásának legfontosabb diagnosztikai tesztje a plazma ammónia mérése. Különböző biomarkereket használnak a hiperamonia differenciáldiagnózisához. Ezek közé tartoznak a plazma és a vizelet aminosav profiljai, a vizelet szerves sav profiljai és a plazma acilkarnitin profiljai. Az akut hyperammonia kezelése magában foglalja a fehérje bevitelének leállítását, valamint a nitrogén eltávolító és glükóz kezelését. Az arginint minden karbamid ciklushibában adják be, kivéve az argináz hiányt. A betegség utáni biomarkerek közé tartozik a plazma ammónia szintje, specifikus aminosavak és vizelet orotinsav. Mivel a betegek alacsony fehérjetartalmú étrendet folytatnak, a táplálékhiány markereit is figyelemmel kísérik.
Parenterális táplálás
Ammónium
Hyperammonemia fordult elő a parenterális táplálás során a veseelégtelenség terápiájának részeként [23]. A hyperammonemia a mentális állapot változásaként jelentkezett, amely körülbelül 3 héttel a parenterális táplálkozási kezelés megkezdése után alakult ki; a legtöbb esetben az epizódok egyre hosszabb időtartamúak és paroxizmálisak. Három beteg közül az akut fázisban végzett szérum aminosav-analízis az ornitin és a citrullin (a karbamil-foszfáttal történő kondenzáció megfelelő szubsztrátja és terméke a karbamid ciklusba való belépéskor) csökkent koncentrációját mutatta. Az ornitin előfutárának, az argininnek a koncentrációját megemeltük.
Ammónia anyagcseréje és hiperammonémiás rendellenességek
15 Vegyes okok
A HA hipovolémiás sokkban és pangásos szívelégtelenségben fordul elő. A hipoxiás izmok fokozott ammónia-felszabadulása és a pericentralis hepatocyták elvesztése, és ezáltal a védő GS-aktivitás hozzájárul. A veleszületett portoszisztémás sönt ritka ok [1273]. A szöveti hypoxia/ischaemia, a máj éretlensége és a portrendszeri tolatás a ductus venosuson keresztül mind az újszülött átmeneti HA-jának javasolt okai, ami egy ritka, megmagyarázhatatlan rendellenesség, amely általában a koraszülötteket érinti légzési nehézségekben és acidózisban. A plazma ammónia gyorsan emelkedik nagyon magas szintekre (gyakran 1500 μmol/L fölé), és az élet 2-3 napján akut encephalopathia alakul ki. A plazma glutamin, alanin és citrullin mérsékelten emelkedik, a májfunkciós tesztek nem figyelemre méltók és a karbamidciklus enzimek normálisak. A plazma ammónia korai agresszív kezeléssel gyorsan leesik, és a HA nem újul meg. A túlélők normális fehérjetoleranciával rendelkeznek [274] .
Az ammóniatermelést fokozza a túlzott aminosav katabolizmus, például súlyos testmozgás, görcsrohamok, trauma vagy égési sérülések, szteroid beadás, kemoterápia, gyomor-bél vérzés, gyengén táplált betegek magas fehérjetartalmú pótlása, argininhiány és hólyag, méh vagy ízület glicinoldattal történő öntözés a műtét során. Ez tüneti HA-t válthat ki azoknál, akik már más okok miatt veszélyben vannak [285–287]. Az intenzív testmozgás egy másik ok [40]. Végül hyperammonemiás kómáról számoltak be súlyos pajzsmirigy alulműködésben és egyidejűleg fennálló májbetegségben szenvedő betegeknél, de a máj dekompenzációjának egyéb bizonyítékai nélkül. Úgy tűnik, ez nagyon ritka. A tünetek a pajzsmirigy-helyettesítő terápiával megszűntek. A mechanizmus ismeretlen [288,289] .
A szénhidrát, az ammónia, az aminosav és a szerves sav anyagcseréjének veleszületett hibái
J. Lawrence Merritt II, Renata C. Gallagher, az Avery újszülött betegségeiben (tizedik kiadás), 2018
Az újszülött átmeneti hiperammonémiája
A THAN leggyakrabban olyan koraszülötteknél jelentkezik, akiknek terhességi kora 36 évnél fiatalabb, és születési súlyuk kevesebb, mint 2,5 kg. Jellemzően légzési distressz szindróma után következik be az élet első 24 órájában, és a kóma az élet első 48 órájában alakul ki (Ballard et al., 1978). A szérum ammónia szintje meghaladhatja az 1500 µmol/L értéket, és a csecsemőknek hemodialízisre és fehérje korlátozásra lehet szükségük (Stojanovic et al., 2010).
Ennek a betegségnek az oka ismeretlen, bár egyes esetekben a szabadalmi ductus venosus okozhatja. A portális véna Doppler-ultrahangját el kell végezni a portális véna alvadásának megállapításához. A plazma aminosav szintje megemelheti a citrullin és az arginin szintjét. A glutamin/ammónia arány megkülönböztetheti ezt a karbamid ciklus hibájától (glutamin: ammónia arány Stojanovic et al., 2010). A halálozási arány THAN-ban a koma időtartamához kapcsolódik; az eredmény jó lehet a túlélő csecsemőknél, és hosszú távú kezelésre és fehérje korlátozásra nincs szükség.
Folyamatos vesepótló terápia gyermekgyógyászati betegeknél
David T. Selewski MD, MS, Patrick D. Brophy MD, MHCDS, a Dialízis terápiájának kézikönyve (Ötödik kiadás), 2017
Az anyagcsere veleszületett hibái
A hyperammonemia valódi sürgősséget jelent, és gyors kezelést igényel. A CRRT alkalmazása az anyagcsere veleszületett hibáinak (például karbamidciklus-hibák) kezelésére szokásos gyakorlat. Hiperammonémiában szenvedő gyermekeknél a kezelési protokollok klasszikus módon szakaszos hemodialízissel kezdődtek, majd áttéréssel a CRRT-re, hogy megakadályozzák az intermittáló HD-vel kapcsolatos szokásos visszapattanást. Újabban a modern CRRT eszközök alkalmazásával olyan kezelési protokollokat fejlesztettek ki, amelyekben CRRT-t alkalmaztak 8 L/h/1,73 m 2 dózisban, kezdeti hemodialízis nélkül. Ez a kezelés előnyös lehet azáltal, hogy elkerüli a hipotenziót, amely a kritikus beteg újszülöttek hemodialízisével társulhat. Ha metabolikus koktélra, például nátrium-benzoátra van szükség, akkor szükség lehet az adag növelésére annak érdekében, hogy megfeleljen ezeknek a koktéloknak a CRRT-vel megnövekedett clearance-e. Általában azt tapasztaltuk, hogy az infúzió sebességének megduplázása megfelelő, és konzultációt kell folytatnia gyógyszerészekkel és genetikusokkal.
Anyagcserezavarok
Az újszülött átmeneti hiperammonémiája (NEM)
Átmeneti tüneti hyperammonemia fordulhat elő a 34-36 hetes terhesség alatt született újszülötteknél. A klinikai jellemzők a légzési distressz és a letargia, amelyek a születést követő 4 napon belül rohamokká és kómává válnak. Gyakori a pupilla kitágulása.
A kezdeti plazma-ammónia koncentrációja 800-3400 μg/dl, de akár 7600 μg/dL-t is elérhet. A karbamid-ciklus enzimjeinek hiánya nem mutatható ki. Noha a hyperammonemia oka nem határozható meg, az érintett újszülöttek gyorsan és teljesen reagálnak a transzfúzióra vagy a dialízisre. A túlélőknek később normális neurológiai és fejlődési kiértékelésük van, és nem tapasztalnak visszatérő hyperammonemia epizódokat. Ez a tüneti hyperammonemia a fiziológiás, tünetmentes hyperammonemia túlzás lehet, amelyet a koraszülések több mint 50% -ában észlelnek, és amely nem igényel kezelést.
Karbamid ciklus: A betegség szempontjai
Diagnózis
A hiperammonémia általános a karbamidciklus minden rendellenességében. Sajnos az ammónia mérése nehéz lehet, ha gyakran megemlítik a hamis emelkedéseket. A vért szabadon áramló forrásból (általában vénából) kell beszerezni, és gyorsan lehűteni, hogy elkerülhető legyen a vérsejtekből történő mesterséges termelés. Minden klinikai laboratóriumnak meg kell határoznia a vér ammónia normális értékét; valamilyen variáció gyakori. Gyermekeknél és felnőtteknél a plazma ammónia koncentrációja általában kevesebb, mint 35 μmol l −1. Egészséges újszülöttek vérkoncentrációja gyakran akár 100 μmol l-1 lehet teljes idejű csecsemőben és 150 μmol l -1 koraszülöttnél. A beteg csecsemő ammónia-koncentrációja a plazmában általában meghaladja a 200 μmol l-1 értéket .
2. ábra . Klinikai megközelítés egy tüneti hiperammonémiában szenvedő újszülöttnél.
- Liraglutid - áttekintés a ScienceDirect témákról
- Magas fruktóz tartalmú étrend - áttekintés a ScienceDirect témákról
- Magas fruktóztartalmú kukoricaszirup - áttekintés a ScienceDirect témákról
- Limfoid hiperplázia - áttekintés a ScienceDirect témákról
- Mallory Body - áttekintés a ScienceDirect témákról