Hisztamin H1 receptor agonista
Kapcsolódó kifejezések:
- Csontvelő-elnyomás
- Infúzió
- Hasmenés
- Hisztamin
- Toxicitás
- Hányinger
- A felezési idő megszüntetése
- Intravénás gyógyszeradagolás
Letöltés PDF formátumban
Erről az oldalról
A hisztamin-receptorok és ligandumaik: mechanizmusok és alkalmazások ☆
H1 agonisták
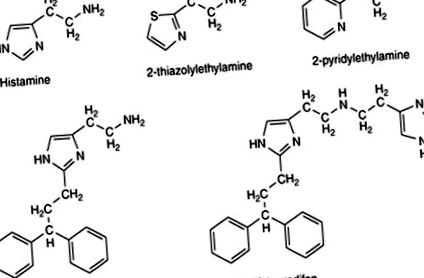
Egészen a közelmúltig nagyon kevés szelektív H1 agonista állt rendelkezésre, és azok aktivitási szintje sokkal alacsonyabb volt, mint a nem szelektív hisztaminé, így csak korlátozottan használhatók. A legszélesebb körben alkalmazott agonisták a 2-tiazolil- és a 2-piridil-analógok voltak (3. ábra). Az 1. ábrán bemutatott hisztamin-származékok, amikor a C2 helyzetben egy aromás csoportot hordoznak alkilén linkerrel (3. ábra), jelentősen javították az anyagot; olyan vegyületek, mint a hisztaprodifen és a szuperhisztaprodifen, fontos eszközökké váltak a H1 receptorok fiziológiában és patológiában betöltött szerepének tanulmányozásában.
3. ábra Farmakológiai kutatási eszközként használt H1 agonisták.
Konstitutív aktivitás a receptorokban és más fehérjékben, A. rész
Saskia Nijmeijer,. Henry F. Vischer, in Methods in Enzymology, 2010
2.5.2 A vizsgálat leírása
A H1R-t endogén módon expresszáló HeLa-sejteket 24 órán át preinkubáljuk az inverz agonista tripelennaminnal, amely az összes inverz H1R agonista közül az egyik leggyorsabb disszociációs kinetikát mutatja. A tripelennamin teljes disszociációja az előkezelt sejtektől elengedhetetlen a radioligand kötődés közvetlen interferenciájának elkerülése érdekében, ami a H1R expressziós szintek alulbecsülését eredményezi. A HeLa-sejteket összegyűjtjük és jéghideg kötőpufferben (50 mM Na2/K-foszfátpuffer, pH 7,4) homogenizáljuk. A sejt homogenizátumokat 5 percig centrifugáljuk 1400 x g-vel, majd a felülúszót 20 percig 15 000 x g-vel. A HeLa/H1R sejtmembránokat 30 percig 30 ° C-on inkubáljuk 1 nM [3H] -mepiramint tartalmazó kötőpufferben. Α a specifikus kötődést 1 μM mianserin jelenlétében határozzuk meg. Az inkubációkat gyors hígítással és ezt követő szűréssel állítjuk le 0,3% polietilén-iminnel bevont Whatman GF/C szűrőkön, jéghideg kötőpuffer alkalmazásával. A szűrőkön visszatartott kötött radioligandumot folyadék szcintillációs számlálással mérjük.
Neuro-otológia
J. M. Espinosa-Sanchez, J. A. Lopez-Escamez, a Klinikai Neurológia kézikönyvében, 2016
Betahistine
Ezt a gyógyszert az Egyesült Államok kivételével világszerte széles körben használják, mivel az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala nem hagyta jóvá. A betahisztin a hisztamin strukturális analógja, amely gyenge részleges posztszinaptikus hisztamin H1 receptor agonistaként és preszinaptikus H3 receptor antagonistaként működik, a posztszinaptikus H2 receptorokra nincs hatással (Gbahou et al., 2010). Úgy tűnik, hogy a gyógyszer hatásmechanizmusa főleg a két metabolit, az amino-etil-piridin és a hidroxi-etil-piridin által közvetített H3-receptorokra gyakorolt hatásától függ (Bertlich et al., 2014).
Állatokon végzett kísérleti vizsgálatok azt mutatják, hogy a betahisztin javítja a labirintus mikrocirkulációját a stria vascularis arterioláinak értágításával, valamint a hátsó félköríves csatorna ampullájában. Így a betahisztin csökkentené az endolimfatikus nyomást azáltal, hogy csökkenti az endolimfa termelését és növeli annak újrafelszívódását (Dziadziola et al., 1999; Laurikainen et al., 2000; Ihler et al., 2012).
A betahisztin hatása dózistól és időtartamtól függ (Tighilet et al., 2005; Ihler et al., 2012). A szokásos adag 48–96 mg/nap, bár időnként magasabb 288 és 480 mg közötti adagot is alkalmaznak (Strupp és mtsai, 2008; Lezius és mtsai, 2011). A káros hatások ritkák, enyheek és önmagukat korlátozzák. A bőrön túlérzékenységi reakció a leggyakrabban jelentett panasz. Időnként hányingerről, hányásról, epigasztrikus fájdalomról és fejfájásról számolnak be, különösen nagyobb dózisok esetén (Jeck-Thole és Wagner, 2006; Benecke és mtsai, 2010).
A betahisztin klinikai hatékonyságát számos vizsgálatban értékelték, és ellentmondásos bizonyítékok állnak rendelkezésre. A Cochrane-felülvizsgálat arra a következtetésre jutott, hogy nincs elegendő bizonyíték annak megmondására, hogy a betahisztinnek van-e hatása az MD vertigo epizódjainak gyakoriságára vagy időtartamára (James és Burton, 2001). Ezt követően meta-analízist hajtottak végre, amely alátámasztja a betahisztin terápiás előnyeit mind az MD, mind a vestibularis vertigo esetében (Nauta, 2014). A 144 mg/nap betahisztin hasonló vertigo kontroll arányt eredményez, mint az intratympanikus dexametazon (Albu és mtsai, 2015). Egy nemrégiben végzett hosszú távú, kettős-vak, randomizált, placebo-kontrollos klinikai vizsgálat (BEMED-tanulmány), 48 vagy 114 mg/nap betahisztin alkalmazásával, kimutatta, hogy a betahisztinnek nincs jótékony hatása MD-ben (Adrion et al., 2016) . További, hosszú távú, randomizált, placebo-kontrollos klinikai vizsgálatok szükségesek nagyobb betahisztin dózisokkal a BEMED vizsgálat eredményeinek megerősítésére. A klinikai kutatásnak a betahisztin-válasz biológiai markereinek vagy klinikai előrejelzőinek azonosítására is összpontosítania kell MD-ben.
Az alvás alapvető fogalmai, tudomány, nélkülözés és mechanizmusok
N. Sakai, S. Nishino, az Alvás enciklopédiája, 2013
Hisztaminerg H3 antagonisták
A hisztamin régóta szerepet játszik az éberség ellenőrzésében, mivel a H1 antagonisták erősen nyugtató hatásúak. A cerebrospinalis folyadék hisztaminszintjének csökkenése megfigyelhető humán narkolepsziában és más központi eredetű hiperszomniákban is. Bár a központilag injektált hisztamin vagy hisztaminerg H1 agonisták elősegítik az ébrenlétet, ezeknek a vegyületeknek a szisztémás beadása különféle elfogadhatatlan mellékhatásokat vált ki a perifériás H1 receptor stimuláció révén. Ezzel szemben a hisztaminerg H3 receptorokat gátló autoreceptoroknak tekintik, és a központi idegrendszerben gazdagodnak. A H3 antagonisták fokozzák az ébrenlét normális patkányokban és macskákban, valamint narkoleptikus egerek modelljeiben. A hisztaminerg H3 antagonisták hasznosak lehetnek ébrenlétet elősegítő vegyületekként az EDS kezelésében vagy kognitív fokozóként, és számos gyógyszeripari vállalat tanulmányozza őket.
Esettörténetek
8.02.3 Professzornak lenni Amszterdamban
Az 1970-es évek vége felé Nautának nyugdíjba kellett vonulnia (kora miatt, a szigorú holland törvényeknek megfelelően), és engem neveztek ki utódjának (3. ábra). Úgy döntöttem, hogy újraélesztem a csoport hisztamin-kutatását (anti). Mivel nem éreztem szükségét új gyógyszer kifejlesztésének, úgy döntöttem, hogy inkább antagonisták, hanem H2 agonistákon dolgozom. Őszinte meggyőződésem, hogy az akadémikusoknak szabadon kell használniuk a kutatási területek kiválasztását; soha nem szabad utánozniuk azt, amit a gyógyszeriparban dolgozó kollégáik végeznek; mindenesetre rossz helyzetben lennének. Abban az időben azt javasolták, hogy a H2 receptor aktiválásához elengedhetetlen a protontranszfer a hisztamin molekula imidazolmagjának tautomer fajtáin keresztül. A hisztamin megfelelően fennmaradt tiazol-analógjainak viszonylag magas H2 agonista aktivitásával megmutathattuk, hogy ez nem lehet igaz. Időközben azonosítottunk egy nagyon szelektív H2 (versus H1) agonista amthamint, a hisztamin helyettesített tiazol analógját, egy olyan vegyületet, amely egy sokat használt kutatási eszköz lett.
3. ábra A szerző tisztelettel adózik professzorának, W. Th. (Wijbe) Nauta az alma materben, a Vrije Universiteit Amszterdamban tartott előadás során.
Ami az 1950-es években történt a H1-antagonistával, az a nyolcvanas években a H2-blokkolókon volt látható. Az első vegyületek közepesen aktívak voltak (cimetidin), de hamarosan rendkívül erős H2 antagonistákat azonosítottak. Ismét bebizonyosodott, hogy ha érdekes célpont áll rendelkezésre, a gyógyszerkémia előáll majd ligandumokkal. Nem sokkal később úgy tűnt, hogy a hisztaminkönyv másodszor is bezárható; a szakterület gyógyszerkémia befejeződött.
A klasszikus antihisztaminok (H1 antagonisták) klinikai profiljával kapcsolatos kérdés azonban mindeddig nem oldódott meg. Valamennyi vegyület súlyos szedációt váltott ki, de annak mechanizmusa nem volt ismert. Sok kutató úgy gondolta, hogy a hatás nem kapcsolódik a hisztaminerg rendszerrel való kölcsönhatáshoz, hanem inkább a muszkarin receptor blokkolása okozta (akkor még csak egy típus). Általánosan elfogadott volt, hogy a hisztaminnak nem volt neurotranszmitter funkciója.
De ez a vélemény megváltozott, amikor Schwartz elegáns ex vivo vizsgálatokkal kimutatta, hogy egyértelmű összefüggés van a központi idegrendszer (CNS) hisztamin receptorainak elfoglaltsága és a H1 antagonisták által okozott szedáció szintje között. A Schwartz eredményei két fontos következtetéshez vezettek: a hisztamin valószínűleg neurotranszmitter, a H1 antagonisták pedig szedációt okoznak azáltal, hogy blokkolják az agy H1 receptorait. Mindkét következtetés hamarosan igaznak bizonyult. 4
Ezt követően a H1-blokkolók új figyelmet kaptak a farmakokémiai iparban. Az első nem szedált vagy második generációs H1-blokkolót, a terfenadint véletlenül találták meg; Ca-belépést blokkoló szerként fejlesztették ki. Ennek a mérsékelten aktív H1 antagonistának nem szétválasztó tulajdonságai az agyba való bejutás gyenge képességének következményei; ezt a megközelítést már korábban kipróbálták, de sikertelenül. De most bebizonyosodott, hogy az elv produktív; új nem szedő vegyületek eljutottak a piacra, és sikerfilmekké váltak; a terfenadin után például cetirizint és loratadint vezettek be.
Valamennyi új generációs származék csak minimális mértékben blokkolta a H1 receptorokat a központi idegrendszerben, és a tankönyvek szerint ez „a magas hidrofilitás miatt volt”. A nem szétválasztó vegyületek azonban log P értékeket mutattak, amelyek a lipofil sejtekre vonatkozó alapszabály szerint karakter lehetővé tenné számukra, hogy könnyen átjutjanak a vér – agy gáton. A megállapítást a Δlog P elmélet alkalmazásával próbáltuk megmagyarázni: a magas Δlog P (log P oktanol – víz mínusz log P ciklhexán – víz) magas hidrogénkötő képességet jelent, ezért erős kötődést mutat a plazmafehérjékhez, következésképpen gyenge CNS behatolási képesség. A megállapításokat csak a Δlog P mellett a vegyületek további tulajdonságainak felhasználásával magyarázhatnánk. Szinte lehetetlennek tűnt nem CNS-behatoló vegyületek megtervezése; nagyrészt véletlen kérdése volt. Később kiderült a valódi mechanizmus, amikor bebizonyosodott, hogy minden második generációs vegyület a P-gP transzporter szubsztrátja. Valójában az új vegyületek különösen jó szerencsének köszönhetők.
Hisztamin
Az agyi hisztamin jelentősége a gyógyszerhatás szempontjából
Számos olyan klinikailag elérhető gyógyszer, amely módosítja az alvás-ébrenlét ciklust és az étvágyat, a hisztaminerg rendszeren keresztül hat
A fájdalomérzékelést módosító gyógyszerek részben a hisztaminerg rendszeren keresztül hatnak
Noha a fájdalomcsillapító opioid gyógyszerek, mint például a morfin, számos neurokémiai változást indítanak el, az idegsejt hisztamin felszabadulásának ezen szerekkel történő aktiválása és az azt követő agyi H2 receptorok stimulálása kritikus fontosságú e vegyületek hatásmechanizmusa szempontjából (Gogas et al., 1989; Eriksson és munkatársai, 2000). A stresszválaszok szintén hozzájárulhatnak az opioid fájdalomcsillapításhoz, és úgy tűnik, hogy a hisztaminerg idegsejtek közvetítik a morfin antinocicepció stressz okozta potencírozását. Habár a H2 receptorokon alapuló fájdalomcsillapító gyógyszereket nem fejlesztettek ki, a cimetidinnel (H2 antagonista) és a burimamiddal (H2 és H3 tulajdonságokkal rendelkező gyógyszer) kapcsolatos gyógyszerekből új fájdalomcsillapítók családját fedezték fel. Ezeket az improgánszerű szereket eddig csak kutatási eszközként használták. Az agyon kívül az érzékszervi idegrostok H1-receptorai bizonyos fájdalom és gyulladás során aktiválódnak, és H1-antagonistákat alkalmaznak gyulladáscsökkentő és fájdalomcsillapító profiljukhoz (Raffa, 2001). Ellentétes mechanizmus révén a H3 agonisták csökkentik a kémiai és mechanikai ingerek által kiváltott fájdalomátvitelt (Hough & Rice, 2011).
A H3 receptor vonzó célpont számos központi idegrendszeri betegség kezelésében
A H3 receptor nemcsak autoreceptor, hanem más neurotranszmitterek, köztük az 5-HT, az acetilkolin, a dopamin és a noradrenalin felszabadulását is szabályozza (16–7. Ábra; Haas et al., 2008). Ezek a tulajdonságok nagyon vonzó terápiás célponttá teszik a központi idegrendszeri rendellenességek szempontjából, mivel a többszörös és komplementer hatásmódú szerek nagyobb valószínűséggel mutatnak széles körű hatékonyságot a mag és a társbetegségek tüneteivel szemben. Számos H3 receptor antagonista vesz részt klinikai vizsgálatokban narkolepszia, az Alzheimer-kórral kapcsolatos kognitív károsodások, Parkinson-kór, skizofrénia és figyelemhiányos hiperaktivitási rendellenesség (ADHD) kezelésére (Benarroch, 2010). A H3 receptorok szembetűnő tulajdonsága a magas konstitutív aktivitásuk in vivo (Morisset et al., 2000). Ez a felfedezés fontos a gyógyszerfejlesztés szempontjából, mivel a konstitutívan aktív H3-receptorállamokkal való versengés képessége (inverz agonizmus) fontos terápiás következményekkel jár.
A H3 antagonisták hatékonyak az alvászavarok kezelésében (Lin és mtsai., 2011). Az elsődleges narkolepsziát, a túlzott nappali álmosságot, a kataplexiát és a narkoleptikus epizódokat, valamint a különféle okokból eredő álmosságot jelenleg főleg ébrenlétet elősegítő vegyületek, például modafinil vagy pszichostimulánsok, például amfetamin kezelik, amelyek a dopaminerg rendszeren keresztül hatnak. Hatásos izgalmi hatása ellenére ezek a vegyületek feltehetően nem aktiválják a hisztaminerg mechanizmusokat, mivel hatásuk megmarad a HDC-KO egerekben. Az agy H3-receptora jelenleg a legígéretesebb célpont a hiperszomnia kezelésében, mivel blokádja növeli a hisztamin felszabadulást, ami serkenti a posztszinaptikus H1 receptorokat. A H3 antagonisták valóban figyelemre méltó ébredést elősegítő hatást mutatnak a kísérleti állatokban, és a klinikai vizsgálatok megerősítik ennek a gyógyszerosztálynak az érvényességét a különböző patológiás eredetű aluszékonyság és éberséghiány kezelésében (Lin és mtsai., 2008). Mindezek a vegyületek jobb farmakológiai profilt mutatnak, mint más pszichostimulánsok, mert az amfetaminokkal, a koffeinnel vagy a modafinillel ellentétben nem váltanak ki visszapattanó hatást vagy nem gerjesztik a viselkedést.
A hisztaminerg rendszerre ható gyógyszerek ígéretes jelöltek az elhízás, az epilepszia és a neurodegeneratív rendellenességek kezelésében is. A H1-receptor antagonisták növelik az élelmiszer-fogyasztást és a testsúlyt, míg a H1-receptorok aktiválása elnyomja az élelmiszer-bevitelt, az agyi hisztamin elérhetőségének növekedése a H3-receptor-antagonisták alatt pedig súlycsökkenést okoz (Passani et al., 2011). Habár a H3-receptor antagonisták nem okoztak jelentős súlyváltozást a narkolepszia vagy ADHD hatékonyságának tesztelését célzó klinikai vizsgálatokba beiratkozott betegeknél, ezek a vegyületek hatásosnak bizonyulhatnak specifikus étkezési rendellenességek kezelésében. A preklinikai adatok arra utalnak, hogy a H3 antagonisták hasznosak lehetnek az alkoholizmus (Nuutinen et al., 2010), valamint az epilepszia (Benarroch, 2010) kezelésében. A hisztamin szintén szerepet játszik a sclerosis multiplex patológiájában és annak egérmodelljében, a kísérleti autoimmun encephalomyelitisben, és a neuroprotekcióban betöltött szerepe jelenleg mérlegelés alatt áll.
Nappali álmosság és narkolepszia
- Máj policisztás betegség - áttekintés a ScienceDirect témákról
- Alacsony zsírtartalmú tej - áttekintés a ScienceDirect témákról
- Béldiszmotilitás - áttekintés a ScienceDirect témákról
- Kefir - áttekintés a ScienceDirect témákról
- Kemény széklet - áttekintés a ScienceDirect témákról