Hosszú távú hematopoietikus őssejtkárosodás az akut sugárzási szindróma hematopoieticus szindróma egér modelljén
Hui Lin Chua
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
P. Artur Plett
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Carol H. Sampson
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Mandar Joshi
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Rebeka Tabbey
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Barry Katz
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Thomas J. MacVittie
† Marylandi Egyetem, Baltimore Orvostudományi Kar, Baltimore, MD, USA
Christie M. Orschell
* Indiana Egyetem Orvostudományi Kar, Indianapolis, IN, USA
Absztrakt
BEVEZETÉS
A sugárzással járó terrorista események növekvő veszélye, valamint a sugárbalesetek lehetősége aláhúzza a sugárzás áldozatainak kezeléséhez szükséges orvosi felkészültség szükségességét. Az elnyelt sugárzási dózistól és az expozíció típusától függően a kezelési stratégiák, valamint az azonnali és hosszú távú klinikai eredmények az áldozatok között eltérőek lesznek. Míg az emberek 50% -ának halálos dózisa az expozíció utáni 60 napon (LD50/60) 3,5-4,5Gy (Lushbaugh 1969, Vriesendorp és Van Bekkum 1984), addig ez 6-7Gy-ig növelhető, amikor az antibiotikumokat és a folyadékokat támogató kezelésként biztosítják (Dainiak 2002). A 10Gy-nál nagyobb expozíció gyors halált eredményez a kiterjedt neurológiai és gyomor-bélrendszeri károsodások miatt. Az 1 és 10Gy közötti expozíció elsősorban a vérképző rendszert érinti, amely az egyik legproliferatívabb és így sugárérzékenyebb szövet az emberi testben. A hematopoietikus rendszer sugárzáskárosodása az úgynevezett akut sugárzási szindróma (H-ARS) Hematopoietic Syndrome-ját eredményezi, a tartomány alsó végén meglehetősen jóindulatú tünetek jelentkeznek, de a magasabb neutropenia és a thrombocytopenia miatt valószínű halál vége.
A vérképző őssejtek (HSC) a ritka csontvelő (BM) sejtek speciális csoportja, amely két egyedi tulajdonsággal rendelkezik, megkülönböztetve őket más BM sejtektől: 1) képes differenciálódni hematopoietikus progenitor sejtekké (HPC), amelyek érett sejteket eredményeznek a vér képződött elemeit (neutrofilek, vérlemezkék, vörösvértestek stb.) tartalmazó összes vonalra, és 2) az önmegújulás képességére, amely folyamat során a HSC megoszlik és a HEM-nek hasonló vérképző potenciállal rendelkező lányát eredményezi, mint a szülő HSC-t. (Till és McCulloch 1961, Abramson és mtsai 1977, Visser és mtsai 1984, Jones és mtsai 1989, Jones és mtsai 1990). Úgy gondolják, hogy e két folyamat révén a HSC képes fenntartani az egész életen át tartó vérképzést és helyreállítani a normális BM-funkciókat transzplantáció, rádió- vagy kemoterápia vagy nemkívánatos nagy dózisú ionizáló sugárzás után (Till és McCulloch 1961, Visser et al. 1984, Jones és mtsai 1990, Keller és Snodgrass 1990). A primitív velő hematopoietikus őssejtek (HPC) szintén thymus progenitorokat eredményeznek, amelyek elhagyják a BM-t, és a tímuszot elvetik, hogy elindítsák az immunrekonstrukciót (Kondo et al. 1997, Perry et al. 2003, Perry et al. 2004). A HSC és a HPC elvesztése a morbiditás és a mortalitás végső oka a H-ARS-ben.
A jelenlegi vizsgálatok célja annak meghatározása, hogy a halálos besugárzás túlélőinek milyen hosszú távú károsodása van a hematopoietikus rendszerben és a HSC-térben, és milyen mértékben járul hozzá a RBMD-hez. Várható, hogy a megállapítások az RBMD hátterében álló mechanizmusok és a sugárzási áldozatok életkorának következményeinek jobb megértéséhez fognak vezetni, azzal a fontos céllal, hogy a lehetséges orvosi ellenintézkedéseket kifejlesszék e gyengítő állapot enyhítésére.
MÓD
Egerek, sugárzás, dozimetria és tartás
A besugárzott (TBI) és az életkornak megfelelő nem besugárzott (nem TBI) kontroll C57Bl/6 egerekről (CD45.2 +), amelyeket ezekben a vizsgálatokban elemeztek, valamint a tartást, besugárzást, dozimetriát és az egészségi állapot monitorozását, a a kísérő cikket Plett és munkatársai (sajtóban). A csontvelő-transzplantációs vizsgálatokban alkalmazott fogadó egerek és a versengő sejtek donorjai hím vagy nőstény kongén Ptrc a Pep3 b/BoyJ (B6.BoyJ; CD45.1 +) vagy a C57Bl/6 és B6.BoyJ egerek F1 hibridjei (CD45) voltak. 2 +/CD45,1 +). A B6.BoyJ és F1 hibrideket házon belül tenyésztették és 8-12 hetes kor között használták. Valamennyi tanulmányt az Indiana Egyetem Orvostudományi Karának intézményi állatgondozási és felhasználási bizottsága hagyta jóvá.
Kísérleti terv
Áramlási citometriás elemzések
A c-Kit +, Sca-1 +, törzs, CD150 + (KSLCD150 + sejtek) sejtfelszíni fenotípust expresszáló csontvelő sejtek a HSC potenciál szempontjából erősen dúsított sejtek populációját képviselik (Kiel et al. 2005, Chen et al. 2008). Ezért ezt a fenotípust választottuk feltételezett HSC populációként ezekben a vizsgálatokban.
A hematopoietikus populációk elemzéséhez SLAM markerek (Kiel et al. 2005, Chen és mtsai. 2008) és a sejtciklus állapotának elemzéséhez TBI vagy nem TBI egerekből származó LDBM sejteket festettünk vérképző markerekhez CD3-FITC, Gr1-FITC, B220 alkalmazásával. -FITC, Sca-1-PE, c-Kit-APC és CD150-PerCPCy5-5 antitestek. A sejteket egy éjszakán át 1% (v/v) formaldehidben rögzítettük, majd néhány kísérletben DAPI-val (Invitrogen, Eugene, OR) festettük.
A primitív vérképző sejtekben a reaktív oxigénfajok (ROS) tartalmát úgy határoztuk meg, hogy az LDBM-t C-DFDA-val (Invitrogen) előinkubáltuk, majd CD3-APC-vel, Gr1-APC-vel, B220-APC-vel, Sca-1-PECy7-vel festettük. c-kit-PE és CD150-PerCPCy5-5 antitestek.
A transzplantált befogadókban a donor kimérizmusának meghatározásához perifériás vért (PB) kaptunk farokcsíkokkal és ammónium-klorid lízisnek vetettük alá (0,16 M NH4Cl, 0,01 M KHCO3). A lizált PB-t CD45.1-PE antitestekkel festettük a recipiens eredetű fehérvérsejtek (B6.BoyJ vagy a C57Bl/6 és B6.BoyJ egerek F1 hibridje) és CD45.2-FITC antitestek kimutatására a fehérvérsejtek kimutatására. donor eredet (TBI vagy nem TBI C57Bl/6 egér). A transzplantált betegek többsoros feloldódásának meghatározásához a transzplantáció után 6 hónappal a PB-t CD45.1-PE, CD45.2-PerCPCy5.5, CD8a-Pacific Blue, CD4-Alexa Fluor 647, B220-PE Texas Red festékkel láttuk el. és Gr1-FITC.
Az összes antitestfestési eljárást 30 percig, 4 ° C-on hajtottuk végre, majd mosást (1% szarvasmarha borjúszérum/PBS), centrifugálással 2000 fordulat/perc sebességgel, 4 ° C-on. Az áramlási citometriás elemzést FACScan vagy LSRII rendszerek [Becton Dickinson Immunocytometry Systems (BDIS), San Jose, CA] alkalmazásával hajtottuk végre. Minden antitestet a BD Biosciences-től (San Jose, Kalifornia) vásároltunk, a CD150-PerCPCy5.5 (Biolegend, San Diego, CA) és a Sca-PECy7 (eBiosciences, San Diego, CA) kivételével. Körülbelül 1,0–2,0 × 105 esemény történt a kiméra és a származási elemzéshez, és 0,2–1,0 × 106 esemény történt a primitív hematopoietikus sejtfenotipizáláshoz és a sejtciklus elemzéséhez.
Áramlási citometrikus sejtrendezés
TBI vagy nem TBI egerekből származó LDBM-et (3 - 20 × 106) CD3-FITC, B220-FITC, Gr1-FITC, Sca-1-PE, c-Kit-APC és CD150-PerCPCy5.5 antitestekkel festettünk. a KSLCD150 + sejtekhez rendezve FACSVantage SE vagy FACSAria (Becton Dickinson, Franklin Lakes, NJ) vagy Reflection (iCyt, Champaign, IL) rendszerekkel. Megépítettek egy elsődleges fényszóró kaput, amelyet a származási markert expresszáló sejtek vizualizálására használtak. Egy második kaput készítettek a származási negatív sejtek köré, és a c-Kit + és Sca-1 + sejtek [c-Kit + Sca-1 + lin - (KSL) sejtek] vizualizálására használták. A KSL-sejteket meghatározó végső kaput használtuk a CD150 + sejtek vizsgálatához és rendezéséhez. A KSLCD150 + sejteket 10% (v/v) szarvasmarha-magzati szérumot tartalmazó IMDM-ben (Lonza, Walkersville, MD) gyűjtöttük (Atlanta Biologicals, Lawrenceville, GA).
Hosszú távú kompetitív transzplantáció
Tisztított KSLCD150 + sejteket TBI-ből vagy nem TBI egerekből (C57Bl/6) áramlási citometriás sejtrendezéssel állítottunk elő, és ezekből a sejtekből 150-et intravénásán transzplantáltunk 1,0 × 105 konjuktív LDBM versenytárssal (B6.BoyJ vagy a C57Bl F1 hibridjével együtt)./6 és B6.BoyJ egerek) konjugens recipiensekké (B6.BoyJ vagy a C57Bl/6 és B6.BoyJ egerek F1 hibridjei), amelyeket halálosan besugároztunk 700cGy osztott adaggal, majd 4 óra múlva 400cGy összesen 1100cGy. A kongén C57Bl/6, B6.BoyJ és F1 hibridek alkalmazását versenyképes BM transzplantációs vizsgálatokban már korábban leírtuk (Plett és mtsai 2002, Plett és mtsai 2003) és mások (Hoggatt és mtsai 2009). A címzetteknek doxycyclin chow-t és neomicin-vizet biztosítottunk a transzplantáció előtt egy héttel, majd ezt követően egy hónapig. A PB-t havonta 6 hónaponként elemezték a donor kiméra és a transzplantáció után 6 hónappal a törzsvonal helyreállítása szempontjából.
Vérképző progenitor sejtek vizsgálata
1,0 × 105 5 LDBM-sejtet szuszpendáltunk két példányban 1 ml metilcellulóz-táptalajban, amely a vérképző növekedési faktorokat egér őssejtfaktort, egér interleukin-3, rekombináns humán interleukin-6 és rekombináns humán eritropoietint tartalmazta (Methocult M3434, Stem Cell Technologies, Vancouver BC, Kanada). A tenyészeteket 100% -ban nedvesített 5% CO2-ban inkubáltuk levegőben, 37 ° C-on, és 13 nappal később felsoroltuk CFU-GM, BFU-E és CFU-GEMM telepekre fénymikroszkóp alatt, benzidin oldatot használva a BFU-E telepek vizualizálására. (Clarke és Housman 1977).
A B előtti limfoid kolónia vizsgálatok
1,0 × 105 LDBM sejtet duplikálva szuszpendálunk rekombináns humán IL-7-et tartalmazó 1 ml metil-cellulóz-táptalajban (MethocultvM3630, Stem Cell Technologies, Vancouver, BC, Kanada). A tenyészeteket 100% -ban nedvesített 5% CO2-ban inkubáltuk levegőben, 37 ° C-on, és 7-8 nappal később felsoroltuk a pre-B limfoid telepekre.
Statisztikai elemzések
Kétirányú ANOVA modelleket alkalmaztunk a besugárzást követő hónapok és a súly, donor kiméra, BM sejtesség, CBC paraméterek, progenitor gyakoriság és egérenkénti szám, BM primitív hematopoietikus sejtek (lin, KSL és KSLCD150 +) és a lin-, KSL- és KSLCD150 + -g% G0G1. Ez az elemzés minden paraméterhez összehasonlítja a TBI és a nem TBI egereket, miután beállította az időt. Így az összehasonlítások az összes egeret érintették, nem pedig az egerek kis csoportjai közötti többszörös összehasonlítást az egyes időpontokban. A kezelési csoport és a besugárzás utáni hónapok közötti kölcsönhatást szintén minden modellben megvizsgáltuk.
EREDMÉNYEK
Testtömeg és CBC
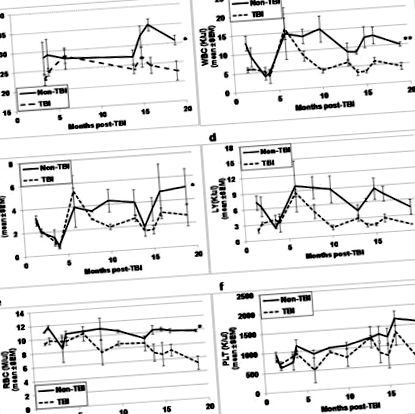
Vizuálisan a TBI és a nem TBI megjelenésében nem különbözött egymástól, kivéve a TBI egerek szőrének színe sokkal világosabb és szürkébb volt, mint a nem TBI egereké. A HSC és HPC elemzések eutanáziáját megelőzően az expozíció utáni különböző időpontokban a TBI és a nem TBI egereket lemértük, és a vért farokrészletekkel gyűjtöttük a CBC elemzéshez. Míg a TBI egerek testtömege (1a. Ábra) és az összes CBC-paraméter (1b-1f. Ábra) hasonlónak tűnt a nem TBI-egerekéhez hasonlóan az expozíció utáni korai időpontokban, mindezen paraméterek közötti különbségek az időpontokban eléggé nyilvánvalóvá váltak több mint 10–13 hónap a TBI után (p≤0,01). Míg a testtömeg és a CBC paraméterek általában nőttek a nem TBI egerekben az életkor előrehaladtával, a TBI egerekben az összes paraméter csökkent.
Halálosan besugárzott kongén egér befogadókat 150 TBS vagy nem TBI donorból izolált 150 KSLCD150 + sejttel és 1,0 × 105 5 LDGM konjugens eredetű versenytárs sejtekkel ültettek át. A farokkivágásokból származó perifériás vért transzplantált recipiensektől havonta kaptuk, és áramlási citometriával elemeztük, hogy meghatározzuk a donor kimérizmáját CD45.1 és CD45.2 elleni antitestek alkalmazásával. A vonalak az átlagos ± SEM donor kimérizmust reprezentálják a transzplantáció után 6 hónappal (kivéve a 3,5, 15 és 16 hónap adatait, amelyek a transzfer után 4, 3, illetve 2 hónappal elemzett folyamatban lévő kísérletek kimérizmusát jelentik). * p 5a. ábra), míg a nem TBI egerekből származó KSLCD150 + sejtek (5b. ábra), vagy a TBI (5c. ábra) vagy a nem TBI (5d. ábra) KSLCD150 + sejtekkel együtt transzplantált KSLCD150 + sejtek normális mintát adtak a transzplantált recipiensek törzsének helyreállítása. Ezek az adatok azt mutatják, hogy a TBI HSC valószínűleg soha nem nyeri vissza a teljes HSC-potenciált a besugárzott túlélő élete során. Érdekes és másokkal egyetértésben (Morrison és mtsai. 1996, Kim és mtsai. 2003) az idős nem TBI egerek HSC-je ferde volt a myeloid vonal felé, amit a donor eredetű granulociták nagyobb százaléka bizonyít a 13. hónapban korábbi hónapokra (5b. ábra).
A 4. ábrán TBI vagy nem TBI KSLCD150 + sejtekkel átültetett egereknek a transzplantációt követő 6 hónapban megvizsgáltuk a donor eredetű törzs rekonstrukcióját. A farokvágásokból származó perifériás vért CD45.1, CD45.2, CD4, CD8, B220 és Gr1 elleni fluoreszcensen jelölt antitestekkel festettük, és áramlási citometriával elemeztük donor vagy versenytárs eredetű CD4 + és CD8 + T sejtek, B sejtek, és granulociták. Az a panel a TBI donorokból származó 150 KSLCD150 + sejt törzsrekonstitúcióját mutatja (az összes TBI donorsejt százalékában kifejezve). Az a panel 2., 8. és 10. hónapjának adatai n = 1 voltak, mivel a TBI KSLCD150 + sejtekkel átültetett egerek gyakran nem mutattak elég magas donor kimérizmust ahhoz, hogy lehetővé tegyék a származási sejtek további fenotipizálását. A b panel mutatja a nem TBI donorokból származó 150 KSLCD150 + sejt törzs rekonstrukcióját (az összes nem TBI donor sejt százalékában kifejezve). A c és d panelen látható azok a kongén sejtek (az összes versenytárs sejt százalékában kifejezve), amelyek együtt transzplantáltak KSLCD150 + -val TBI vagy nem TBI donoroktól, ami belső normaként szolgál a normál vonal rekonstrukcióhoz. . A sávok átlag ± SEM értéket képviselnek; n = 1-7 fogadó egér csoportonként és időpontonként.
Sejtciklus elemzés
A TBI és a nem TBI egereket különböző időpontokban feláldoztuk az expozíció után 1,5 és 16 hónap között, és a csontvelő KSL sejteket áramlási citometriával elemeztük ROS-tartalomra C-DFDA alkalmazásával. A sávok a C-DFDA átlagos fluoreszcencia intenzitásának (MFI) átlagát ± SEM-et képviselik a C-DFDA + KSL sejteken; * p 2h ábra). Mások beszámoltak a besugárzott egerek CD150 fokozott expressziójáról HPC-n (Simonnet et al. 2009), igaz, az expozíció utáni korábbi idõpontokban. Bár a CD150 funkciója a HSC-n nem ismert, ismert, hogy a CD150-et a citokinek és az LPS szabályozzák a limfoid sejtekben (Sidorenko és Clark 1993), és szabályozza az AKT-t és/vagy az ERK1/2-t (Yurchenko és Sidorenko 2010), javasolva az esetleges szerepeket sejtek túlélése (Yurchenko és mtsai 2011). Lehetséges, hogy a besugárzott egerekből származó CD150 krónikus utregulációja HSC-ben tükrözheti az expozíció utáni krónikus gyulladásos állapotot, és védő mechanizmus lehet a besugárzás által károsított sejtek apoptózisának ellenőrzésére.
Végül értékelik, hogy a TBI-modellek nem utánozzák a nukleáris terrorista forgatókönyvet vagy más ellenőrizetlen nukleáris eseményeket. Az árnyékolás a sugárbaleset helyszínén valószínűleg az áldozat és a forrás, a nehéz ruházat vagy a test szövetei közötti fizikai akadályok miatt következik be. Ez az árnyékolás lehetővé teszi néhány olyan HSC megtakarítását, amelyek elősegíthetik a sugárzás akut hatásainak felépülését. A vérképző rendszer egy részének az akut letalitásra való árnyékolásának védőhatásáról már 1949-ben beszámoltak, amikor Jacobsen et. al. (Jacobsen és mtsai. 1949) kimutatták, hogy az egerekben az LD50 értéket a lép árnyékolásával 5,50Gy-ról 9,75Gy-ra lehet növelni. Más vizsgálatok egerekben egyetlen láb vagy farok árnyékolásával mutattak védelmet (Robinson és mtsai 1965, Carsten és Bond 1968, Carsten és Bond 1969). Így az árnyékolás hatással lehet az RBMD megnyilvánulásaira is. Az ilyen vizsgálatok meghaladták a jelenlegi tanulmány kereteit, de a folyamatban lévő „részleges test-besugárzás” (PBI) vizsgálatok során foglalkoznak velük, ahol az egér BM 5% -a védett a besugárzástól. A PBI más modellrendszerekre gyakorolt hatásáról más cikkekben számoltak be ebben a számban (sajtóhivatkozásokban).
KÖVETKEZTETÉSEK
Ezek az adatok együttvéve azt sugallják, hogy a halálos sugárzás túlélőiben a primitív hematopoietikus sejtek közötti fokozott ciklus hozzájárulhat a hematopoietikus őssejtek kimerüléséhez, az elhúzódó immunszuppresszióhoz és az azt követő RBMD-hez. Ezek az adatok azt igazolják, hogy a hematopoietikus őssejtek működése a letálisan besugárzott egerekben az expozíció után 19 hónapig súlyos depresszióban van, és az öregedés „második találata” tovább rontja ezekben az egerekben már hiányos HSC funkciót.
Az expozíció után 1,5 és 19 hónap között izolált TBI és nem TBI egerekből származó 1,0 × 105 LDBM-et szuszpendáltuk 1 ml metilcellulóz táptalajban, amely muSCF-t, muIL-3-at, rhuIL-6-ot és rhuEPO-t tartalmaz (hematopoietikus progenitorok esetében), vagy rekombináns humán IL-7-et tartalmazó 1 ml metil-cellulóz-táptalajban (pre-B limfoid telepek esetén). A sejteket inkubáltuk 100% -os nedvesített 5% CO2-ban levegőben 37 ° C-on, és 13 nappal később CFU-GM, BFU-E és CFU-GEMM telepekre, vagy 7 nappal később a pre-B limfoid telepekre inkubáltuk. A CFU-GM, a BFU-E és a CFU-GEMM együttes gyakoriságát, valamint egérenként egerek számát az a és b panelen mutatjuk be. A c és d panelek megadják az egérenkénti pre-B limfoid telepek gyakoriságát és teljes számát. A sávok átlag ± SEM értéket képviselnek; A nem TBI-t és a TBI-t összehasonlító p értékeket minden ábrán megadjuk. n = 1-3 egér csoportonként és időpontban.
Köszönetnyilvánítás
Finanszírozás:
Ezt a projektet teljes egészében vagy részben az Országos Allergia- és Fertőző Betegségek Intézetének (szerződésszámok: HHSN266200500043C és HHSN272201000046C), valamint a Nemzeti Szív-, Tüdő- és Vérintézet (Díjszám: R01HL075660 - CMO), Nemzeti Intézetek finanszírozták. Egészségügyi és Humán Szolgáltatások Osztálya. A tartalom kizárólag a szerzők felelőssége, és nem feltétlenül képviseli a Nemzeti Egészségügyi Intézet hivatalos nézeteit.
Lábjegyzetek
Pénzügyi összeférhetetlenséget egyik szerző sem jelentett be.
- A mértéktelen étkezési rendellenességek gyógyulásának kezelése hosszú távon
- Sok nőnek hosszú távú súlycsökkenése van a hasüreg után, beszámol a plasztikai és a rekonstruktív műtétről
- A lábrögök (más néven mélyvénás trombózis) azonnali és hosszú távú veszélyt jelentenek az egészségre - Harvard Health Blog
- Olasz modell megfogadja, hogy 19 millió férfinak ad orális szexet a férfiak egészségére
- Hogyan szerezz olyan testet, mint egy fehérnemű modell - Business Insider