Interleukin-1 génpolimorfizmusok fertőzött krónikus gasztritiszes betegeknél Helicobacter pylori mint a gyomorrák kialakulásának kockázati tényezői
Absztrakt
Bevezetés
Legutóbbi elemzésünk NOD2/CARD15 gén azt mutatta, hogy a T allél gyakorisága a 802C/T polimorfizmusban szignifikánsan magasabb (32,8%) volt a betegcsoportban, összehasonlítva az általános populációs csoporttal (18,1%), relatív kockázata 1,8 volt. A betegcsoportban a CC genotípus gyakorisága 51,1%, CT 32,1% és TT 16,8% (relatív kockázat: 0,7, 1,1 és 4,2), míg a populációs csoportban: 69,0, 25,7 és 5,3% (relatív kockázat): 1,0, 0,9, illetve 1,3) (Hnatyszyn és mtsai. A NOD2/CARD15 gén T polimorfizmusa krónikus gyomorhurutgal és rákra való hajlamgal H. pylori fertőzött betegeknél. Exp Mol Pathol 88: 388–393 "href ="/cikk /10.1007/s00005-013-0245-y#ref-CR18 "> 2010).
Ez arra utal, hogy a gazda gyulladásos reakciójának génpolimorfizmusa befolyásolhatja a gyomornyálkahártya jellegét és mértékét H. pylori fertőzés. Vizsgálataink célja a citokin proinflammatorikus gének asszociációinak elemzése volt: IL1A és IL1B a gyomornyálkahártya változásainak előfordulásával. Ebből a célból az allél és genotípus gyakorisága IL1A génpolimorfizmus –889C> T és a IL1B génpolimorfizmus + 3954C> T összehasonlították az általános lengyel populáció és a krónikus gyomorhurutban, atrófiában, bélmetapláziában, diszpláziában, bél típusú gyomorrákban szenvedő betegek között H. pylori fertőzés.
Anyagok és metódusok
Betegek
Gasztroszkópos vizsgálatok
A gyomor összes endoszkópos vizsgálatát helyi érzéstelenítésben (2% Lignocainum) végeztük videogasztroszkóp segítségével (GiF Q 165 Olympus, Tokió, Japán), ugyanaz az endoszkóp. A betegek egyikét sem altatták altatásban. A gyomornyálkahártya gyulladásos változásainak (ödéma, hiperémia, nyálkahártya granulálása, eróziók és fekélyek jelenléte, hipertrófia vagy gyomorredők atrófiája) endoszkóp képének makroszkópos értékelését a frissített Sydney-besorolásnak megfelelően végeztük (Dixon et al. 1996; Misiewicz 1991). Az elvégzett vizsgálatok során a következő öt szövetmintát vettük: a pylorus régiójából, a gyomor szögéből és korpuszából a nagyobb és kisebb görbületből. További két biopsziát vettünk az antrumból és a gyomor korpuszából H. pylori kimutatás gyors ureázpróba alkalmazásával (Élelmezési és Táplálkozási Intézet, Varsó). A kísérleteket a Poznan Orvostudományi Egyetem Bioetikai Bizottsága fogadta el. Valamennyi beteg, valamint a szülők és gyermekek hozzáférhettek a kísérletekre vonatkozó teljes információkhoz, és írásbeli beleegyezésüket adták az elvégzésükhöz.
Szövettani vizsgálatok
A szövettani értékelést a készítmények haematoxilinnal és eozinnal történő kezelésével végeztük a korábban leírtak szerint (Hnatyszyn és mtsai. A NOD2/CARD15 gén T polimorfizmusa krónikus gyomorhurutgal és hajlamra hajlamos H. pylori fertőzött betegeknél. Exp Mol Pathol 88: 388–393 "href ="/article/10.1007/s00005-013-0245-y # ref-CR18 "> 2010). Az összes mintát ugyanaz a hisztopatológus vizsgálta meg klinikai információk nélkül. H. pylori a fertőzést pozitívnak ítélték szérumpróbával vagy szövettani vizsgálattal Giemsa festéssel. A gyomor nyálkahártya-gyulladásának intenzitását, a mirigyek atrófiáját, a bél metapláziáját és a dysplasiait minden szakaszban értékeltük a frissített Sydney-osztályozás szerint (Misiewicz 1991; Dixon és mtsai 1996). A nyálkahártya-gyulladás, atrófia és a bélmetaplázia mértékét négy fokozatban osztályozták az alábbiak szerint: 0 – nincs; 1 – enyhe; 2 – mérsékelt; és 3 – súlyos. A gyomor karcinómát bél és diffúz típusokba sorolták Lauren kritériumai szerint (Lauren 1965).
A H. pylori Fertőzés
A jelenléte H. pylori baktériumokat találtunk az ureazteszt segítségével (Institute of Food and Nutrition, Varsó), amelyet 2 és 24 óra után leolvastunk (kétes esetek). Ezenkívül a H. pylori a baktériumokat a gyomornyálkahártyában szövettani vizsgálatokkal igazolták, a Warthin-Starry módszert alkalmazva, amelyet Giemsa módosított a friss Sydney-rendszer szerint (Misiewicz 1991; Dixon és mtsai 1996). Valamennyi beteg esetében mindkét vizsgálatot elvégeztük. A leglényegesebb eredményeket hisztopatológiai vizsgálattal érték el, figyelembe véve a gyorsabb ureáz teszt alacsonyabb érzékenységét és specifitását. A H. pylori a populációban lévő baktériumokat immunológiai teszt alkalmazásával végeztük (HELICO Test, Ani Biotech Oy, Finnország). Ez a teszt a baktérium elleni IgG antitestek szintjét méri.
A polimorfizmus elemzése IL1A és IL1B Gének
A –889C/T polimorfizmusok asszociációjának molekuláris vizsgálata IL1A és + 3954C/T polimorfizmusa IL1B gének krónikus gyomorhurutban és hajlamosak a rákra H. pylori-fertőzött betegeket olyan betegeknél végeztünk, akiknek a krónikus gyulladás különböző stádiumait gasztroszkópos és szövettani elemzésekkel igazolták. DNS-t izoláltunk betegek és kontrollcsoportok esetén a gyomornyálkahártya-biopsziák paraffin blokkjaiból Roche High Pure PCR templátkészítõ készlettel és perifériás vérbõl guanidin-izotiocianát (GTC módszer) alkalmazásával.
A genotipizálást PCR – RFLP assay alkalmazásával végeztük, majd elektroforézist végeztünk 6% poliakrilamid gélekben (ALFExpress) vagy 1,5% agaróz gélekben. A 98 bp-os fragmens amplifikálása érdekében, amely magában foglalja a –889C/T polimorfizmust IL1A gén, a PCR-reakciót 20 μl reakcióelegyben hajtottuk végre, amely 100 ng genomiális DNS-t, egyenként 15 pmol F és R primert, 0,125 mM dNTP-t, 1,0 U Taq polimerázt tartalmazott. Az alapozó szekvenciák a következők voltak: IL1A (–889C/T) F 5′-Cy5-GTTCTACCACCTGAACTAGGC-3 ′ és IL1A (–889C/T) R 5′-TTACATATGAGCCTTCC-ATG-3 ′. A 230 bázispár méretű fragmens magában foglalja a + 3954C/T polimorfizmust IL1B a gént primerek segítségével amplifikáltuk: IL1B (+ 3954C/T) F 5'-Cy5-GACTTTGACCGTATATGCTCAG-3 'és IL1B (+ 3954C/T) R 5'-ATGGACCAGACATCACCAAGC-3'. A reakció körülményei: kezdeti denaturálás 95 ° C, 5 perc; 30 ciklus: denaturálás 92 ° C, 30 s, primer izzítás 55 ° C, 45 s, szintézis 72 ° C, 60 s és végső szintézis 72 ° C, 5 perc. Restrikciós enzimekkel végzett hidrolízis után kapott DNS-fragmensek NcoI (37 ° C, 6 óra) és TaqI (65 ° C, 6 óra) a következő méretű volt: allél NcoÉn (-) IL1A gén 98 bp és allél NcoI (+) 82 és 16 bp, míg allél TaqÉn (-) IL1B gén 230 bp, allél TaqI (+) 126 és 104 bp.
Statisztikai analízis
Ha másként nem jelezzük, az elemzéshez a the 2 Pearson-tesztet használtuk. A Hardy – Weinberg-disztribúciónak való megfelelés elemzését a népességcsoportra, a χ 2 elemzést a trendre és az OR kiszámítását a helyszíni segédprogrammal végeztük: http://ihg.gsf.de/cgi- bin/hw/hwa1.pl. Feltétel nélküli logisztikus regresszióanalízist használtunk az OR és a konfidencia intervallum (CI) kiszámításához. A Bonferroni korrekciót a többszörös teszteléshez nem használták. A fennmaradó elemzéseket a Statistica 10.0 (StatSoft Inc.) programmal végeztük.
Eredmények
Az e vizsgálatban érintett betegek és kontrollok demográfiai és klinikai jellemzőit az 1. táblázat mutatja be IL1A és IL1B génpolimorfizmusok H. pylori-a krónikus gyomorhurutban fertőzött betegeket minden gén esetében külön végeztük.
Krónikus gyomorhurutban, atrófiával krónikus gyomorhurutban, bélmetapláziával járó krónikus gyomorhurutban és diszpláziával járó krónikus gyomorhurutban szenvedő betegeket a krónikus gyomorhurutban szenvedő betegek egyik csoportjába soroltak. Ez négy csoportot eredményezett a molekuláris elemzéshez: populációs csoport, kontroll csoport elváltozások és fertőzés nélkül H. pylori gyomornyálkahártyában krónikus gyomorhurut H. pylori fertőzések és a bél típusú gyomorrák. A populációs csoport 100 egészséges egyénből állt (50 nő, 50 férfi), amelyeket kifejezetten a vizsgálatokhoz gyűjtöttek. Az életkor megoszlása a népességcsoport között 21-30, a kontrollcsoportban 16-57 és a 11-87 betegcsoportban volt (1. táblázat).
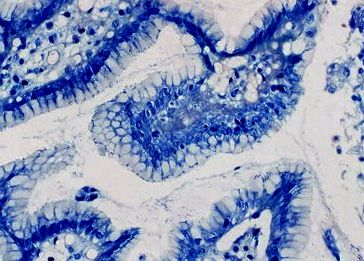
A szövettani vizsgálatokat a korszerűsített Sydney-rendszer szerint végezték négy fokozat felhasználásával. Példák a gyomorhurut különböző stádiumú biopsziás mintáira és H. pylori ábrán mutatjuk be a fertőzést. 1. és 2.
Helicobacter pylori Giemsa-Romanovsky festéssel. H. pylori (a fertőzés közepes stádiuma) a gyomor hámját borító nyákrétegben van (nagyítás × 400)
A nyálkahártya változásainak különböző szakaszaiból származó hematoxilin és eozin festés. a Mérsékelt atrófia (2. fokozat) és mirigyek a bél metaplazia jeleivel (2. fokozat) a pylorusban (nagyítás × 100). b Gyomorrák (tubuláris adenocarcinoma G2-Kubo osztályozás; béltípus: Lauren-osztályozás). Szilárd fészkek, az adenokarcinóma rákos mirigyei (felső) és jóindulatú mirigyek (bal alsó). Rák és gyulladásos beszivárgás a stromában (nagyítás × 400). c Egy mirigy súlyos stádiumú dysplasia jeleivel (3. fokozat; jobb alsó) és jóindulatú mirigyek (bal és felső) (nagyítás × 400). d Krónikus gyomorhurut (2. fokozat). Gyomornyálkahártya gyulladásos infiltrátummal, amely limfocita sejtekből, plazma sejtekből és neutrofil sejtekből áll (nagyítás × 400)
A IL1A és IL1B A genotípus eloszlását, az allél frekvenciákat, a közös nómenklatúrát, a módszertani nómenklatúrát, a genotipizáláshoz alkalmazott módszereket a 2. táblázat foglalja össze. A Human Genome Variation Society által ajánlott módszertani nómenklatúrát alkalmazták (www.hgvs.org). A IL1A és IL1B a genotípus eloszlása Hardy – Weinberg egyensúlyban volt.
Abban az esetben IL1A génpolimorfizmusok nincsenek jelentős különbségek a genotípus eloszlásában és az allél gyakoriságában a fertőzött betegek között H. pylori krónikus gyomorhurutot, krónikus atrófiás gyomorhurutot, bélmetapláziát, diszpláziát vagy gyomorrákot, valamint a kontrollt vagy populációt figyelték meg, akár domináns, akár recesszív öröklődési modellben. Amikor azonban a + 3954C> T polimorfizmusának genotípus-eloszlása IL1B gént ugyanabban a betegcsoportban, kontroll és populációs csoportban elemeztük, szignifikáns különbségeket találtunk az öröklődés domináns modelljében. A + 3954C> T allél T alléljának gyakorisága IL1B a gén magasabb volt a krónikus gyomorhurutban, atrófiában, bélmetapláziában, diszpláziában vagy béltípusú gyomorrákban szenvedő betegek csoportjában (32,1%), összehasonlítva a populációs csoporttal (23%), χ 2 = 4,61 és o = 0,03. Ez megfelel OR: 1,58, 95% CI: 1,04–2,4. A genotípus megoszlást az összes vizsgált csoportban a 3. ábra mutatja be.
A + 3954C> T polimorfizmusának genotípus-gyakoriságainak összehasonlítása IL1B gén a vizsgált populációs és kontrollcsoportos betegcsoportok között. Jelentősen eltérő eloszlást figyeltek meg a krónikus gyomorhurutban szenvedő betegek és a populációs csoport összehasonlításában. VAGY: 1,609; 95% CI: 1,05–2,47; χ 2 = 4,72; o = 0,03
Vita
Jelen tanulmány az IL1A és IL1B polimorfizmusok szerepét és együttélését vizsgálta H. pylori fertőzés a krónikus gastritis kialakulására való hajlamban Nyugat-Lengyelországból származó betegek csoportjában. Először elemeztük a IL1A és IL1B génpolimorfizmusok, mint hajlamosító tényezők, együtt H. pylori fertőzés, az emésztőrendszerben azonos lokalizációjú kóros változásokig.
A rendelkezésre álló metaanalízisek közül nagyon érdekes Wang és munkatársai. (2007), aki 39 vizsgálatból gyűjtött adatokat, amelyek 6863 gyomorrákos esetet és 8434 kontrollt tartalmaztak. Az IL1B – 511T, 231C, 13954T és az IL1RN * 2-hez kapcsolódó gyomorrák kockázatának összesített VAGY értéke 1,26 (95% CI: 1,03–1,55), 1,00 (95% CI: 0,82–1,22), 1,37 (95% CI: 0,94) –2,00), illetve 1,20 (95% CI: 1,01–1,41). Az IL1B – 511T a gyomorrák (béltípus) fokozott kockázatával járt (OR: 1,76, 95% CI: 1,12–2,57). Az IL1RN * 2 a gyomorrák megnövekedett kockázatával is társult a kaukázusiak körében (OR: 1,30, 95% CI: 1,09–1,54).
Újabb metaanalízis, amely tizennégy tanulmányon alapul IL1B +Hat ázsiai és nyolc nem ázsiai populáció adatait lefedő 3954 polimorfizmus mutatta a statisztikai szignifikancia hiányát a vizsgált polimorfizmus jelenléte és a gyomorrák kockázata között. Általánosságban minden eredmény hasonló nagyságrendű volt, amikor az elemzésekre korlátozódtak H. pylori-pozitív esetek és kontrollok (Persson et al. 2011). Az eredmények jelzik az anatómiai hely, a szövettani típus szerinti rétegződés fontosságát, H. pylori fertőzés és származási ország. A vizsgálat minőségi szempontjai - mind laboratóriumi, mind epidemiológiai szempontok - szintén befolyásolhatják az eredményeket, és megmagyarázhatják az eddig közzétett eredmények változékonyságát.
Az IL1B +3954 polimorfizmus más vizsgálataiban a feltételezett-érzékeny T-allél gyenge domináns hatása javasolt. A gyomorrákhoz kapcsolódó IL1B +3954 polimorfizmusokkal kapcsolatban nem találtak szignifikáns összefüggést, de az IL1B +3954 polimorfizmusokkal kapcsolatos támogatható vizsgálatok száma meglehetősen korlátozott, és az összes eredményt rendkívül körültekintően kell magyarázni. Ebben a metaanalízisben az IL1B −511T allél és az IL1RN * 2 változó számú tandem ismétlés (VNTR) szignifikánsan összefügg a gyomor karcinóma kialakulásának megnövekedett kockázatával, és még jelentősebben a nem cardia gyomor karcinómával vagy a bél típusú gyomor karcinómával. Mindkettő jelentősen összefügg a gyomor karcinóma kialakulásának fokozott kockázatával a kaukázusiak körében, de az ázsiaiak és a spanyolok körében nem. Az IL1B – 31C allél vagy a homozigóta CC plusz TT, vagy az IL1B + 3954T allél azonban nem jár a gyomorrák kialakulásának megnövekedett kockázatával, de az IL1B – 31 homozigóta CC plusz TT szignifikánsan fordítottan összefügg a bél típusú gyomorrák kockázatával (Xue és mtsai. 2010).
Meta-analízist Camargo és mtsai. (2006) a IL1B-511T, IL1B-31C, IL1B +3954T, vagy IL1RN * 2 allélek és összefüggésük a gyomorrák kockázatával. Az IL1B + 3954T polimorfizmusok esetében nyolc vizsgálatot említettek: négyet kaukázusiaknál, hármat ázsiaiaknál és egyet spanyoloknál. A T allélt hordozó egyéneknek a C/C genotípussal összehasonlítva a gyomorrák kockázata jelentéktelenül megnövekedett. A szövettani altípus és elhelyezkedés szerinti alcsoport-elemzéseket egyik etnikai csoportban sem végezték el, az SNP-re vonatkozó adatok hiánya miatt. A korlátozás másik típusa a vizsgálatok kevés száma, következésképpen a statisztikai hatalom korlátozottsága volt. Mivel a gyomorrák multifaktoriális betegség, több tanulmánynak a haplotípusok és a gén-környezet kölcsönhatások tesztelésére kell összpontosítania H. pylori fertőzés, mivel ez tovább tisztázhatja ennek a komplex betegségnek a genetikáját (Camargo et al. 2006).
Másrészről a lengyel lakosság körében elvégzett vizsgálataink a IL1B gén + 3954C> T polimorfizmus a gyomornyálkahártya gyulladásos változásaival és a gyomor karcinóma béltípusával együttélő betegeknél H. pylori fertőzés bizonyított ilyen kapcsolatot. Ezért ennek a polimorfizmusnak az előfordulása az IL1B – 31/–511 polimorfizmushoz hasonlóan további kockázati tényezőként kezelhető a gyomornyálkahártya-gyulladás és a karcinogenezis kialakulásában. Ezenkívül figyelembe kell venni más szinergetikusan ható polimorfizmusok létezését is. Úgy tűnik, hogy ezt a sejtést alátámasztják koreai kutatók jelentései (Lee és mtsai 2004). Kimutatták, hogy az IL1B – 1473G hordozókban megnő a bél típusú gyomor karcinóma kockázata.
Gén IL1A három polimorfizmusa van: –889 és 4845 pozícióban, valamint 46 bp-os VNTR-vel a 6. intronban (Dinarello 1996). A gyomor karcinómában szenvedő koreai betegeknél nemrégiben publikált vizsgálatok szerint az IL1A – 889 polimorfizmus előfordulásának nincs összefüggése a gyomor karcinóma kialakulásának kockázatával (Chang és mtsai 2005). Vizsgálataink során értékeltük az IL1A polimorfizmus –889 helyzetben való kapcsolatát a gyomornyálkahártya gyulladásos elváltozásainak és a bél típusú gyomor karcinóma előfordulásának kockázatával az H. pylori. Csak növekvő tendenciát mutatott a C és T allélok előfordulásának gyakorisága, valamint a –889C> T genotípus polimorfizmusai tekintetében. IL1A statisztikai szignifikancia nélküli gén a vizsgált betegcsoportban.
Kutatási eredményeink megerősítik a gének előfordulásának jelentős szerepét IL1 polimorfizmusok a gyomornyálkahártya gyulladásának kialakulásában, valamint a gyomor karcinóma kialakulásában. Figyelembe kell venni továbbá más citokinek (például IL-6, IL-10, TNF-a) génpolimorfizmusainak jelentőségét, valamint más genetikai tényezőket, amelyek szinergikus hatást fejthetnek ki ezen változások kialakulásában. A gyomor karcinóma kialakulásának kockázati szintjének meghatározásakor számos környezeti tényezőt figyelembe kell venni, mint például a sófogyasztás vagy a dohányzás. Egy másik nagyon fontos tényező az adott populáció előfordulásának skálája H. pylori fertőzés. Az egyes környezeti tényezők előfordulásának különbségei jelentős hatást gyakorolhatnak egy adott populációban végzett kutatási eredményekre. Ezért a gyomor karcinóma kockázatának meghatározási pontosságának javítására irányuló kísérleteknek egy adott populációban nagyobb számban kell tartalmazniuk a vizsgált polimorfizmusokat, és figyelembe kell venniük a széles körben ismert környezeti tényezőket, valamint az etnikai és földrajzi különbségeket.
Hivatkozások
Az EUROGAST vizsgálati csoport (1993) Nemzetközi társulás a Helicobacter pylori fertőzés és a gyomorrák között. Az EUROGAST vizsgálati csoport. Lancet 341: 1359–1362
Bakwill F, Mantovani A (2001) Gyulladás és rák: vissza Virchowhoz? Lancet 357: 539–545
- Helicobacter pylori fertőzés, reflux oesophagitis és atrófiás gyomorhurut Felfedezetlen háromszög -
- A Helicobacter pylori megakadályozza a gyomorhurutot a vastagbélgyulladásban
- Helicobacter pylori antitest reaktivitás és vastagbélrák kockázat egy eset-kontroll tanulmányban
- A Helicobacter pylori fertőzés és az alacsony étrendi vas-viselkedés megváltoztatja a vashiányos vérszegénységet,
- A Helicobacter pylori fertőzés súlyosbítja az étrend által kiváltott inzulinrezisztenciát a bélrendszerrel együtt