Kapilláris áramlás
Kapcsolódó kifejezések:
- Diabéteszes retinopátia
- Arteriole
- Fehérje
- Pericyte
- Retina
- Artéria
Letöltés PDF formátumban
Erről az oldalról
Lab-on-a-chip, mikro- és nanoszkálájú immunvizsgálati rendszerek, valamint mikrorayák
Kapilláris áramlás
A szemfenék mikrocirkulációja
Charles E Riva, Leopold Schmetterer, a mikrocirkulációban, 2008
16.2.4 Vérsebesség a retina kapillárisaiban
A hipofluoreszcens szegmensek mozgásán alapuló átlagos perifovealis kapilláris áramlási sebességek, amelyek feltehetően az eritrocita rouleaux képződését és a sejtmentes plazmát képviselik, 1,37 és 3,3 mm/s között mozogtak [43,75,76]. A perifovealis retina kapillárisokban (7–11 μm átmérőjű) mozgó leukociták sebessége pásztázó lézeres oftalmoszkópiával mérve ~ 1,4 mm/s [76]. A kékmezős entoptikus szimulációs technika azt mutatja, hogy e leukociták mozgása pulzáló, átlagos Vleuk, syst/Vleuk, diaszt 2,8 [77], átlagos sebessége fiziológiai körülmények között 0,23 és 1,9 mm/s között mozog [77–89]. .
Sav-bázis, folyadék és elektrolit kezelése
Michael A. Posencheg, Jacquelyn R. Evans, Avery újszülött betegségeiben (Kilencedik kiadás), 2012
Renin-Angiotenzin-Aldosterone rendszer
A vese kapilláris véráramlásának csökkenése serkenti a renin szekrécióját, ami viszont elindítja az angiotenzin termelését. Az angiotenzin érszűkületet, fokozott tubuláris nátrium- és víz-felszívódást, valamint aldoszteron felszabadulást vált ki (Riordan, 1995). Az aldoszteron fokozza a kálium szekrécióját és tovább fokozza a disztális tubulusban a nátrium visszaszívódását; ezért ennek a rendszernek az elsődleges feladata az extracelluláris rekesz térfogatának védelme és a megfelelő szöveti perfúzió fenntartása (Bailie, 1992). Az újszülöttnél azonban hatékonyságát némileg korlátozza az éretlen vese csökkent reakciókészsége e hormonok nátrium- és vízmegtartó hatásaira (Sulyok és mtsai, 1985). A vesében képződő értágító és natriuretikus prosztaglandinok (Gleason, 1987) a fő ellenszabályozó hormonok, amelyek egyensúlyban tartják a renin-angiotenzin-aldoszteron rendszer vese hatásait. Ezért, amikor az indometacin gátolja a prosztaglandin termelést, az aktivált renin-angiotenzin-aldoszteron rendszer nem ellenes vazokonstriktív és nátrium-retenciós hatása hozzájárul a korai csecsemőben a gyógyszer által kiváltott veseelégtelenség kialakulásához (Gleason, 1987; Seri, 1995; Seri és mtsai, 2002).
Folyadék-, elektrolit- és sav-bázis egyensúly
Renin – Angiotenzin – Aldosterone rendszer.
Sav-bázis, folyadék és elektrolit kezelése
Renin-Angiotenzin-Aldosterone rendszer.
A vese kapilláris véráramlásának csökkenése és a juxtaglomeruláris készülékbe jutó tubuláris nátrium bejuttatása serkenti a renin szekrécióját, ami viszont elindítja az angiotenzin termelését. Az angiotenzin vazokonstrikciót vált ki, növeli a tubuláris nátrium- és vízfelszívódást és az aldoszteron felszabadulását (Riordan, 1995). Az aldoszteron fokozza a kálium szekrécióját és tovább fokozza a disztális tubulusban a nátrium visszaszívódását. Így ennek a rendszernek az elsődleges feladata az extracelluláris rekesz térfogatának védelme és a megfelelő szöveti perfúzió fenntartása (Bailie, 1992). Az újszülöttnél azonban hatékonyságát némileg korlátozza az éretlen vese csökkent reakciókészsége e hormonok nátrium- és vízmegtartó hatásaira (Sulyok és mtsai, 1985). Ez is az egyik oka annak, hogy ez a rendszer a születés után több hétig-hónapig aktiválódik, különösen éretlenebb vagy kritikusan beteg újszülötteknél (Godard et al, 1979; Sulyok et al, 1979).
A vesében képződő értágító és natriuretikus prosztaglandinok (Gleason, 1987) a fő ellenszabályozó hormonok, amelyek egyensúlyban tartják a renin-angiotenzin-aldoszteron rendszer vese hatásait. Ezért, amikor az indometacin gátolja a prosztaglandin termelést, az aktivált renin-angiotenzin-aldoszteron rendszer nem ellenes vazokonstriktív és nátrium-retenciós hatása hozzájárul a korai csecsemőben a gyógyszer által kiváltott veseelégtelenség kialakulásához (Gleason, 1987; Seri, 1995; Seri és mtsai, 2002).
Vese és az alsó húgyúti traktus
Megnövekedett glomeruláris szűrési arány
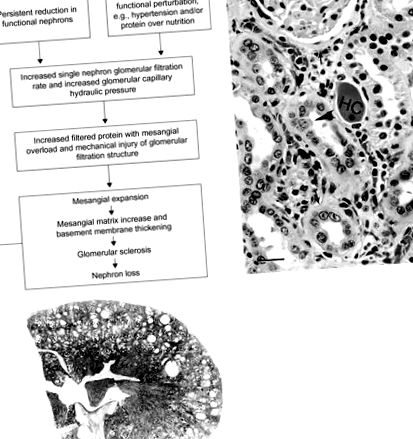
A glomeruláris kapilláris áramlásának állandó emelkedése glomeruláris sérülést okoz, amelyet mesangiális expanzió és proteinuria jellemez, és fokális glomeruláris szklerózisra fejlődik. Két, egymással összefüggő, de potenciálisan önállóan ható, sérülést okozó hemodinamikai funkcionális változás közé tartozik az egyetlen nephron glomeruláris szűrési sebesség (SNGFR) és a glomeruláris kapilláris hidraulikus nyomás (GCHP) növekedése. A megnövekedett SNGFR és GCHP dezoxikortikoszteron injekcióval és sóoldattal, mint ivóvízforrással indukálható, amely modell a hipertónia kiváltására.
A megnövekedett SNGFR vagy GCHP mellett a hiperszűrő nephronban várhatóan megnő a plazmafehérje transzglomeruláris forgalma. A glomeruláris filtrációs gát fehérje túlterheltsége a magas vérnyomásban a glomeruláris sérülés mediátorának számít. Ezzel párhuzamosan a megnövekedett kapilláris hálózat hidraulikus nyomása mechanikusan sértheti a glomeruláris kapilláris szerkezetét. Az alacsony fehérjetartalmú étrend megakadályozza az SNGFR és a GCHP növekedését, és ezáltal megvédi a hipertóniás patkányokat a károsodás kialakulásától (proteinuria és glomeruláris morfológiai elváltozások, 11.8B. Ábra). Az étkezési fehérje csökkenése a normál patkányban az SNGFR és a GCHP csökkenéséhez vezet. Az étrendi fehérje fontos szerepet játszik a vesekárosodás kialakulásában és előrehaladásában. Az étkezési fehérje növekedése a veseméret és a GFR növekedését okozhatja, későbbi glomeruláris sérüléssel, mesangiális lerakódások felhalmozódásával és végül glomerulosclerosissal.
Legalább részben a fehérje túlzott táplálkozásával társulva krónikus progresszív nephropathia (CPN) fordul elő majdnem mind a kétéves hím laboratóriumi patkányokban (lásd alább), a nőstény patkányok kevésbé érintettek. Ezeket az elváltozásokat jelentősen csökkentik a fehérje vagy az étrend teljes fogyasztásának korlátozása. Az embereknek a nefronok 10-30% -ának glomeruláris szklerózisa is van az élet negyedik és nyolcadik évtizede között.
A vese tömegének csökkenése az SNGFR és a GCHP növekedését is eredményezi a parenchymában, kompenzációs válaszként a vesefunkció fenntartására. A vese tömegének csökkenése morfológiailag nephron sérülést eredményez, amely morfológiailag hasonló a magas vérnyomáshoz és a fehérje túlzott táplálkozásához. Az étkezési fehérje csökkentése jelentősen csökkenti a betegség súlyosságát és progressziójának sebességét a maradék parenchymában.
A csökkent vesetömeg egyedi nephron hiperfiltrációval, az azt követő mesangiális expanzió és a további nephron veszteséggel járó szklerózis tehát a progresszív veseelégtelenség végső közös útját jelenti, függetlenül az elsődleges sérülési mechanizmustól (11.9. Ábra). Az étkezési fehérje korlátozása ennek megfelelően univerzálisan előnyös a krónikus progresszív vesebetegségek enyhítésében, függetlenül a kiváltó tényezőktől.
11.9. Ábra (A) A krónikus progresszív nephropathia patogenezise. (B) 2 éves Sprague – Dawley patkány vese, bemutatva a krónikus progresszív nephropathia jellemzőit, beleértve a hyalin gipszeket (HC), a megvastagodott alapmembránt (nyilak) és a regeneratív proximális tubulus hámot (nyílhegy). Interstitialis gyulladásos sejtek is jelen vannak (Bar = 32 μm). (C) Subgross fotomikrográf egy 2 éves Sprague – Dawley patkány veséjéről, amely súlyos krónikus progresszív nephropathia cisztás változásait szemlélteti. Rúd = 1 mm.
Rendszerek toxikológiai patológiája
Megnövekedett glomeruláris szűrési arány
A Fawn csuklyás patkányoknál, elsősorban a hímeknél, spontán alacsony reninszintű magas vérnyomás alakul ki, amely a kallikrein csökkent vizeletürítésével jár együtt már 2 hónapos korban, majd progresszív glomerulosclerosis vagy krónikus progresszív nephropathia és proteinuria már 3 hónapos korban. A megnövekedett SNGFR vagy GCHP mellett a hiperszűrő nephronban várhatóan megnő a plazmafehérje transzglomeruláris forgalma. A glomeruláris filtrációs gát fehérje túlterheltsége a magas vérnyomásban a glomeruláris sérülés mediátorának számít. Ezzel egyidejűleg a megnövekedett kapilláris hálózati hidraulikus nyomás mechanikusan sértheti a glomeruláris kapilláris szerkezetét. Az alacsony fehérjetartalmú étrend megakadályozza az SNGFR és a GCHP növekedését, és ezáltal megvédi a hipertóniás patkányokat a sérülések kialakulásától (proteinuria és glomeruláris morfológiai elváltozások). Az étkezési fehérje csökkenése a normál patkányban az SNGFR és a GCHP csökkenéséhez vezet. Az étrendi fehérje fontos szerepet játszik a vesekárosodás kialakulásában és előrehaladásában. Az étkezési fehérje növekedése a veseméret és a GFR növekedését okozhatja, későbbi glomeruláris sérüléssel, mesangiális lerakódások felhalmozódásával és végül glomerulosclerosissal.
Legalább részben a fehérje túlzott táplálkozásával társul, a CPN szinte minden 2 éves hím laboratóriumi patkányban előfordul. A nőstény patkányok hasonló változást mutatnak, de alacsonyabb az előfordulásuk és lassabb a progresszió, valószínűleg az alacsonyabb táplálékfogyasztás miatt. Ezeket az elváltozásokat patkányban jelentősen csökkentik a fehérje vagy a teljes táplálékfogyasztás korlátozása. A CPN iránti érzékenység genetikailag befolyásolható, de a patkányokban nem ismerik el, hogy törzs-specifikusak, bár a súlyosság laboratóriumok és törzsek szerint változó. Mivel a standard laboratóriumi rágcsáló-étrendeket úgy fejlesztették ki, hogy elősegítsék az érés alatti gyors növekedést, és támogassák a vemhességet vagy a laktációt, az étrendek felesleges fehérjét és kalóriát tartalmaznak az érettség elérése utáni karbantartási igényekhez. A laboratóriumi patkányokban végzett túlélés nemcsak módosító tényező, hanem feltehetően ok-okozati tényező is a spontán CPN előfordulásában (lásd még: Táplálkozási toxikológiai patológia, 36. fejezet). A keringő aldoszteronszint emelkedését összefüggésbe hozták a sejtek replikációs gyakoriságának növekedésével a patkány veséjében, amely szerepet játszik a CPN kialakulásában.
A vese tömegének csökkenése az SNGFR és a GCHP növekedését is eredményezi a vese parenchymában, mint kompenzációs válasz a vesefunkció fenntartására. A megnövekedett SNGFR és GCHP akkor is bekövetkezhet, ha a vese tömegének elégtelen csökkenése a csökkent GFR és akut veseelégtelenség kialakulásához vezet, ami azt jelzi, hogy a GFR értékek nem feltétlenül tükrözik az SNGFR-t. Hormonok, például glükagon és prosztaglandinok gyaníthatóan közvetítői ezeknek az intrarenalis hemodinamikai változásoknak. A vese tömegének csökkenése morfológiailag nephron sérülést eredményez, amely morfológiailag hasonló a magas vérnyomáshoz és a fehérje túlzott táplálkozásához. Az étkezési fehérje csökkentése jelentősen csökkenti a betegség súlyosságát és progressziójának sebességét a maradék parenchymában.
A csökkent vesetömeg egyedi nephron hiperfiltrációval, az azt követő mesangiális expanzió és a további nephron veszteséggel járó szklerózis tehát a progresszív veseelégtelenség végső közös útját jelenti, tekintet nélkül az elsődleges sérülési mechanizmusra. Az étkezési fehérje korlátozása univerzálisan előnyös a krónikus progresszív vesebetegségek enyhítésében, a kiváltó tényezőktől függetlenül.
Vékony rétegű kromatográfia | Alapelvek
Kényszerített áramlás
Üveg: Szol – gél bevonatok
1.3 Kapilláris áramlás
A lapos szubsztrátumokat egyenletesen bevonhatjuk a kapilláris áramlás (vagy lamináris áramlás) eljárással is. Az oldatot vízszintes résfelhordó csőbe vagy porózus csőbe pumpálják, ahonnan a résen vagy a pórusokon keresztül a felszínre áramlik, és kívülről folytonos folyékony filmet képez. Az aljzatot érintkezésbe hozzuk a folyékony fóliával, és két meniscus képződik. A hordozót az applikátorcsőhöz képest simán mozgatjuk, és a nedvesített felületen filmréteg ül le. Ez a technika elvileg hasonló a merítéses bevonathoz, de sokkal kisebb oldattartályt igényel.
- Az elhízás terhe - áttekintés a ScienceDirect témákról
- Antiallergiás - áttekintő ScienceDirect témák
- Mell Fibroadenoma - áttekintés a ScienceDirect témákról
- Aphthous Stomatitis - áttekintés a ScienceDirect témákról
- Antifolate - áttekintés a ScienceDirect témákról