Antifolátum
A folát antagonisták jól szolgálták az orvostudományt, és ezt továbbra is biokémiai próbaként kell szolgálniuk, miközben klinikailag fontos gyógyszerek maradnak a daganatos és nem daganatos betegségekben szenvedő betegek kezelésében.
Kapcsolódó kifejezések:
- Enzim
- Fehérje
- Hasmenés
- Metotrexát
- Toxicitás
- Hányinger
- Dihidrofolát-reduktáz
- Folsav
Letöltés PDF formátumban
Erről az oldalról
A kemoterápia és a sugárzás kölcsönhatása
Christopher Douglas Willey,. James A. Bonner, a Klinikai Sugárzás Onkológiában (negyedik kiadás), 2016
Antifolátumok: Metotrexát, Trimetrexát és Pemetrexed
Az antifolát, a metotrexát szorosan megköti a dihidrofolát-reduktázt (DHFR), ezáltal gátolja a folát anyagcserét. Ezen gátlás révén blokkolják a timidilát szintézist és így a purin bioszintézisét. Ezenkívül bizonyos aminosav szintézis károsodhat ezen enzim blokkolása révén, ami citotoxicitást eredményez. A Pemetrexed egy pirrolopirimidin, amely antifolátként működik, és több enzimet gátol, beleértve a timidilát-szintázt, a dihidrofolát-reduktázt, a glicinamid-ribonukleotid-formil-transzferázt és az amino-imidazol-karboxamid-formil-transzferázt sejttől független módon. A pemetrexed számos szilárd daganat ellen hatásos, és a preklinikai rendszerekben megfelelő módon sugárérzékenyítést mutatott. 44,45,46
Fejlődési rendellenességek
Folsav-antagonisták
Korábban a folsav antagonistákat, amelyekről ismert, hogy nagyon embrioletálisak, klinikai vizsgálatokban mint abortorítók (abortuszt okozó szerek). Noha a terhességek háromnegyedét megszakították, a tartósan életben maradt embriók csaknem egynegyede súlyosan rosszul alakult. Az embriotoxikus folsav-antagonista klasszikus példája aminopterin, amely több súlyos anomáliát eredményez, mint például anencephalia, növekedési retardáció, ajak- és szájpadhasadék, hydrocephalia, hypoplasticus állcsont és alacsony fülű fülek. A folsav-antagonisták ezen drámai hatásai hangsúlyozzák az étrendben a megfelelő mennyiségű folsav fontosságát a normális fejlődés elősegítése érdekében.
A timidilát-szintáz megcélzása antifolát gyógyszerekkel a rák kezelésében
ANN L. JACKMAN,. MATTHEW NG, a rákellenes gyógyszerek tervezésében és felfedezésében, 2008
9.7.1 Preklinikai
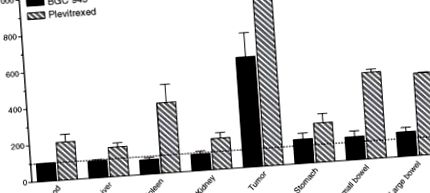
A KB sejtekben a növekedés gátlására szolgáló BGC 945 IC50 ~ 3 nM, és ez ~ 5 μM-re növekszik, ha 1 μM folsavat adunk hozzá, hogy versenyképesen gátoljuk a BGC 945 kötődését az α-FR-hez. A folsav nagyon alacsony affinitással rendelkezik az RFC iránt (> 100 μM), így 1 μM nem gátolja a standard antifolát gyógyszerek RFC által közvetített felvételét. A 9.1. Táblázat összehasonlító adatai azt mutatják, hogy a BGC 945 mennyire célzottabb az α-FR-pozitív KB sejtekhez képest, mint a többi antifolát. Hasonló tapasztalatot tapasztaltunk az α-FR-vel (A431-FBP) transzfektált A431 sejteknél is (9.1. Táblázat, 9.3. Ábra). Az α-FR alacsonyabb szintjét expresszáló tumorsejtek szintén érzékenyek a BGC 945-re, bár a nagyon alacsony expresszáló vonalaknak előnyös a gyógyszer hosszú expozíciója, hogy növeljék a receptor által közvetített endocitózis és a gyógyszer felhalmozódásának körét (Gibbs et al., 2005 ).
9.4. ÁBRA A BGC 945 és a plevitrexed hatása a [125 I] dUrd biodisztribúciójára KB tumoros egerekben. [125I] dUrd egy Thd analóg, és a TK aktivitása révén beépül a DNS-be. A fokozott beépülés a TS gátlásának markere (részletek: Gibbs et al., 2005). [125 I] dUrd-t 24 órával injektáltunk egerekbe 100 mg/kg 6R, S-BGC 945 (szilárd rúd) vagy 100 mg/kg plevitrexed (csíkos rúd) után. A szöveteket 24 órával később gamma-számlálás céljából eltávolítottuk, és az eredményeket százalékos kontrollértékként adtuk meg.
Az egerek plazma Thd szintjére vonatkozó óvatosságok ellenére tumorellenes vizsgálatokat végeztek KB tumort hordozó egereken. A 14 napos napi adagolás (100 mg/kg) körülbelül 5 napos növekedési késést váltott ki két független kísérletben (nem publikált adatok). A BGC 945 jelenleg preklinikai fejlesztés alatt áll.
A gyorsított ateroszklerózis és az érsérülések patogenezise a szisztémás lupus erythematosusban
Metotrexát
A folsav-antagonista metotrexát (MTX) számos gyulladáscsökkentő hatást mutat, és számos autoimmun betegség, így RA, pikkelysömör és SLE kezelésében hatékonynak bizonyult. 163 Az MTX-ről kimutatták, hogy gátolja a T-sejtek proliferációját, csökkenti az adhéziós molekulák expresszióját, és modulálja a citokinek és MMP-k termelését. A gyulladásos vasculopathia egérmodelljében az MTX beadása szignifikánsan csökkentette az intramyocardialis vasculopathiát és a végszervek károsodását. 166 Az MTX autoimmun betegségekben szenvedő betegeknél is kardioprotektív hatásokat mutatott be. Az MTX szerepe a CVD megelőzésében SLE-ben szenvedő betegeknél azonban még meghatározandó.
Nukleotid metabolizmus
A folát-bioszintézis gátlása
A szintetikus antifolát gyógyszerek, mint például a trimetoprim, sok baktériumra mérgezőek, és bakteriális fertőzések kezelésére szolgálnak. Az analógok hatásos inhibitorai a dihidrofolát-reduktáznak, az enzimnek, amely katalizálja a dihidrofolát redukcióját tetrahidrofoláttá. Ez az egyetlen reakció, amely révén a timidilát szintézisében képződő dihidrofolát tetrahidrofoláttá alakítható. A trimetoprimmal szemben rezisztens mikroorganizmusok túltermelik a timidilát-szintázt vagy a dihidrofolát-reduktázt. A szulfonamid (például szulfametoxazol), a p-amino-benzoesav szerkezeti analógja és a trimetoprim vagy hasonló analógjai kombinációja a baktériumok szaporodásának hatékony gátlója, és olyan baktériumok fertőzésének kezelésében alkalmazzák, mint az E. coli és a Salmonella. Ezek a vegyületek együttesen úgy hatnak, hogy kimerítik a tetrahidrofolát-származékok intracelluláris szintjét, ami nukleotidhiányt eredményez.
Gyógyszer-rezisztencia
Lori Hazlehurst, Miles Hacker, a farmakológiában, 2009
15.2.1.2 Kábítószer-felvételi fehérjék a drogrezisztenciában
A klasszikus antifolát metotrexát MTX továbbra is fontos összetevője a kemoterápiás fegyverkezésnek számos rák esetében, ideértve a gyermekkori ALL-et, az oszteogén szarkómát, a limfómát és az emlőrákot. A Raltitrexedet, egy másik anti-folátot, az Egyesült Államokon kívül a világ nagy részén használják előrehaladott vastagbélrák kezelésére. Végül a Pemetrexed-et 2004-ben engedélyezték a pleurális mesothelioma kezelésére, majd röviddel ezután a nem kissejtes tüdőrák második vonalbeli kezelésére. Ezek a gyógyszerek utánozzák a természetes folátmolekulát, és ezzel a membránhoz kötött redukált foláthordozó (RFC) fehérjerendszert használják a sejtbe jutáshoz.
Az RFC-nek aktívan elegendő mennyiségű kötetlen gyógyszert kell szállítania ahhoz, hogy intracelluláris hatóanyag-koncentrációkat biztosítson a céldihidrofolát-reduktáz (DHFR) enzim gátlásának fenntartásához és a poliglutamált antifolátok szintéziséhez, ezeknek a gyógyszereknek a tárolási formájához. Az irodalomban 1962 óta említik a csökkent RFC-expresszió miatti antifolát-rezisztenciát, amely azóta a klasszikus antifolátokkal szembeni ellenálló képesség fontos mechanizmusává vált.
Az RFC funkció elvesztése a fehérje csökkent expressziójának és ezáltal a membránhoz kötött RFC szintjének csökkenésével következhet be. Miután az RFC-t klónozták, nyilvánvalóvá vált, hogy az RFC transzportjának és az antifolát-rezisztenciának az elvesztése mélyen összefügg az mutációkkal az RFC-ben. Ezek a mutációk a gyógyszer szállításának csökkenését vagy a gyógyszer szállításának elmaradását és a folát transzport hatalmas növekedését eredményezték. Mivel az antifolátok versenyben vannak a DHFR megkötéséért normál redukált folátokkal, a fokozott foláttranszport ugyanolyan előnyt jelent a sejteknek, mint a csökkent antifoláttranszport.
Autofág sejthalál kiváltása rákellenes szerekkel
Antimetabolitok
Az antifolát és antimetabolit pemetrexedet már klinikailag használják nem kissejtes tüdőrák (NSCLC) kezelésére. A pemetrexed megzavarja a sejtek metabolizmusát, és megemelkedett 5-amino-imidazol-4-karboxamid-1-b-D-ribofuranozil-monofoszfát (ZMP) szinthez vezet, ami az AMPK aktivációjához vezet, ami viszont inaktiválja az mTORC1-et. A végeredmény fokozott autofágia. Kimutatták, hogy az emlőrákos sejtek pemetrexed-kezelése csökkenti a sejtek életképességét, ezt a hatást blokkolta a 3-MA vagy a BECN1 leütése (Bareford et al., 2011). A pemetrexed és egy másik autofágia induktor, a rapamicin kombinációja tovább fokozta a pemetrexed toxicitását több daganatsejt-típusban.
Az anyagcsere másik modulátora a 3-bróm-piruvát (3-BP). A sejtekbe történő felvétel után az oldott hordozó 16-os családon keresztül (SLC16) a 3-BP gátolja a mitokondriális légzőrendszer (szukcinát-dehidrogenáz) komplexét a normális szubsztrát-piruvát helyettesítésével. A 3-BP kezelés az ATP-szint csökkenését, a reaktív oxigénfajok (ROS) képződését és az anyagcsere-oxidatív stresszt eredményezi, ami sejthalálhoz vezet. Ezt a hatást akár a rákos sejtek előzetes glutamin-éheztetése is felerősítheti, megkönnyítve ezzel a 3-BP sejtfelvételét. A glutamin megvonása után a 3-BP által kiváltott karcinóma sejthalált nem apoptózis útján hajtották végre, hanem az ACD jellemzőit mutatta, amit az autofág fluxus növekedése és a sejthalál kémiai (3-MA) vagy genetikai (siRNS- mediált Atg5 leütés) gátlása az autofág gépezetnek (Cardaci és mtsai, 2012). A 3-BP és ROS által stimulált ACD közvetítésében feltételezett jelölteknek javasolták a mitogén-aktivált protein-kináz 8-t (MAPK8/JNK), az AMPK-t és a halálhoz társuló protein-kinázt (DAPK1).
A fekélyes vastagbélgyulladás jelenlegi orvosi terápiái
Matthew Cheah, MD, Reena Khanna, MSc, Pouchitis és Ileal Pouch Disorderekben, 2019
Metotrexát
Folsav-antagonista, az MTX elsősorban a dihidrofolát-reduktáz gátlásán keresztül játszik szerepet, amely kulcsfontosságú enzim a purinok és pirimidinek előállításának szintetikus útjában [72]. Tekintettel arra, hogy a betegek legfeljebb egyharmada nem reagál a tiopurinokra, és legfeljebb 15% nem képes elviselni ezeket a szereket a mellékhatásoktól, alternatív szteroid-megtakarító szerként MTX-t alkalmaznak [73]. Az eddigi egyetlen placebo-kontrollos vizsgálatban Oren és mtsai. retrospektív összehasonlítást végzett, összehasonlítva az MTX-t a placebóval UC-ben. 9 hónap elteltével nem volt szignifikáns különbség a remisszió indukciójában és fenntartásában [74]. Korlátozott mennyiségű adat támasztja alá az MTX-t hatékony kiegészítő szerként szteroidfüggő egyéneknél. Egy kis tanulmány megállapította, hogy az orális MTX 15 mg/hét dózisban lehetővé tette a kortikoszteroidok használatának akut csökkentését, bár ezt a 76 hetes követés végéig nem tartották fenn. Mint fentebb említettük, Maté-Jiménez et al. összehasonlították a 6-MP, MTX és 5-ASA-t a remisszió indukciójával és fenntartásával UC-ben szenvedő szteroidfüggő betegeknél. Itt a 6-MP-t jelentették az MTX-nél és az 5-ASA-nál hatékonyabb szerként mind a remisszió indukciójában, mind a remisszió fenntartásában [64]. .
Tekintettel az MTX korai kísérleteiben alkalmazott viszonylag alacsony dózisokra, Carbonnel és mtsai. a METEOR vizsgálatban arra keresték a választ, hogy a parenterális MTX magasabb dózisa (25 mg/hét) hatékony-e, mint a placebo a szteroidmentes remisszió kiváltásában 16. héten 111 szteroidfüggő UC-s betegben. Sajnos a vizsgálat nem érte el a statisztikai szignifikanciát elsődleges végpontjában (MTX 31,7% vs placebo 19,6%, P = 0,15), bár egy alcsoport elemzés szerint az MTX csoportban a betegek nagyobb százaléka érte el a szteroidmentes remissziót, ami kevesebb megvonás a terápiából (41,7% vs 23,5%, P = 0,04) [75]. Jelenleg számos vizsgálat folyik a parenterális MTX hatékonyságának további vizsgálatára a szteroidmentes remisszió elérésében [76, 77] .
- Az elhízás terhe - áttekintés a ScienceDirect témákról
- Antiallergiás - áttekintő ScienceDirect témák
- Aszkorbinsav - áttekintés a ScienceDirect témákról
- Epevezeték-diszkinézia - áttekintés a ScienceDirect témákról
- Mell Fibroadenoma - áttekintés a ScienceDirect témákról