Metabolikus szindróma krónikus vesebetegségben szenvedő gyermekeknél és vesetranszplantáció után
Mieczysław Litwin
Nefrológiai és artériás hipertóniás osztály, The Children's Memorial Health Institute, Varsó, Lengyelország
Anna Niemirska
Nefrológiai és artériás hipertóniás osztály, The Children's Memorial Health Institute, Varsó, Lengyelország
Absztrakt
Bevezetés
Asztal 1
A metabolikus szindróma definíciói, amelyeket a Felnőtt Kezelő Testület (ATP) és a Nemzetközi Diabétesz Szövetség (IDF) adott ki
| Központi elhízás (derékkörfogatként definiálva etnikum-specifikus értékekkel) | Az alábbiak közül legalább három: | |
| ÉS az alábbiak bármelyike: | ||
| • Trigliceridek:> 150 mg/dl (1,7 mmol/l), vagy a lipid rendellenesség speciális kezelése | • Központi elhízás: derék kerülete ≥ 102 cm vagy 40 hüvelyk (férfi), ≥ 88 cm vagy 36 hüvelyk (nő) | |
| • HDL-koleszterin: 130 vagy diasztolés BP> 85 Hgmm, vagy korábban diagnosztizált magas vérnyomás kezelése | • Dyslipidemia: HDL-C 100 mg/dl (5,6 mmol/l), vagy korábban diagnosztizált 2-es típusú cukorbetegség | • Vérnyomás ≥ 130/85 Hgmm |
| • Éhomi plazma glükóz ≥ 6,1 mmol/l (110 mg/dl) | ||
| Ha az FPG értéke> 5,6 mmol/l vagy 100 mg/dl, akkor erősen ajánlott orális glükóz tolerancia teszt, de nem szükséges a szindróma jelenlétének meghatározásához | ||
| Ha a BMI> 30 kg/m 2, akkor feltételezhető a központi elhízás, és a derék kerületét nem kell mérni |
HDL nagy sűrűségű lipoprotein; BP vérnyomás; BMI testtömegindex
2. táblázat
A metabolikus szindróma meghatározása gyermekeknél - IDF kritériumok
| 6-16 | Használja a meglévő IDF-kritériumokat felnőttek számára: | ||||
| Központi elhízás (a derékbőség kerülete ≥ 94 cm az Europid férfiaknál és ≥ 80 cm az Europid nőknél, más csoportok etnikai jellemzőivel) | |||||
| plusz a következő négy tényező bármelyike: | |||||
| • emelkedett trigliceridszintek: ≥ 1,7 mmol/l | |||||
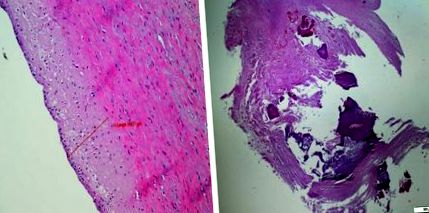
| csökkent HDL-koleszterinszint: 1). A folyamat diffúz és az egész artériás fára hat. Az urémiás arteriopathia fő kockázati tényezője az alacsony glomeruláris filtrációs ráta (GFR), annak következményeivel, mint például a másodlagos hiperparatiroidizmus, amely kalcium- és foszfát-homeosztázis zavarokhoz vezet. Az urémiás arteriopátia patogenezisének döntő lépése az érfal simaizomsejtjeinek differenciálódásának folyamata az artériás fal mediális rétegében osteoblastszerű sejtekké [35–38]. Az arteriopathia a dialízis kezdetével felgyorsul, és az életkor előrehaladtával növekszik [38, 39]. Kísérleti vizsgálatok kimutatták, hogy az atherogén étrend hiperlipidémiát okozott mind subtotally nephrectomizált, mind ál-operált patkányokban, de inkább urémiás patkányokban. Azonban a VLDL és az LDL koleszterin koncentrációjának növekedésével járó hiperlipidémia ellenére a lipidek koncentrációja nem nőtt az urémiás patkányok artériás falain [40]. A normál vesefunkcióval elhunyt betegek koszorúereinek és a dializált betegek artériáinak összehasonlítása azt mutatta, hogy az urémiás betegeknél nagyobb volt a koszorúerek mediális rétegének vastagsága. Ezenkívül az urémiás betegek elváltozásait meszes plakkok és kisebb számú extracelluláris lipid lerakódások jellemezték [41]. Az urémiás betegek aortáiban szintén magasabb volt a kalcium- és foszfortartalom, és nagyobb volt az osteoblast fenotípus transzformáció markereinek expressziója, még a nem meszes területeken is, mint a nem urémiás betegek aortáiban. A fetuin A kisebb mértékű lerakódása kísérte urémiás aortákban, ami azt jelzi, hogy a kalcifilaxis természetes inhibitorainak rendszere részt vesz az urémiás arteriopátia patogenezisében [42]. Urémiás arteriopathiás gyermekeknél a carotis intima media vastagságának növekedése (cIMT) és a közös carotis artéria merevsége korrelál a csökkenő GFR-rel [35]. Bár az alacsony HDL-koleszterinszint, az apoproteinek A és B korreláltak a cIMT-vel, ezek közül a tényezők közül egyiket sem találták az IMT független prediktoraként. | |||||
Bal urémiás arteriopathia. A 20 éves fiú aortafala 8 éven át dializált. Az aortafal közegének megvastagodása. Normál endothelium. A veseartéria jobb ateroszklerózisa 60 éves férfiban (Dr. W. Grajkowska jóvoltából)
Az urémiás kardiomiopátia kialakulásának alapja a diffúz intermyocardiocyta fibrózis (2. ábra). Az urémiás kardiomiopátia fő kockázati tényezői megegyeznek az urémiás arteriopátiával, és mind az urémiás arteriopátia, mind a kardiomiopátia a hagyományos CV rizikófaktorokkal eltúlzottak és a CKD 5. stádiumában felgyorsulnak [43].
Bal normális szívizom. A 13 éves lány jobb szívizombiopsziája 5 éven át dializált. A szívizomsejtek hipertrófiája (nyilak). Diffúz intermyocardiocyta fibrózis (kettős nyilak) és steatosis. A kötőszövet mennyisége - 3% (normál 1%) (Dr. W. Grajkowska jóvoltából)
Az urémia és az SM-re jellemző, az ateroszklerózishoz vezető metabolikus rendellenességek által okozott CV-szövődmények különböző kóros alapjai magyarázzák az ateroszklerotikus gyógyszerek kezelésének eltérő eredményeit a CKD stádiumához viszonyítva.
A metabolikus szindróma prevalenciája gyermekek és serdülők körében.
Az IDF definícióját felhasználva az USA Nemzeti Egészségügyi és Táplálkozási Felmérésének 1999–2004 közötti adatai azt mutatták, hogy a 12–17 éves serdülők között az SM prevalenciája 4,5% volt. A 12 éves 1,2% -ról a 16–17 éves 7,1% -ra nőtt [44]. Az Európai Ifjúsági Szívvizsgálatban az IDF szerint meghatározott SM prevalenciája 0,2% volt a 10 éves gyermekeknél és 1,4% a 14 éves gyermekeknél [45]. Hasonló adatokat közöltek a SM 10 éves gyermekek körében elterjedtségéről Görögországban [46]. Lengyelországban a városi népességből származó serdülők körében az SM előfordulása 1,4 és 2,2% között mozgott, de a PH-s gyermekek körében tízszer magasabb volt, mint az általános népességnél, és 15 és 20% között mozgott [6, 8].
A metabolikus rendellenességek és a metabolikus szindróma prevalenciája CKD-ben
Anyagcsere-rendellenességek, a testösszetétel változásai növekedési kudarccal, az LBM csökkenése és a zsigeri zsír növekedése korrelál a csökkenő GFR-rel. Viszont viszonylag kevés adat áll rendelkezésre az SM prevalenciájáról CKD-s gyermekeknél. A CKD-ben szenvedő gyermekek alacsonyabbak, és súlyuk viszonylag nagyobb, mint az egészséges gyermekeknél, ami a CKD 3. stádiumából kitűnik [47–49]. Ezt a hatást ma már a környezeti és életmódbeli változások modulálják, és beszámoltak arról, hogy a CKD-s gyermekek többnyire túlsúlyosak, mint két évtizeddel ezelőtt [50, 51]. A diszlipidémia és a glükóz intolerancia a CKD tipikus metabolikus rendellenességei. A CKID-tanulmány jelentései azt mutatják, hogy a CKD 2–4 stádiumú gyermekeknél a legjellemzőbb rendellenesség a hipertrigliceridémia [52]. Becslések szerint a GFR minden 10 ml/perc/1,73 m 2 csökkenése a TTG szérumkoncentrációjának 8% -os, az LDL koleszterin koncentráció 2% -os és a HDL koleszterin koncentráció 3% -os növekedésével járt. . Proteinuria társult ezekhez a rendellenességekhez, és nephrotikus proteinuria-ban szenvedő gyermekeknél kétszer gyakrabban fordultak elő, mint a nem proteinurikus gyermekek.
Metabolikus szindróma gyermekeknél veseátültetés után
Az urémia okozta metabolikus rendellenességek normalizálása, sőt az urtériás artériás és szívkárosodás Rtx utáni visszafordulása az átültetett vese GFR-jétől függ [57, 58]. A szervek kilökődésének megelőzésére szolgáló immunszuppresszív terápia ugyanakkor jelentős anyagcsere-rendellenességeket is okoz, mint például az érelmeszesedéses diszlipidémiát, az IR-t, valamint az újszülött cukorbetegség kockázatát transzplantáció után (NODAT). Ezeket az MS-re jellemző rendellenességeket zsigeri elhízás és az LBM csökkenése kíséri. Ezért az eredmény függ a GFR-től és az immunszuppresszív gyógyszerek mellékhatásaitól.
Az SM átlagos prevalenciája felnőtteknél Rtx után körülbelül 60–70%. Az elhízás az SM kialakulásának fő kockázati tényezője az Rtx után, és az SM növeli a CV kockázatát [59, 60]. A gyermekgyógyászati vizsgálatok átlagolt eredményei azt mutatják, hogy az SM prevalenciája az Rtx után szignifikánsan növekszik, és magasabb az általános populációhoz és a dializált gyermekeknél. Wilson és mtsai. arról számoltak be, hogy az SM prevalenciája az Rtx után egy évvel gyermekekben 37,6% volt, és kétharmadukban de novo alakult ki MS [61]. Höcker és mtsai. megállapította, hogy az SM Rtx utáni előfordulása az Rtx-től és a kortikoszteroidok (CS) használatától függ, és az Rtx utáni első hónapokban 40% -tól 2 év után 20% -ig terjedt [62].
Az SM-ben szenvedő Rtx utáni gyermekeknél szintén nagyobb volt a bal kamrai tömeg, és 55% -ukban fejlődött ki a bal kamrai hipertrófia, szemben SM-vel nem rendelkező 32% -kal [61]. Az elhízásra és az SM-re jellemző excentrikus bal kamrai hipertrófiát az SM-ben szenvedő gyermekek 34% -ánál találták, míg SM-ben nem szenvedő gyermekek 15% -ánál.
Az Rtx utáni MS alacsonyabb graft túlélési arányokkal jár [63, 64]. Maduran és mtsai. beszámolt arról, hogy a CS használatától függetlenül az SM-ben szenvedő gyermekek GFR-je is szignifikánsan alacsonyabb volt [65].
A CS döntő szerepet játszik az SM Rtx utáni patogenezisében. Höcker és mtsai. kimutatta, hogy azoknál a betegeknél, akiknél a kortikoszteroidokat kivonták, az SM prevalenciája 1 év után 5% -ra csökkent [62]. Hasonlóképpen, az SM tényezőknek való kitettség ebben a csoportban szignifikánsan csökkent, összehasonlítva a gyermekekkel, akiknél a CS kezelés folytatódott. Nagyobb dózisú CS alkalmazása a HLA illesztési és elutasítási epizódok származéka. Megállapították, hogy az SM prevalenciája háromszor alacsonyabb volt az élő donor graftok befogadói között, mint a cadaver donor graftok befogadói között [66].
Az Rtx után a CS legsúlyosabb metabolikus szövődménye a NODAT. Úgy tűnik, hogy az Rtx után a NODAT első leírását Starzl adta 1964-ben [67]. Bár az azatioprin használata hasnyálmirigy-sérüléssel is jár, úgy tűnik, hogy a NODAT prevalenciája jelentősen megnőtt a kalcineurin inhibitorok (CNI) bevezetésével a XX. Század nyolcvanas éveinek közepén [68]. A ciklosporin (CSA) és különösen a takrolimusz (TAC) potenciálisan közvetlenül károsíthatja a hasnyálmirigy β sejtjeit [69]. Az elmúlt három évtized nyilvántartási adatainak összehasonlítása azt sugallja, hogy a NODAT prevalenciája az 1980-as évek 10% -áról 20-30% -ra nőtt az elmúlt évtizedben [70]. Az amerikai veseadat-rendszer elemzése kimutatta, hogy a transzplantált gyermekeknél a NODAT prevalenciája az 1980-as évek végén 2-3% -ról az utóbbi időben 7,5% -ra nőtt [71]. A NAPRTSC jelentés a NODAT prevalenciáját mutatta a gyermekeknél az Rtx után, azonban a változás csak statisztikai tendenciát mutatott [72]. Mindazonáltal mindkét jelentés azt jelzi, hogy a transzplantált gyermekeknél a NODAT prevalenciája növekszik az elmúlt évtizedekben.
A NODAT patogenezise multifaktoriális, és a cukorbetegség összes kockázati tényezője, beleértve a CS-t és a CNI-t is, szerepet játszik. A TAC erősebb kockázati tényező a NODAT számára, mint a CSA [72]. A NODAT kockázati tényezői azonban már a dialízis időszakában működnek, és magukban foglalják a peritonealis dialízist és az elhízást [73]. A másik kockázati tényező a hiperglikémia a posztoperatív időszakban [74]. A peritonealis dialízis, a túlsúly, a CNI alkalmazása és a poszttranszplantált hiperglikémia mind a NODAT kockázati tényezőinek tűnnek.
A metabolikus szindróma mint a CKD kockázati tényezője gyermekeknél
Az anyagcsere-rendellenességeknek való kitettség és a vesekárosodás közötti késés elmagyarázza, hogy az első rendellenességek csak a progresszív CKD helyettesítői. Megállapították, hogy elhízott és nem alkoholos zsírmájbetegségben szenvedő gyermekeknél az SM kritériumoknak való kitettség csökkent glükóz tolerancia és IR korrelált a mikroalbuminuriával és a hiperfiltrációval [82–84]. Kolouridis és mtsai. megállapította, hogy az MS kritériumoknak való kitettség pozitívan korrelált a GFR-rel. A GFR azonban csökkent, ha a gyermekeket több mint négy SM kritériumnak tették ki [85]. Serdülők és fiatal felnőttek (átlagéletkor 18 év) prospektív vizsgálata azt mutatta, hogy a túlsúly, a magas vérnyomás és az alacsony HDL-koleszterin-koncentráció 6,6-szorosára növelte a hiperfiltráció valószínűségét. Sőt, a magas metabolikus kockázat korrelált a hiperfiltrációval, és megelőzte a nyilvánvaló nephropathia kialakulását [86]. Az általános következtetés az, hogy az SM-ben szenvedő gyermekeknél az első rendellenesség a hiperfiltráció, és a későbbi szakaszokban albuminuria alakul ki, amelyet a GFR csökkenése követ.
Bár az SM-hez kapcsolódó progresszív vesekárosodás patogenezise multifaktoriális, ezt legalább részben az elhízással kapcsolatos glomerulopathiában (ORG) megfigyelt jelenségek magyarázzák. Az elhízás és a vesekárosodás kapcsolatáról szóló első jelentés Preble-től származott, aki 1923-ban arról számolt be, hogy az elhízás proteinuriaval jár [87]. Weisinger és mtsai. először mind az elhízott felnőttek veséjében leírtak mind a klinikai lefolyást, mind a biopsziás eredményeket, akik SM-ben és nephrotikus proteinuriában jelentkeztek [88]. A proteinuria csökkent a súlycsökkenéssel, de azoknál a betegeknél, akik újra híztak, a proteinuria újra megjelent. A szívkatéterezés során megnövekedett a jobb pitvari nyomás. A vesebiopsziák szegmentális szklerózist tártak fel.
- Sikeres krónikus vesebeteg étkezési tervek vese étrend menü székhelye
- A vesefunkció eredményei és a 3B. Stádiumú krónikus vesebetegség kockázati tényezőinek kockázati tényezői
- A műtét utáni akut vesekárosodás a vese-helyreállítási definíciókra, a vesebetegség progressziójára összpontosít
- Veseeledel csak vesebeteg macskáknak Természetes háziállat
- Kálium-homeosztázis, krónikus vesebetegség és a Növénydúsított Diéták Amerikai Társasága