Öregedés, elhízás és gyulladásos korral járó betegségek
Daniela Frasca
1 Mikrobiológiai és Immunológiai Tanszék, Miami Egyetem Miller Orvostudományi Kar, Miami, FL, Egyesült Államok
Bonnie B. Blomberg
1 Mikrobiológiai és Immunológiai Tanszék, Miami Egyetem Miller Orvostudományi Kar, Miami, FL, Egyesült Államok
Roberto Paganelli
2 Dipartimento di Medicina e Scienze dell’Invecchiamento, Università degli Studi ’G. d’Annunzio ’Chieti-Pescara, Chieti, Olaszország
Absztrakt
Bevezetés
A túlsúly és az elhízás prevalenciájának növekedése világszerte jelenség, amely számos krónikus betegséggel társul, mint például a 2-es típusú cukorbetegség (T2D), a rák, a rheumatoid arthritis és az osteoarthritis (OA), a kognitív károsodás és a demencia, valamint a szív- és érrendszeri betegségek. (CV) rendszer.
A globális elhízási járvány minden korosztályt érint. A legutóbbi tanulmányok, amelyek 195 országban 68 millió ember testtömeg-indexének (BMI) adatait vizsgálták, világszerte mind a magas BMI-alanyok megnövekedett prevalenciáját, mind betegségterhelését mutatták az elmúlt 20 évben (1). Bár az elhízás gyakorisága a gyermekek körében alacsonyabb, mint a felnőtteknél, növekedési üteme meghaladja a felnőttekét (2). A magas BMI-vel kapcsolatos betegség globális terheit az alapfeltételek nélküli egyéneknél számolják, és felnőtteknél lassabban növekszik, elsősorban a CV-betegségek egyéb kockázati tényezőinek csökkenése és a hatékony klinikai beavatkozás miatt. Kimutatták azonban, hogy a megnövekedett BMI számos betegséggel patogenetikailag összefügg. Ezek közül az inzulinrezisztencia (IR) és a T2D szoros kapcsolatban áll az elhízással, és a metabolikus szindróma a súlyos CV események (koszorúér-betegség, stroke) kockázati tényezőinek csoportját jelenti. Az öregedésre ráhelyezett elhízás további kockázati tényezőt jelent az idősebb korosztályok számára, amelyekben a krónikus betegségek prevalenciája, valamint a szövődmények előfordulása növekszik (3-5). A gyermekek (≤18 éves) magas BMI-jének betegségterhelésével nem foglalkoztak ugyanolyan részletesen.
Az öregedési folyamatot a krónikus gyulladás állapota jellemzi, amelyet gyulladásnak neveznek. Számos tényező járul hozzá a gyulladáshoz, ideértve a gyulladásgátló gének promoter régióiban kialakuló polimorfizmusokat, az immunsejtek krónikus stimulálását vírusokkal, például citomegalovírussal, a bél mikrobiomjának változását és a belek fokozott permeabilitását [áttekintve a Ref. (6)]. Nemrégiben azt javasolták, hogy a veleszületett receptorok endogén jelek, például a károsodáshoz kapcsolódó molekuláris mintázatok folyamatos bekapcsolódása a háttérgyulladás krónikus állapotát vezérli, amelyet gyulladáscsökkentő mechanizmusokkal kell ellensúlyozni. A sejtes öregedést és az öregedéshez kapcsolódó szekréciós fenotípus (SASP) megszerzését a fibroblasztok (7), valamint az endotheliális (8) és az immunsejtek (9–11) között szintén meghatározták, mint a gyulladás jelentős hozzájárulását. A sejt öregedése a szabályozatlan funkciójú terminálisan differenciált B, T és NK sejtek felhalmozódását indukálja az öregedést és az energiát érzékelő jeleket integráló utak aktiválásával.
A gyulladás fontos kapcsolat az elhízás, az IR, az öregedés és az életkorral összefüggő betegségek között, mint például a kognitív károsodás, az érelmeszesedés, a rák és az autoimmunitás. Az emelkedett gyulladásgátló citokinek csökkent inzulinérzékenységgel járnak. A krónikus alacsony fokú (steril) gyulladás IR-t okoz, ami a metabolikusan normális elhízásból a metabolikus szindrómába való átmenethez vezet. Ez mind a szisztémás gyulladás, mind a metaflammáció (12) révén következik be, amely folyamat során a tápanyagfelesleg elősegíti a krónikus, alacsony fokú gyulladást, és amelynek metabolikus jellemzői a magas lipidszint, szabad zsírsavak (FFA), glükóz és reaktív oxigénfajok (ROS).
A veleszületett és adaptív immunrendszer immunsejtjei behatolnak az inzulinra reagáló szövetekbe, például a zsigeri zsírszövetbe (VAT), és elhízással gyulladásos reakciókat váltanak ki. Az immunsejtek (makrofágok, T, B, NK, NKT sejtek és neutrofilek) szerepet játszottak a zsírszövet (AT) gyulladásban és az IR-ben (13–17). A gyulladás helyi és szisztémás növekedéshez vezet a gyulladásgátló molekulákban, például a tumor nekrózis faktor (TNF) -α, az interleukin (IL) -1β, az IL-6, az interferon (IFN) -γ, a gyulladásos adipokinek, a kemokinek és az FFA-k [ áttekintve a Ref. (16)].
Az elhízás kapcsolata az inzulinrezisztenciával (IR) és a T2D-vel
Az IR a keringő inzulinra adott válasz hiánya számos szövetben, beleértve a májat, az izmokat és az AT-t (18). Gyakran társul az elhízással, a magas vérnyomással (a metabolikus szindróma jellemzőinek integrálásával) és a CV betegséggel, és jellemzően megelőzi a T2D megjelenését. A hasnyálmirigyben a β-sejtek a teljes β-sejt tömegének növekedésével és az inzulin fokozott szekréciójával (hiperinsulinemia) alkalmazkodnak a hiperglikémiához, amely nemcsak a normális glikémiás szintet képes szabályozni, hanem β-sejt stresszt is kiválthat, β-sejt meghibásodást okoz, majd T2D (19). A T2D-ben szenvedő betegek gyenge glikémiás kontrollja súlyos szövődményeket eredményez, például veseelégtelenséget, vakságot, neuropathiát és CV-rendellenességeket (20).
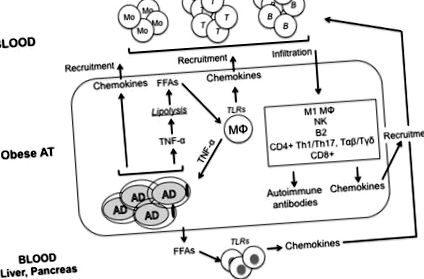
Nem teljesen világos, hogy az elhízás hogyan okozza az IR kialakulását. Bár számos molekuláris mechanizmust javasoltak, ideértve az ER stresszt, az oxidatív stresszt, a lipid homeosztázis diszregulációját, a mitokondriális diszfunkciót, a hipoxiát és az inzulin jelátviteli útjának károsodását az inzulinra reagáló sejtekben, bizonyíték van arra, hogy az elhízás okozta gyulladás kulcsfontosságú lehet IR-faktor (21). Ábra Az 1. ábra az elhízott AT gyulladásához vezető fő utakat foglalja össze.
Gyulladásgátló mediátorok előállítása az elhízott AT-ban
Az AT magas TNF-a-szintje krónikusan megemelkedett bazális lipolízissel, a trigliceridek hidrolízisének folyamatával társul FFA-k és lipidek felszabadításához (22). Ezek krónikus stimulációt okoznak a makrofágok számára, ami FFA által indukált TNF-a termeléshez vezet, IR-t okozva. Felvetődött, hogy az adipocita eredetű TNF-α hozzájárul az elhízott egyének vérében az FFA-szintek emelkedéséhez (22), és a TNF-α in vivo semlegesítése elhízott egerekben csökkenti az FFA-k keringési szintjét (23). Kimutatták, hogy a TNF-a csökkenti a lipidcseppeket (perilipinek) stabilizáló fehérjék expresszióját is, ami ektopiás lipid lerakódáshoz vezet az inzulinérzékeny szövetekben. A lipidek és a lipid eredetű molekulák közvetlen hatással vannak az inzulinérzékeny szövetekre és IR-t indukálnak (25).
Az elhízott AT által felszabadított egyéb fő gyulladásgátló citokinek a CD8 + T sejtek (26) és az NK sejtek (27) által szekretált IFN-y és a CD4 + T sejtek által kiválasztott IL-17 (28).
Hypoxia és „ön” antigének felszabadulása az elhízott AT-ban
Az elhízás kialakulása során a táguló AT oxigénellátása nem lesz megfelelő, ami hipoxia területeit eredményezi (29, 30). A gyengén oxigénnel kezelt AT ezen jelensége nemcsak a transzkripciós faktor hipoxia által indukálható faktor-1α (HIF-1α) aktiválását és a gyulladásgátló citokinek további felszabadulását aktiválja (31), hanem a sejthalált és az „én” antigének felszabadulását is előidézi, amelyek stimulálják az osztályt váltás és IgG patogén antitestek termelése. Az AT-ban fellépő hipoxia volt az egyetlen javasolt mechanizmus az „ön” antigének felszabadítására az elhízott AT-ban.
Immunsejt-infiltráció az elhízott AT-ben
Elhízott egerek és emberek adatai azt mutatják, hogy a hipertrófiás AT erősen beszivárog a különféle immunsejtekből, amelyek gyulladáscsökkentő fenotípust mutatnak, amelyet a SASP markerek szekréciója jellemez (32), és számuk fordítottan korrelál az inzulinérzékenységgel. Gyulladáscsökkentő fenotípusú sejtekről beszámoltak az elhízott AT-ben is, de ezek a sejtek alacsony frekvencián vannak jelen. Ezek az IL-10-t termelő B1 B-sejtek (15, 33) és a veleszületett 2-es típusú limfoid sejtek, amelyek nagy mennyiségű Th2-citokint, például IL-4, IL-5 és IL-13 termelnek (34). Tregekről is beszámoltak, de csak a sovány AT-ban (35).
A makrofágok beszivárgását az AT-ben a gyulladás egyik fő hajtóerejének tekintették, az immunsejtek AT-be történő toborzásában szerepet játszó gyulladásgátló citokinek és kemokinek szekréciója miatt. Az adipociták azonban gyulladásgátló mediátorokat is szekretálnak (citokinek, kemokinek és adipokinek), és nagyobb mennyiségben, az immunsejtekhez képest (36). Ezért elhízással az adipociták és az AT-be beszivárgó immunsejtek közötti áthallás hozzájárul a krónikus gyulladás kialakulásához, ami az IR előfeltétele. Az AT makrofágjai szinte kizárólag M1-nek minősülnek, gyulladásos működésük függ a glikolízistől, az AT-ban való stimulálásuk pedig glükóz transzporter expressziót és glükóz bevitelt és felhasználást indukál (37). A hipoxia (HIF-1α-n keresztül) fokozza a glikolízist és stabilizálja a gyulladásos fenotípust (38). Az M1 makrofágokban a gyulladásos NLRP3 aktiválja a kaszpáz 1-et és az IL-1β szekrécióját (39), amely közvetlenül mérgező a hasnyálmirigy β-sejtjeire és IR-t indukál (40). Fokozott gyulladásos aktivitásról számoltak be T2D betegek monocita eredetű makrofágjaiban (41).
Az AT T-sejtjei Th1 CD4 + és IFN-y-termelő CD8 + T-sejtek (26). Ezek elősegítik a gyulladásgátló citokinek szekrécióját az M1 makrofágokból, mind helyi, mind szisztémás IR-hez vezetve (42). A makrofágokhoz hasonlóan a T-sejtek részhalmaza az AT-ben a hormonok (leptin) és az intracelluláris tápanyag-érzékelő kinázok, például AMPK/mTOR (43) által szabályozott szubsztrát-anyagcsere modulációján keresztül történik. A Th1 CD4 + T sejtek magas szintű membrán glükóz transzportereket expresszálnak, és erősen glikolitikusak (44), ez a tulajdonság gyulladásos reakciókat támogat.
Az interferon-y, a Th1 citokin szignatúra, a makrofágokat és a T-sejteket kemokinek kiválasztására indukálja, amelyek immunsejteket toboroznak az elhízott AT-hez (45, 46). Ezenkívül az IFN-γ megkönnyíti az M2 – M1 polarizációt (47), és csökkenti az inzulinreceptorok szignalizációját az inzulinreceptorok és a glükóztranszporterek expressziójának csökkentésével (48). Az IFN-γ termelést a T-bet szabályozza, a T-box család transzkripciós faktora, amelyet először az IFN-γ transzkripciós induktorként azonosítottak a CD4 + T sejtekben (49). A T-bet kritikus szerepet játszik az IR kialakulásában az elhízás állatmodelljeiben, és a magas zsírtartalmú étrenddel táplált T-bet hiányos egerek refrakterek az IR indukciójára (50). Ezek az egerek javított inzulinérzékenységet és glükóz toleranciát mutatnak, csökkent az immunsejtek száma az AT-ben (CD4 +/CD8 + T-sejtek, NK-sejtek és makrofágok), és csökken a gyulladásgátló citokinek termelése egy gramm zsírban (IFN-γ, TNF-a, IL-1β és IL-6).
Az elhízott és a T2D-s betegek megváltoztatják mikrobiomjuk összetételét, a Bacteroidetes (jótékony baktériumok) aránya csökkent az elhízott és a sovány egyének esetében (51). Sőt, arról számoltak be, hogy a bél mikroflóra szabályozza az elhízás kialakulását állatmodellekben (52). A T-bet szabályozza a nyálkahártya T-sejtjeinek aktiválódását (53), a T-bet hiánya pedig megváltoztatja a mikroflóra összetételét (54). A T-bet hiányosság az elhízással küzdő egyének mikrobiomját is megváltoztathatja, ami a T2D-t szabályozó gyulladásos és metabolikus folyamatokhoz vezet.
A B-sejtek az elhízott AT-ben is felhalmozódnak (15, 55, 56). A B-sejtek toborzása megindíthatja a T-sejtek által indukált M1 polarizációt és IR-t. Az elhízás és a hiperglikémia közvetlen hatással van az antitesttermelésre, és a gyulladt VAT-ból származó IgG-szekréció modulálja a rezidens makrofágok működését. Beszámoltak arról, hogy az AT B-sejtjeit patogén IgG autoantitestek termelésére indukálják, az autoantigének hipoxiás adipociták általi szabályozatlan expressziója miatt. A B-sejtek támogatják a gyulladásos T-sejtek aktiválódását is, amelyek a szisztémás gyulladás és az IR fő kórokozói.
Nemrégiben egy új limfoid szövetet azonosítottak zsírral társult limfoid klaszterekként (FALC), amelyeket egerek és emberek mesenterialis AT-jében azonosítottak. A FALC-k gyulladásos ingerek után gyorsan indukálódnak, és támogatják a B-sejtek proliferációját és a differenciálódást, amely szabályozza az antitest termelést az AT-n belül (57).
Elhízás és reumás ízületi gyulladás (RA): Bizonyítékok és mechanikus kapcsolatok
Az “elhízási paradoxon” RA-ban
Az elhízás fontos kapcsolatot jelent a társbetegségekkel, például a metabolikus szindrómával (71) és a CV betegségekkel (72); azonban egyes tanulmányokban a megnövekedett BMI a halandóság csökkenésével ellentétes hatást fejtett ki (70, 73), amelyet „elhízási paradoxonnak” neveztek (74). Sőt, túlsúlyos RA betegeknél a csontpusztulás progressziója csökkent (75, 76), a duzzadt ízületek száma nem nő, és jobb életminőségről számoltak be (77). A súlycsökkenés és a cachexia a halálozás nagyobb kockázatának (78) és a rosszabb életminőségnek (77) a meghatározó tényezője, ezáltal erősítve az elhízott betegek alacsonyabb halálozásának paradox megfigyelését. Utóvizsgálatok azonban kimutatták, hogy RA-ban szenvedő betegeknél, akiknek az anamnézisében elhízás volt, a csökkent BMI szorosan összefügg a halállal. Ezért az „elhízási paradoxon” nem jár az elhízás biológiailag védő szerepével (73), felvetve azt a kérdést, hogy a BMI alkalmazása érvényes eszköz-e az elhízás értékelésére RA-ban (65).
A B-sejtek szerepe az RA patogenezisében
Az autoreaktív B-sejtek kulcsfontosságú szerepét a diagnosztikus autoantitestek jelenléte emeli ki, és a reumatoid faktor (RF) (99) és az anticiklusos-citrullinált peptid antitestek (ACPA) (100) a betegség és a betegség súlyosságának jól megalapozott indikátorai. megelőzi a betegség kialakulását. A B-sejtek RA patogenezisében betöltött szerepével a túlsúly/elhízás összefüggésében még nem foglalkoztak, ezért alapos figyelmet érdemel. A korai B-sejt-tolerancia elsődleges hibáját detektálták, mivel a naiv B-limfociták többsége polireaktív autoantitesteket expresszál, beleértve az RF-t és az ACPA-t is. Ezek a B-sejtek ellenállnak a Fas által indukált apoptózisnak, ezért Treg nem szuppresszálja őket (101). A B-sejtek azonban más mechanizmusok révén vesznek részt az RA-ban, a segítő T-limfociták kétirányú támogatásában, önantigént bemutató sejtekként, gyulladásos mediátorok felszabadulásával és a limfoid neogenezis elősegítésével (ami kiemelkedő az RA-synovitisben) ). Az RF + B sejtek képesek IgG-t tartalmazó immunkomplexeket felvenni és antigént mutatni a T-sejtekben, ezáltal aktiválva a kölcsönösen megerősített választ (102).
Osteoarthritis (OA), öregedés és elhízás
Időseknél az ízületi gyulladás gyakran társul más, többszörös öregedéssel vagy degeneratív tünetekkel járó betegségekkel (109). Az OA és RA közös jellemzőkkel rendelkeznek az idős betegeknél, és jelentősen hozzájárulnak a fogyatékossághoz (110). Az OA-t általában az életkor alapján különböztetik meg a diagnózistól, a reggeli merevség időtartamától, az ízület érintettségének mintázatától és a radiográfiai eredmények alapján. A betegségek megkülönböztetése kihívást jelenthet, de a 60 évnél idősebb korosztályban az OA sokkal gyakoribb. Annak ellenére, hogy az OA közvetlenül korrelál az életkorral, ennek az összefüggésnek a valódi oka nem egyértelmű, és az OA fejlődése elosztható az öregedéstől függő és az öregedéstől független folyamatokig (111–114). Mind a mátrix metalloproteinázok, mind a citokinek megnövekedett termelése, a II-es típusú kollagén szintézisének csökkent szintje és a ROS fokozott termelése a kondrociták korral összefüggő változásokat idéz elő (114). Ezek a változások megváltoztatják a porcfunkciókat, és a szarkopénia tovább csökkenti az ízületek stabilitását (115). A sejtek öregedése, a regeneráció romlása és a helyreállítás olyan tényezők, amelyek hozzájárulnak a porc károsodásához az öregedéssel (115, 116).
Kognitív fogyatékosság, demencia és kapcsolat az életkorral összefüggő betegségekkel és elhízással
Záró megjegyzések
Az immunitás és az anyagcsere erősen integrált tényező az öregedés és az életkorral összefüggő betegségek szempontjából. Ez egyre bővülő vizsgálati terület. Az elhízás és az azzal összefüggő szövődmények a globális járvány egyik fő oka. A tudományos kutatásnak az elhízás minden következményének megértéséhez a megoldás döntő részének kell lennie, de ez a kutatás még mindig a kezdeti szakaszában van. Azon mechanizmusok vizsgálata, amelyek révén a gyulladás és az immunaktiváció megzavarja a funkcionális immunválaszt, új betekintést nyújt a gyulladás és a hosszú távú metabolikus betegség kimenetele közötti kapcsolat megértésébe, és új utakat nyit a hatékony terápiás beavatkozásokhoz.
Szerző közreműködései
Valamennyi szerző részt vett a cikk megírásában, és véglegesen jóváhagyta a beküldött verziót.
Összeférhetetlenségi nyilatkozat
A kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
- Az Arnold Institute of Aging meggyújtja az egészséges öregedés javítására irányuló erőfeszítéseket, az elhízás megelőzésére összpontosítva
- Az öregedés, a cukorbetegség, az elhízás és a kognitív hanyatlás A népességen alapuló tanulmány - Ganguli - 2020 - Journal
- Absztrakt 51 Allograft 1. gyulladásos tényező hiánya megakadályozza az elhízást és az inzulinrezisztenciát
- A kalória-korlátozó étrend javíthatja az életkorral összefüggő betegségek kockázatát
- A bariatrikus sebészet biztonságos és hatékony lehetőség gyulladásos bélbetegségben szenvedő betegek számára