Súlyos krónikus hasmenés és súlyvesztés koleszteril-észter tárolási betegségben: Esettanulmány
Levelezés: Dr. Uta Drebber, Kölni Egyetem Patológiai Intézete, Joseph-Stelzmann-Str. 9, D-59031 Köln, Németország. [email protected]
Telefon: + 49-221-4786370 Fax: + 49-221-4786360
Absztrakt
CÉL: Az emberi lizoszomámsav lipáz (LAL) örökletes hiánya a Wolman-betegség és a koleszteril-észter tárolási betegség (CESD) ritka állapotát eredményezi. Szeretnénk bemutatni a CESD ritka esetét egy felnőttnél.
MÓDSZEREK: Egy felnőtt nőbetegről számolunk be, akinek súlyos krónikus hasmenése és súlycsökkenése van a CESD következményeként. A klinikai vizsgálat a malabszorpció jeleit és enyhén emelkedett májenzimszinteket mutatott.
EREDMÉNYEK: A májszövet hisztopatológiai változásai és a DNS-szekvencia-elemzés megerősítette a CESD diagnózisát a leggyakoribb CESD-mutáció, a lizoszomámsav-lipáz (LIPA) gén 8. exonja által kódolt G934A-splicíziós hely homozigozitása miatt.
KÖVETKEZTETÉS: Az irodalomban az első eset a hasmenés, mint a CESD feltételezett tünete felnőtt betegeknél.
BEVEZETÉS
A Wolman-kór és a koleszteril-észter tárolási betegség (CESD) nagyon ritka örökletes rendellenességek a lipid anyagcserében. Mindkettő az autoszomális recesszív mutációk következménye, amelyek a humán lizoszomális sav lipáz (LAL) sav észteráz és koleszteril észter hidroláz hiányos vagy erősen csökkent aktivitását eredményezik [1]. Az érett 378 aminosav fehérjét, amelynek molekulatömege kb. 43-54 ku, a lizoszomámsav lipáz (LIPA) gén kódolja a 10q23.2-q23.3 kromoszómán, amely 10 exont tartalmaz egy 38,8 kb méretű régióra diszpergálva [2 -4].
A LAL elengedhetetlen a koleszteril-észterek és trigliceridek intralysosomális lebontásához, amelyeket a receptor által közvetített endocitózis vesz fel. Örökletes hiány vagy alacsony aktivitás a megfelelő lipid szubsztrátok intralysosomális tárolását eredményezi. Mivel az enzimet az összes sejtmag szintetizálja, a lipiddel terhelt sejtek minden szervben megtalálhatók, különösen a májban, a lépben, a mellékvesében és a vérképző rendszerben, valamint a belekben, valamint a nyirokcsomókban, a tüdőben, a herékben és petefészkek [5-8].
Míg a Wolman-betegség infaustikus prognózissal rendelkezik, hydrops fetalishoz és veleszületett asciteshez, valamint rendellenes neurológiai fejlődéshez vezet, a CESD enyhébb formát mutat a kb. 3% -os maradék enzimatikus aktivitás miatt, amely széles körű lipidlerakódást eredményez, és bármely életkorban [9-13].
A CESD-t ritkán diagnosztizálják. Beszámolunk egy szokatlan esetről, amikor egy 41 éves nő kora gyermekkora óta visszatérő hasmenéstől szenvedett, és súlyos hasmenéses epizód és az azt követő fogyás miatt kórházba utalták. A klinikai vizsgálat során májbiopsziát végeztek, amely a CESD kísérleti diagnózisához vezetett. Ezt molekuláris genetikai elemzés igazolta.
ESETLEÍRÁS
Egy 41 éves nőbeteget, akit nevelőszülőként neveltek fel, kórházba utaltak tartós krónikus hasmenés miatt, amely romlást okozott azáltal, hogy az utolsó 5 hónapban 10 kg súlycsökkenést okozott (testtömeg 44 kg, magasság 168 cm a kórházi felvételkor). A klinikai vizsgálat a lipidben oldódó vitaminok csökkent szintjét, valamint a kóros laktóz toleranciát tárta fel. A hasi ultrahang a vékonybél nyálkahártyájának ödémáját mutatta. A lisztérzékenységet kizárták az endomysium, a szövet-transzglutamináz és a gliadin elleni normális antitestszintek. A hasmenésszerű fertőzés vagy a hashajtó bántalmazás egyéb okait szintén kizárták. A páciens májenzimszintje emelkedett (AST 47 U/L, ALT 57 U/L). A vírusos hepatitis (HbsAg- és anti-HBc-) jelei azonban nem voltak. Az immunglobulin értékek szintén normálisak voltak. A megnövekedett májenzimek és a hasmenés okának megtalálásához a máj és a vékonybél biopsziáját vették fel.
Kóros leletek
A hisztopatológiai és immunhisztokémiai elemzésekhez formalinnal rögzített, paraffinba ágyazott májszövetet és vékonybél biopsziákat készítettünk. Ultrahangos vizsgálatot végeztünk glutáraldehiddefixált májszöveten elektronmikroszkóp alatt.
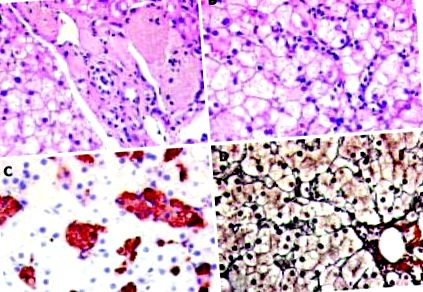
A máj fénymikroszkópiája a Kupffer-sejtek és a makrofágok növekedését mutatta, amelyek a sinusoidákon belül, valamint a portális traktusokban találhatók. A makrofágok szembetűnőek voltak a habos, barnás színű, PAS-pozitív anyagok citoplazmatikus tárolásával. Az immunhisztokémiában a leírt sejtpopuláció a makrofág-specifikus CD68 markert expresszálta. A CD68-pozitív populáció eloszlása az egész acinuson bőséges volt, zonális hangsúlyozás nélkül. Ezenkívül diszkrét parenchimás gyulladásos aktivitás egyetlen apoptotikus testtel, valamint finom hólyagos steatosis a hepatociták körülbelül 40% -ában. Diszkrét pericelluláris fibrózist láthattunk a reticulin foltban (ábra (1. ábra 1).
Fénymikroszkópos leletek a májban. V: A barnaszínű habos anyag látható a szembetűnő makrofágokban a portális traktus mellett. HE-folt × 400. B: Acinus része, kiemelkedő intrasinusoidalis sejtes infiltrációval és a hepatocyták mikrovezikuláris steatosisával. HE-folt (× 400). C: Immunhisztokémiai festés a habos anyaggal megrakott CD68 pozitív makrofágokkal. D: Reticulin festés (× 400). Nincs figyelemre méltó fibrózis.
A vékonybél biopsziák során egyetlen makrofág került kimutatásra, a PAS-pozitív habos, sárgásbarna anyag citoplazmatikus tárolásával a villina apikális részén belül a lamina submucosában (2. ábra). Az ultrakonstrukturális vizsgálat kimutatta, hogy lizoszomális lipidek tárolódnak a hepatociták és makrofágok citoplazmájában, valamint egyes koleszteril-észter kristályok vannak jelen (ábra (3. ábra)).
A vékonybél biopsziában egyes makrofágok tárhatók fel, amelyekben a PAS-pozitív habos, sárgásbarna anyag citoplazmatikusan tárolódik a villina apikális részén a lamina submucosában. PAS-foltot mutatunk be a nyilak közötti PAS-pozitív makrofágokkal (cd) (× 400).
V: A májszövet elektronmikroszkópiája egyetlen koleszterin kristályt mutat be a májsejt citoplazmájában. B: Különböző méretű triglicerid cseppek a hepatociták citoplazmájában (× 11000).
Összességében a máj biopsziájának szövettani változásai a CESD-re utalnak. Ezért elvégeztük a proband LIPA génjének DNS-szekvencia elemzését. A páciensről kiderült, hogy a leggyakoribb CESD mutáció homozigóta hordozója, a G934A-csere befolyásolja a 8. exon utolsó kódoló bázisát, ezáltal megerősítve a diagnózist. Ez a genetikai hiba a 8. exon kihagyását eredményezi az mRNS-transzkriptumból és a belső 254-277 aminosavak elvesztését az érett enzimből. A mutáció jelenléte ellenére a normális splicing körülbelül 3% -a fordul elő, ami biztosítja az érintett egyén túlélését [1,3].
VITA
Bemutatjuk a CESD szokatlan esetét egy felnőtt nőnél. A CESD ritka állapot, amelyet általában az élet első vagy második évtizedében diagnosztizálnak a vele járó hepatomegalia miatt, gyakran hiperkol-észterolémiával kombinálva, de későbbi felnőttkorban csak ritkán [7]. Bár nincs specifikus kezelés, az enyhülést a 3-hidroxi-3-metil-glutaril-koenzim A (HMG CoA) reduktáz inhibitorokkal, például lovosztatinnal [14-16] indukálhatjuk. Májcirrózis esetén májtranszplantáció javasolt [17-19].
Súlyos hasmenésben és súlycsökkenésben szenvedő páciensünk klinikai tünetei figyelemre méltó különbséget jelentenek a CESD tipikus betegségmintájához képest, amely általában máj tüneteket mutat, korai progresszióval a cirrhosis felé [1]. A beteg krónikus hasmenésről számolt be a korai gyermekkorban, így a CESD okozati szerepet játszik. Ennek megfelelően a laboratóriumi eredmények a krónikus malabszorpció jeleként a lipidben oldódó vitaminok szintjének csökkenését mutatták. A máj tünetei ezzel szemben diszkrétek voltak. Májbiopsziát végeztek ismeretlen etiológiájú, enyhén emelkedett májenzimek miatt. A máj hisztopatológiai változásai a CESD-re voltak jellemzőek, azonban jelentős fibrózis nem alakult ki, amelyet a laboratóriumi eredmények is tükröznek. Ez különösen figyelemre méltó a betegség tüneteinek hosszú időtartama miatt, és összehasonlítva más jelentett esetekkel, ahol súlyos fibrózisról már gyermekkorban beszámoltak [20].
A DNS-szekvencia-analízis homozigóta volt egy G934A-mutációra a LIPA-gén 8. exonjában. Ez a nukleotid szubsztitúció exon kihagyást és 24 aminosav későbbi elvesztését eredményezi az érett enzimből. Ez a leggyakoribb genetikai hiba a CESD-ben, így a mutáció nem magyarázza a szokatlan klinikai megjelenést [3].
Összegzésképpen elmondható, hogy a CESD nagyon ritka anyagcsere-hiba, és olyan lenyűgöző klinikai tünetekkel jár, amelyek megnehezítik a helyes diagnózis felállítását. Az itt közölt beteg az irodalomban az első eset, amikor a CESD és a krónikus hasmenés a CESD feltételezett tünete. Ezért arra a következtetésre jutunk, hogy a CESD-t figyelembe kell venni a krónikus hasmenés differenciáldiagnózisában, ha a hasmenés egyéb okait kizárták.
Lábjegyzetek
Tudományos szerkesztő Li WZ nyelvszerkesztő Elsevier HK
- Fogyás utam reumás ízületi gyulladással krónikus Eileen
- ReShape fogyás műtét nélkül - Emésztőrendszeri központ
- A 2-es típusú cukorbetegség visszafordítása súlycsökkenéssel - Egészségügyi jelentés - ABC Radio National
- A prednizon és a fogyás nem nyeri el Crohnt; s Betegség Fórum
- Az NIH munkacsoport jelentése Innovatív kutatás a fogyás fenntartásának javítása érdekében - PubMed