Szelektált flavonoidok jelátvitele és molekuláris céljai
Absztrakt
Bevezetés
A D iet határozottan befolyásolja az egészséget, és vélhetően jelentős hatást gyakorol bizonyos betegségek, különösen a rák és a szívbetegségek kialakulásának kockázatára. Úgy gondolják, hogy a növényekben vagy a fitokemikáliákban található számos táplálkozási tényezőnek erős antioxidáns és rákellenes hatása van, alacsony toxicitással [áttekintve (9–21)]. A flavonoidok valószínűleg a fitokémiai vegyületek leggyakoribb csoportja, amelyek megtalálhatók az emberi étrendben, mivel mindenütt jelen vannak és széles körben elterjednek az ehető növények sokaságában (133). Az állítólag olyan élelmiszer-tényezők, mint a flavonoidok, megvédik a sejteket a korai öregedéstől és a betegségektől azáltal, hogy a táplálékfaktor antioxidáns tartalma és aktivitása alapján védik a DNS-t, a fehérjéket és a lipideket az oxidatív károsodásoktól. Amellett, hogy általánosságban biztonságosnak vallják magukat, úgy tűnik, hogy rákellenes szerként is hatékonyak azáltal, hogy megelőzik vagy visszafordítják a premalignus elváltozásokat és/vagy csökkentik a második primer tumor előfordulását (59).
Sajnos az egyik legnagyobb kihívás a kutatók számára az, hogy csökkentse a torzulások és féligazságok folyamatos felhalmozódását, amelyekről a népszerű média beszámol bizonyos élelmiszerek vagy étrend-kiegészítők, köztük a flavonoidok egészségügyi előnyeiről. Az étrend- vagy étrend-kiegészítők használata nem új keletű, de a használatuk iránti érdeklődés drámaian megnőtt a vélt egészségügyi előnyök miatt, amelyek feltehetően kellemetlen mellékhatások nélkül szerezhetők be (52). Ez különösen igaz a rák megelőzésére és kezelésére. A flavonoidokat in vitro gyulladáscsökkentő (147), rákellenes (38) és antioxidáns (2) hatásokként hirdetik. Vitatott azonban, hogy a flavonoidok képesek-e ezeket a hatásokat in vivo előidézni (116, 143, 147). Ezért a specifikus szignáltranszdukciós útvonalak, gén-, fehérje- és transzkripciós faktor-célpontok, valamint az egyes táplálkozási tényezők, különösen a flavonoidok állítólagos rákellenes aktivitását magyarázó mechanizmusok azonosítása hatékony alternatívákat vagy kiegészítéseket kínálhat a rák megelőzésének hagyományos módszereihez (azaz kemoprevenció) vagy rákkezelés (azaz kemoterápia).
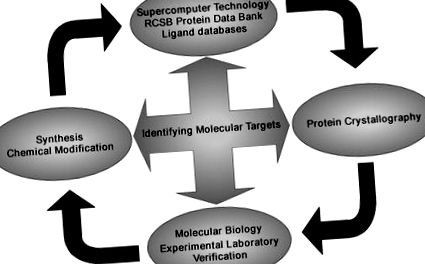
Alapvető stratégia a flavonoidok és más fitokémiai anyagok specifikus molekuláris célpontjainak azonosítására. Szuperszámítógépes technológiát használunk az RCSB Protein Data Bank és sok ligand adatbázis fehérjeskristályográfiával kombinált átvilágítására a megjósolt komplexek megjelenítéséhez. Ez kombinálódik a molekuláris biológiával és a vegyület hatékonyságának kísérleti igazolásával a fehérje céljának megtalálásában és az arra való hatásában is. Számos hatékony vegyületet lehet szintetizálni és kémiailag módosítani, hogy hatékonyabb származékokat állítsanak elő.
E stratégia alkalmazásával tanulmányoztuk a rákellenes tevékenységeket, és tisztáztuk a mindennapi étrendünkben megtalálható különféle flavonoidok szerepét és molekuláris célpontjait. A cikk fennmaradó része kiemeli főbb megállapításainkat ezen étrendi flavonoidok, mint hatékony rákellenes szerek közül, közülük néhány kiválasztott molekuláris mechanizmusainak és fehérje-kötési célpontjainak tekintetében. A fő hangsúly azokra a fehérje célpontokra kerül, amelyeket eddig azonosítottak ezeknél a vegyületeknél.
A flavonoidok fehérje céljai
A flavonoidok nagyon hatékony antioxidánsok in vitro (31, 57). Az in vivo hozzájárulást azonban elhanyagolhatónak tekintették a biológiai hozzáférhetőség és az anyagcsere hiánya miatt (43, 99, 143). A flavonoidok sejtes hatásai inkább a jelátvitelre gyakorolt hatásukhoz kapcsolódhatnak, mint általános antioxidáns hatásokhoz (143). Számos közvetett rákellenes hatásról számoltak be, ideértve a rákos sejtek proliferációjának gátlását és az apoptózis kiváltását (3, 72, 118, 125), csökkent gyulladást (25, 113, 126), a tumor inváziójának gátlását és az angiogenezist (3, 76 ) és a II. fázisú méregtelenítő enzimaktivitás stimulálása (79, 140). Míg állati modellekben a flavonoidok csökkent daganatokkal társultak (4, 23, 27, 41, 42, 48–50, 56, 60, 67–71, 75, 85–90, 93, 95–98, 130, 131, 139, 148, 149), az emberi vizsgálatok kevésbé meggyőzőek (1, 44, 45, 47, 58). További klinikai vizsgálatokra lesz szükség annak megállapításához, hogy specifikus flavonoidok alkalmazhatók-e a rák megelőzésében vagy kezelésében.
Az elmúlt évtizedben végzett munkánk nagy részének fő hangsúlya a molekuláris és sejtes mechanizmusok és célok tisztázása volt, amelyek elengedhetetlenek a rák megelőzésében, különös tekintettel a bőrrák megelőzésére. Manapság az az elképzelés, hogy a rák megelőzhető (17), vagy kis molekulák, például flavonoidok alkalmazásával kezelhető specifikus és talán több rákgén, jelátviteli fehérje és transzkripciós faktorok megcélzásához. Hosszúsága miatt a rák kialakulásának promóciós szakasza lehet az a szakasz, amelyben az étrendnek lehet a legnagyobb hatása. Eddigi munkánkból kiderült, hogy a flavonoid vegyületek közül sok úgy tűnik, hogy az emberi epidermális növekedési faktor receptor (HER)/erbB család több downstream effektorát célozza meg. A tirozin-kináz receptorok ezen családjának nem megfelelő foszforilezését és aktiválódását számos rákban megfigyelték (32), és ez a hagyományos rákterápiákkal szembeni rezisztenciával függ össze. Ezen túlmenően az epidermális növekedési faktor receptor (EGFR) downstream fehérje effektorai közül sokan abnormálisan expresszálódnak különféle rákos megbetegedésekben is (141). Az EGFR aktiválása elsősorban a Ras/Raf/MEK/MAPK útvonalat, a PI3-K/PTEN/Akt/mTOR útvonalat, valamint a jelátalakítót és a transzkripció aktivátorát (STAT) jelző kaszkádot indítja el (6, 37, 39, 63, 65) (2. ábra).
Az EGFR aktiválásának általános rendszere. Az EGFR aktiválása elsősorban a Ras/Raf/MEK/MAPK útvonalat, a PI3-K/PTEN/Akt/mTOR útvonalat és a STAT jelátviteli kaszkádot indítja el. Miután kiváltotta, a jel felerősödik, és különféle transzkripciós faktorok aktiválódását eredményezi, amelyek számos sejtes választ eredményeznek, például megnövekedett túlélést, proliferációt, csökkent apoptózist és gyulladást. EGFR, epidermális növekedési faktor receptor; ERK, extracelluláris szignál által szabályozott kináz; MAP, mitogénnel aktivált fehérje; MEK, mitogén-aktivált protein-kináz/ERK-kináz; mTOR, a rapamicin emlős célpontja; PI3-K, foszfatidil-inozitol-3-kináz; PTEN, foszfatáz és tenzin homológ; STAT, jelátalakító és a transzkripció aktivátora.
A Ras/Raf/MEK/MAPK jelzés gátlása flavonoidokkal
A sejtek neoplasztikus transzformációja és a gyulladás a karcinogenezishez hozzájáruló fő események. Az EGFR-t növekedési faktorok, például epidermális növekedési faktor (EGF) aktiválják. Az EGF megkötése az EGFR aktiválódását és foszforilezését eredményezi tirozin-maradványain, ami végül beindítja a Ras aktivációját. A Ras aktiválja a Raf-et, amely foszforilálja a mitogén-aktivált protein-kináz/ERK-kináz (MEK) 1/2-et, amely ezt követően aktiválja a mitogén-aktivált fehérje (MAP) kinázokat vagy a MAP-kináz-kináz (MKK) jelátvitelt. A MAP kináz és az MKK kaszkádok downstream effektorai közé tartoznak az extracelluláris szignál által szabályozott kinázok (ERK), a p90 riboszomális S6 kinázok (RSK) és a c-Jun N-terminális kinázok (JNKs) (3. ábra). A Ras és/vagy Raf konstitutív módon aktiválódik a különféle rákos sejtvonalakban, és a MEK kritikus szerepet játszik a különböző tumor-promoterek, például EGF vagy 12-O-tetradekanoil-forbol-13-acetát (TPA) által elindított jelek továbbításában. A MEK1 konstitutív aktiválása sejttranszformációt okoz, és a MEK kináz aktivitás blokkolása elnyomhatja a transzformációt és a tumor növekedését in vivo (35, 129).
A Ras/Raf/MEK/MAPK útvonal EGFR-aktiválása. Az EGF megkötése az EGFR aktiválódását és foszforilezését eredményezi tirozin-maradványain, ami végül beindítja a Ras aktivációját. A Ras aktiválja a Raf-et, amely foszforilálja a MEK1/2-t, amely ezt követően aktiválja a MAP-kinázokat vagy az MKK-jelátvitelt. A MAP kináz és az MKK kaszkádok downstream effektorai közé tartoznak az ERK-k, az RSK-k és a JNK-k. Az AP-1 és az NF-κB transzaktiváció ennek az útnak az aktiválásában gyakori eredménye, és fokozott sejtranszformációt, rákos sejtproliferációt és tumor növekedést eredményezhet. AP-1, aktivátor protein-1; JNK-k, c-Jun N-terminális kinázok; MKK, MAP kináz kináz; NF-KB, nukleáris faktor-kappaB; RSK-k, p90 riboszomális S6 kinázok.
A Ras/Raf/MEK/MAPK útvonal aktiválása általában kiváltja az AP-1 tranzakciót. A Jun fehérjék homodimerizációja vagy a két alcsalád Jun és Fos fehérjéinek heterodimerizációja vagy más transzkripciós faktorok, ideértve az aktiváló 2-es transzkripciós faktort (ATF2), a komplexek számára képesek felismerni a specifikus DNS-szekvenciákat, amelyek TPA-reagálóként vagy AP-ként ismertek. 1 oldal. Az aktiválás nettó eredménye tartalmazhatja a fokozott proliferációt, az angiogenezist, az áttéteket, a túlélést, a mozgékonyságot és az apoptózis csökkenését. TPA, 12-O-tetradekanoil-forbol-13-acetát.
A laboratóriumunkban megvizsgált flavonoidvegyületek közül sok úgy tűnik, hogy a MEK-t részesíti előnyben fehérje célként (5. ábra; 1. táblázat), bár a flavonoidok többsége több fehérjét céloz meg hatásuk kifejtése érdekében. A különféle flavonoidok és a MEK kölcsönhatása közötti közös jellemző az adenozin-trifoszfát (ATP) nem versenyképes gátlása. A delphinidin (1. táblázat) egy antocianidin (azaz növényi pigment), amely sok gyümölcsben, különösen bogyókban és gránátalmában található meg. Ez a vegyület gyengítette az EGF- vagy H-Ras-indukált sejttranszformációt és csökkentette a ciklooxigenáz 2 (COX2) expresszióját a JB6 P + epidermális bőrsejtekben azáltal, hogy közvetlenül kötődött a Raf és MEK kináz aktivitásokhoz és elnyomta azokat (70). A delphinidin kötődése a Raf1-hez vagy a MEK1-hez valóban nem volt versenyképes az ATP-vel, amely hasonló volt a többi MEK-inhibitorhoz. A Raf és a MEK delphinidin általi gátlása a MEK, az ERK és az RSK TPA által indukált foszforilációjának ezt követő gyengülését is eredményezte, és csökkentette a TPA által indukált AP-1 és nukleáris faktor-kappaB (NF-κB) transzkripciós faktorok aktivációját 70).
A flavonoidok előnyben részesítik a Raf1-et és a MEK1-et, valamint azok downstream szubsztrátfehérjéit gátló hatásuk kifejtése érdekében. Sok flavonoid előnyös célpontja a Raf1 és a MEK1 nem versenyképes (azaz ATP-vel rendelkező) gátlása. Sok vegyület az ATP-vel versenyképes módon elnyomja az ERK2, RSK2, MKK4 és Cot kináz aktivitását is. A gátlás eredményei között szerepelt a tumor promoter által indukált sejttranszformáció csökkenése, a COX2 aktivitás, az AP-1 és az NF-KB aktiváció, a tumor növekedése és proliferációja, valamint a tumor képződése in vivo. ATP, adenozin-trifoszfát; COX2, ciklooxigenáz 2.
Asztal 1.
A kiválasztott flavonoidok fehérje céljai
A kvercetin (1. táblázat) egy flavon (azaz flavonol) vegyület, amely magas szinten található meg különböző ételekben, beleértve a szőlőt és a vörösbort is. A kvercetin állítólag elnyomta a rákos sejtek szaporodását, de nem befolyásolta a normális sejteket, és csökkentette a TPA által elősegített egér bőrrákot is (132). Beszámoltunk arról, hogy a vörösbor kivonat (RWE) vagy a kvercetin csökkentette a TPA által kiváltott neoplasztikus JB6 epidermális bőrsejt transzformációt, ami az AP-1 és az NF-κB aktiváció dózisfüggő csökkenésével járt (92). A lehúzási vizsgálatok eredményei azt mutatták, hogy az RWE vagy a kvercetin közvetlenül kötődött akár a Raf1-hez, akár a MEK1-hez, és csökkentette az ERK-k és az RSK TPA-indukálta foszforilációját. Annak ellenére, hogy az RWE vagy a quercetin elnyomta a Raf1 kináz aktivitást, a MEK1-re gyakorolt hatása sokkal erősebb volt. Ezenkívül a kvercetin erősebb gátló hatást fejtett ki, mint a PD098059, amely a MEK jól ismert farmakológiai inhibitora. Az in silico protein dokkolási eredmények azt sugallják, hogy a kvercetin hidrogénkötéseket képezett a Ser212 gerincoszlop amidcsoportjával a MEK1-en, ami kulcsfontosságú kölcsönhatás a MEK1 aktivációs hurok inaktív konformációjának stabilizálásában (92).
Az izoflavonok a flavonoid vegyületek egyik alcsaládja, amelyek nemcsak antioxidánsként működnek, hanem hasonlóan viselkednek a gyenge ösztrogén-aktív vegyületekhez is, és ezért fitoösztrogéneknek nevezik őket (53). Úgy gondolják, hogy ezek a vegyületek a szója fő komponensei, amelyek felelősek a jelentett biológiai hatásokért (36). A vastagbélben lévő enzimek átalakítják a szója izoflavonokat, például a daidzeint, számos metabolittá, köztük ekvol (66, 73), 6,7,4′-trihidroxi-izoflavon [6,7,4′-THIF (81)] és 7,3 ′, 4′-trihidroxi-izoflavon [7,3 ′, 4′-THIF (81, 82) 1. táblázat]. Epidemiológiai és állatkísérletek szerint az izoflavonok csökkenthetik a rák kockázatát. Ezzel szemben a daganatot elősegítő hatásokat néhány ember- és állatkísérletben is megfigyelték. Így a szójavegyületek, például a daidzein és metabolitjai, az equol, a 6,7,4′-THIF és a 7,3 ’, 4′-THIF mögöttes molekuláris célok és aktivitási mechanizmusok tisztázása jelentős és kritikus a látszólagos megértés szempontjából. a szójafogyasztás ellentmondásos hatásai. Megállapítottuk, hogy a daidzein metabolitjai hatékonyabb kemopreventív szerek, mint a szülő daidzein vegyület. Fehérje-célpontjaik azonban egyedülállóak.
Kimutatták, hogy az Equol (1. táblázat) véd az UV-indukálta bőrrák ellen egy szőrtelen egérmodellben (142). Összehasonlítottuk az ekvol és a daidzein hatását a TPA által indukált AP-1 aktivitásra és a JB6 P + sejtek transzformációjára, és az eredmények azt mutatták, hogy az ekvol, de a daidzein nem, a MEK/ERK/p90RSK/AP-1 jelátviteli utat célozta meg. Erősen elnyomta a MEK kináz aktivitást, ami a c-Fos aktiváció és AP-1 transzaktiváció elnyomását és a sejttranszformáció csökkenését eredményezte (71). Az ekvol, de nem daidzein, az ERK1/2, a p90RSK és az Elk TPA által indukált foszforilációja, de a MEK vagy a JNK foszforilezése nem. Az equol azonban gátolta a MEK1-et, a Raf1-kináz-aktivitást azonban nem. Fontos, hogy a MEK aktivitásának elnyomása érdekében specifikusan a MEK-hez kötődik az ATP-vel az ATP-vel (71). Ezek az eredmények feltárták az equol rákellenes hatásának molekuláris alapját, és részben figyelembe vehetik a szójabab jelentett kemopreventív hatásait. A daidzein egyéb metabolitjai nem gátolták és nem léptek kölcsönhatásba a MEK-kel vagy a Raf-dal, és később ezeket tárgyaljuk.
Az izorhamnetin (1. táblázat) egy másik növényi flavonol, amely különféle gyümölcsökben és gyógynövényekben található meg. Beszámoltunk arról, hogy az izorhamnetin gátolta a JB6 sejtek EGF-indukálta neoplasztikus sejttranszformációját, és elnyomta az A431 humán hámrák sejtek rögzítésfüggő és független növekedését (75). Az izorhamnetin gyengítette az EGF által kiváltott COX2 expressziót JB6 és A431 sejtekben, és csökkentette az A431 tumor növekedését és a COX2 expresszióját egy xenograft egér modellben. Az izorhamnetin hatékonyan elnyomta az ERK-k, az RSK, a p70S6 kináz és az Akt EGF-indukálta foszforaltionját. Ezeket a hatásokat a kötési vizsgálati eredmények magyarázták, jelezve, hogy az izorhamnetin közvetlenül kötődik a MEK1-hez ATP-nem versenyképes módon, hogy elnyomja aktivitását.
A MEK aktivitás downstream effektorai közé tartoznak az ERK és RSK fehérjék. Ezek a kinázok szintén népszerű közvetlen flavonoid célpontok (5. ábra). A kvercetin-3-metil-éter, egy természetben előforduló vegyület, amely különféle növényekben van jelen, beleértve az ehető fügekaktusz-kaktuszt, állítólag erős rákellenes aktivitással rendelkezik. Megállapítottuk, hogy a kvercetin-3-metil-éter képes szabályozni az emlőrák sejtjeinek szaporodását, amelyek érzékenyek vagy rezisztensek voltak a receptor tirozin kináz inhibitorra, a lapatinibre (95). Úgy tűnt, hogy a kvercetin-3-metil-éter főként azáltal, hogy bármelyik sejttípusban sejtciklus leállást és apoptózist indukál (95). Azt is tapasztaltuk, hogy a kvercetin-3-metil-éter dózis- és időfüggő módon gátolta az egér bőr epidermális JB6 P + sejtjeinek szaporodását azáltal, hogy előidézte a sejtciklus G2/M fázis felhalmozódását, csökkentette az AP-1 aktiválódását és az ERK foszforilációját (94) . A nettó eredmény a TPA által indukált JB6 neoplasztikus sejttranszformáció elnyomása volt. A lehúzásos vizsgálatok azt mutatták, hogy a kvercetin-3-metil-éter közvetlenül kötődik az ERK-khoz, az ERK2-t átterjedve, hogy hatásos kemopreventív aktivitását fejtse ki (94).
A riboszomális S6 kináz 2 (RSK2) a p90RSK (RSK) fehérjecsalád tagja. Ez egy széles körben expresszált szerin/treonin kináz, amelyet foszforileznek és aktiválnak az ERK-k és a foszfoinozidid-függő kináz 1 (PDK1) válaszul a növekedési faktorokra, és aktiválása fokozza a sejtek túlélését. Az RSK2 fontos szabályozója a tumor promoter által indukált sejttranszformációnak, és magas expressziója növeli a JB6 Cl41 bőrsejtek proliferációját, valamint a rögzítéstől független transzformációt és a gócképződést az NIH3T3 sejtekben (26). Az RSK2 fehérje szintje jelentősen magasabb a rákos sejtvonalakban, valamint a rákos szövetekben, összehasonlítva a nem rosszindulatú sejtvonalakkal vagy a normál szövetekkel. Megoldottuk és közöltük az NH2-terminális kináz domén kristályszerkezetét [NTD; (102)] és a COOH-terminális kináz domén [CTD; (103)] és ezeket a struktúrákat felhasználta ezen onkogén kináz új inhibitorainak azonosítására.
A kaempferol (1. táblázat) egy flavonol, amely különféle természetes forrásokban van jelen, különösen a hagymalevélben (832,0 mg/kg) (107). Megállapítottuk, hogy a kaempferol gátolta a rosszindulatú humán rákos sejtvonalak, köztük az A431 hámrák, az SK-MEL-5 és az SK-MEL-28 melanomák, valamint a HCT-116 vastagbélrák sejtek szaporodását (27). A gátlás mechanizmusa összefüggött az RSK2-hez való közvetlen kötődésével az RSK2 aktivitás elnyomása érdekében. Bizonyítottuk, hogy az ERK-k által közvetített CTD aktiválásához az RSK2 NTD aktiválása szükséges. A számítási modellezés azt jósolta, hogy a kaempferol kötődik az NTD-hez, de a CTD-hez (27) nem kapcsolódik aktivitásának kifejtéséhez. Ezt az előrejelzést kísérletileg megerősítették, és mutageneziskísérleteket hajtottunk végre annak egyértelmű bemutatására, hogy a Val82 és a Lys100 kritikus aminosavak a kaempferol kötődéséhez és az RSK2 aktivitáshoz (27).
Az erodiktol (1. táblázat) egy flavanon, amely különböző gyümölcsökben található meg, és felfedeztük, hogy az RSK2 NTD-jéhez is kötődik, hogy gátolja az RSK2 N-terminális kináz aktivitását (79, 85, 98). Ugyanebben a tanulmányban azt találtuk, hogy az ATF1 az RSK2 új szubsztrátja, és hogy az RSK2-ATF1 jelátvitel fontos szerepet játszik az EGF által kiváltott neoplasztikus sejttranszformációban. Az RSK2 foszforilálta az ATF1-et a Ser63-on, és fokozta az ATF1 transzkripciós aktivitását és a tumor promoter által indukált JB6 sejttranszformációt. Az erodiktol nem volt hatással az RSK, MEK1/2, ERK1/2, p38 vagy JNK foszforilezésére, ami azt jelzi, hogy ez a vegyület specifikusan elnyomja az RSK2 jelátvitelt. Az ATF1 RSK2 általi foszforilációját és annak sokféle sejtes hatását, beleértve a Ras által közvetített fókuszképződést, jelentősen csillapították az eriodictyol-kezelés (98). A Ras/Raf/MEK/MAPK út mellett a flavanoidok erősen kölcsönhatásba lépnek az Src és Fyn trirozin kinázokkal is, hogy zavarják aktivitásukat (6. ábra).
- Új gomba-rovar szimbiózis tenyésztési, molekuláris és szövettani módszerek határozzák meg a szaprofita
- Renata Vallecillo Molekuláris és Sejtbiológia
- Hírek és közlemények Molecular and Cellular Biology Graduate Program at UMass Amherst
- Hírek és közlemények Molecular and Cellular Biology Graduate Program at UMass Amherst
- Válogatott bébiétel-gabonafélék és -levek oldható galaktóz-tartalma - ScienceDirect