Szisztematikus megközelítés az idiopátiás peptikus fekélyek diagnosztizálásához és kezeléséhez
Csen-Suan Csung
1 Belgyógyászati Osztály, Távol-Keleti Emlékkórház, Új-Tajpej város, Tajvan
Tsung-Hsien Chiang
2 Tajvani Nemzeti Egyetemi Kórház Belgyógyászati Osztálya, Tajpej, Tajvan
Yi-Chia Lee
2 Tajvani Nemzeti Egyetemi Kórház Belgyógyászati Osztálya, Tajpej, Tajvan
Absztrakt
Az idiopátiás peptikus fekély meghatározása ismeretlen okú fekély vagy spontán jelentkező fekély. A kezelés első lépése a gyakori lehetséges okok kizárása, ideértve a Helicobacter pylori fertőzést, más kórokozókkal való fertőzést, fekélyes gyógyszereket és a nem gyakori betegségeket, amelyek felső gyomor-bélrendszeri megnyilvánulásokkal járnak. Ha az összes ismert ok kizárt, akkor diagnosztizálható az idiopátiás peptikus fekély. Az a beteg, akinek peptikus fekélye idiopátiás, nagyobb a komplikált fekélybetegség kockázata, a gyomorsav-szuppresszánsokra adott gyengébb válasz és a kezelés után magasabb a kiújulási arány. A betegséghez kapcsolódó kockázati tényezők közé tartozhat a genetikai hajlam, az idősebb kor, a krónikus mesenterialis ischaemia, a dohányzás, az ezzel járó betegségek, az Amerikai Aneszteziológusok Társaságának magasabb pontszáma és a magasabb stressz. Ezért a kialakuló betegség diagnosztizálásának és kezelésének szisztematikusan meg kell vizsgálnia az összes ismert okot és kezelnie kell az alapbetegséget, ugyanakkor rendszeres endoszkópos megfigyelést kell tartalmaznia a fekély gyógyulásának megerősítésére és a protonpumpa-gátlók eseti alapú alkalmazását.
BEVEZETÉS
A Helicobacter pylori fertőzés és a nem szteroid gyulladáscsökkentők (NSAID-ok) a peptikus fekélybetegség (PUD) gyakori okai. Az utóbbi években azonban a nem-H globális előfordulása. pylori, a nem NSAID PUD növekedett. Ennek a kialakulóban lévő betegségnek a kezelése egyre fontosabb. Bár a klinikusok hajlamosak leírni a nem H-t. pylori, a nem NSAID PUD mint idiopátiás, az „idiopátiás” kifejezés olyan betegségre utal, amelynek oka nem ismert, vagy úgy tűnik, hogy spontán ered. Ezért a H. pylori kimaradt diagnózisa és az NSAID-k/aszpirin fel nem ismert használata mellett az idiopátiás peptikus fekélybetegség (IPUD) diagnózisának ki kell zárnia a PUD minden más elismert etiológiáját is, amely szisztematikus megközelítést igényel, amely minden lehetségeset figyelembe vesz. okoz.
NÖVEK-e AZ IDIOPÁT PEPTIKUS ULCEREK ARÁNYA VAGY ABSZOLUT SZÁMA?
A PUD kezelése drámai módon megváltozott, miután felfedezték a H. pylori-t, amely a krónikus gyomorhurut, a peptikus fekély és a gyomorrák fő oka. A világ népességének több mint fele fertőzött H. pylori-val, különösen a fejlődő országokban [1,2]. Történelmileg a H. pylori fertőzést a nyombélfekélyben szenvedő betegek 90–100% -ában, a gyomorfekélyben szenvedő betegek 60–100% -ában (GU) találták [3]. A PUD-ban szenvedő betegeknél első vonalbeli kezelésként a H. pylori fertőzés teszt- és kezelési stratégiáját fogadták el, míg a tünetmentes populációban a H. pylori fertőzés szűrési és kezelési stratégiáját hatékony megközelítésnek tekintették. csökkenti a gyomorrák jövőbeli kockázatát [4,5]. Ezek a stratégiák a H. pylori-val kapcsolatos peptikus fekélyek előfordulásának folyamatos csökkenéséhez vezettek. Ázsiában végzett vizsgálatok azt is kimutatták, hogy a H. pylori fertőzés előfordulása fiatalabb betegeknél csökkent [6-10], valószínűleg a higiénia és a higiénia javulásának köszönhetően. Ezzel szemben a nem szteroid gyulladáscsökkentők/aszpirin globális használata egyre elterjedtebb az öregedő népességben, és az orvosi kísérő betegségek gyakoriak. Így a nem-H. A pylori PUD viszonylag gyakoribb a fekélyes gyógyszerek fokozott használata miatt [11].
Graham [12] modellt javasolt a H. pylori-pozitív és -negatív fekélybetegség változó arányának szemléltetésére. Ha a H. pylori prevalenciája 80% -ról 40% -ra csökken, és a PUD kockázata a H. pylori-tól eltérő okok miatt stabil marad, kb. 250/100 000 fő, a fekélyek száma 1050-ről 650-re csökken 100 000 emberre, de a H. pylori-negatív PUD aránya 24% -ról 38% -ra nőne [12]. Az epidemiológiai vizsgálatok következetesen a H. pylori-negatív PUD növekvő hányadáról számoltak be, különösen az ázsiai országokban. Az 1990-es években az Egyesült Államokban végzett vizsgálatok azt mutatták, hogy a DU-knak csak körülbelül 6% -a nem társult H. pylori fertőzéshez, különösen a kaukázusiaknál [13]. A későbbi vizsgálatok azonban ellentmondottak ezeknek az eredményeknek. A floridai Orlandoban végzett tanulmány megállapította, hogy a DU-betegek csupán 32% -a volt H. pylori-pozitív, és a vérző fekélyek csak 25% -a társult H. pylori-hoz [14]. Egy nagyobb léptékű, 305 esetet tartalmazó vizsgálat azt mutatta
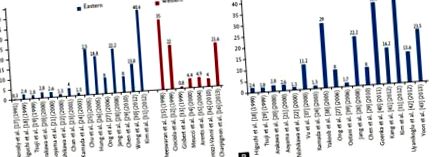
A PUD 35% -a nem volt társítva H. pylori-val vagy NSAID-okkal [15], míg egy több központú francia tanulmány kimutatta, hogy a PUD-ban szenvedő betegek körülbelül 21,6% -ánál nem volt sem H. pylori fertőzés, sem kórtörténetében nem használtak ulcerogén gyógyszereket [16]. Így úgy tűnik, hogy az idiopátiás fekély előfordulása stabil marad a nyugati országokban, szemben az ázsiai országokban az utóbbi években növekvő tendenciával (1. ábra) [15-43].
(A) A klinikai idiopátiás peptikus fekélybetegség globális előfordulása 1991 és 2013 között nagyszabású vizsgálatokban számolt be, amelyek mintamérete meghaladja a 300 beteget. (B) Jelentések az idiopátiás peptikus fekélybetegségről az ázsiai országokban, kivéve a vérző peptikus fekélyekre vonatkozó vizsgálatokat.
Ázsiai országokban egy 1991-ben publikált tanulmány kimutatta, hogy a DU-k csupán 6% -a volt H. pylori negatív, és ha a fekélyes szereket kizárták, akkor az előfordulás csak 0,3% volt [17]. Egy 2006-os japán tanulmányban a DU az esetek egyharmadában idiopátiás volt [38], és egy 2007-ben elvégzett koreai tanulmányban az idiopátiás fekélyek aránya 40,6% -nak bizonyult [31]. Úgy tűnik, hogy az idiopátiás fekélyek növekedésének trendje exponenciális görbét követ, ha nagyszabású vizsgálatokra összpontosítunk> 300 vizsgálati populációval (1A. Ábra), és kizárjuk azokat a vizsgálatokat, amelyek vérző PUD-ot tartalmaznak (1B. Ábra). A változó etiológiának további bizonyítékaként a Hongkongban végzett kutatások azt találták, hogy csak a H. pylori-val kapcsolatos vérző fekély abszolút száma csökken, míg a H. pylori-negatív vérző fekélyek száma stabil maradt [33,44-46] . Így a felhalmozott bizonyítékok alátámasztják a Graham [12] által javasolt koncepciót: nem-H. A pylori- és nem NSAID-okkal összefüggő fekélybetegségek nagyobb valószínűséggel fordulnak elő idősebb, betegebb betegeknél, jobban ellenállnak a savszuppressziós terápiának, és nagyobb a vérzés és megismétlődés kockázata, és nagyobb az összhalandóság aránya hagyományos H. pylori-pozitív PUD [44,45].
IDIOPÁT PREPTIKUS ULCER BETEGSÉG: A KIZÁRÁS DIAGNOSZTIKA
Mivel az IPUD definíció szerint PUD, amely azonosítható ok nélkül merül fel, ez a kizárás diagnózisa. A lehetséges kizárandó etiológiákat az 1. táblázat mutatja (felső panel), amely magában foglalhatja a kimaradt H. pylori fertőzést, az ulcerogén gyógyszerek azonosítatlan alkalmazását, a felső gyomor-bél traktus megnyilvánulásával járó ritka szisztémás betegségeket, a gyomor túlsavasságát és egyéb ritka fertőzéseket a felső emésztőrendszer.
Asztal 1.
Az idiopátiás peptikus fekély és a kapcsolódó kockázati tényezők diagnosztizálásához kizárandó etiológiák
| Kizárandó etiológiák |
| A Helicobacter pylori fertőzés kimaradt diagnózisa |
| Ulcerogén gyógyszerek (pl. Fel nem ismert nem szteroid gyulladáscsökkentők, aszpirin és más ulcerogén gyógyszerek) burkolt használata |
| Ritka szisztémás megbetegedések a felső emésztőrendszeri megnyilvánulásokkal (pl. Crohn-kór, mastocytosis, sarcoidosis, amyloidosis, eozinofil gastroenteritis és vasculitis) |
| A gyomor túlsúlya (azaz Zollinger-Ellison szindróma). |
| Egyéb fertőzések (pl. Helicobacter heilmanii, citomegalovírus, herpes simplex vírus, tuberkulózis, szifilisz és gombás fertőzés) |
| Az idiopátiás fekélybetegség kockázati tényezői |
| Demográfiai kockázati tényezők (pl. Fehér faj és idősebb kor) |
| Pszichoaktív szerek használata (pl. Dohányzás és alkohol) |
| Genetikai kockázati tényezők (pl. Mucin gének és HLA-DQA1) |
| Komorbid betegségek (pl. Májcirrhosis, végstádiumú vesebetegség, diabetes mellitus, cerebrovaszkuláris baleset és rosszindulatú daganatok) |
| Krónikus mesenterialis ischaemia |
| Magasabb pszichológiai stressz |
A H. pylori hibás diagnózisa
Számos módszer áll rendelkezésre a H. pylori fertőzés kimutatására. Ezeket a módszereket az jellemzi, hogy szükség van-e nyálkahártya-mintára az elemzéshez. A biopszián alapuló vizsgálatok magukban foglalják a szövettani kiértékelést, a tenyésztést, a polimeráz láncreakciót és a gyors ureáz tesztet (RUT). Alternatív megoldásként a nem invazív módszerek magukban foglalhatják a karbamid lélegeztető tesztet (UBT), a szerológiát és a széklet antigéntesztet (SAT). Egy metaanalízis a következő összesített érzékenységet és specifitást tárta fel a különböző módszerek esetében: RUT 0,67 és 0,93; szövettan 0,70 és 0,90; tenyészet 0,45 és 0,98; UBT 0,93 és 0,92; SAT 0,87 és 0,70; illetve 0,88 és 0,69 [46] szerológia, amelyek egyértelműen bizonyítják, hogy a különböző tesztek mindegyikének megvannak a maga korlátai, és egyetlen negatív teszt nem zárja ki a H. pylori fertőzést.
Az antibiotikumok vagy a protonpumpa-gátlók (PPI) jelenlegi vagy közelmúltbeli használata ismert módon befolyásolja a H. pylori-tesztek pontosságát. Ezek a gyógyszerek csökkentik a baktériumok koncentrációját, ami hamis-negatív eredményekhez vezet. Számos tanulmány kimutatta, hogy az antibiotikum-terápiában részesülő betegeknél alacsonyabb a hozam a H. pylori fertőzés tesztelésében. Borody és mtsai. [17] azt mutatta
A H. pylori-negatív DU-betegek 22% -a beszámolt arról, hogy nemrégiben alkalmazott antibiotikumokat. Gisbert és mtsai. [33] alacsonyabb H. pylori prevalenciát talált azoknál a DU-betegeknél is, akiknél korábban antibiotikum-terápia volt, azokhoz képest, akik nem (78% vs. 96%). Egy másik tanulmányban a H. pylori-negatív DU prevalenciája sokkal alacsonyabbnak bizonyult, ha kizárták azokat a betegeket, akik antibiotikumot szedtek a tesztelés után 4 héten belül [47]. Ezenkívül a PPI-k és a hisztamin-2 receptor antagonisták (H2RA) alkalmazása szintén hamis negatív eredményeket okozhat a gyomorsav-szekréció csökkentésével és a H. pylori növekedésének gátlásával. A H. pylori fertőzés szempontjából pozitívaknak számító betegek körülbelül egyharmadának negatív UBT eredménye volt, miközben PPI-ket kaptak [48]. A tanulmány még azt is kimutatta, hogy azoknak a betegeknek az aránya, akiknek UBT-eredménye pozitívnak bizonyult a PPI-terápia befejezése után, 91% volt a 3. napon, 97% a 7. napon és 100% a 14. napon [48]. Chey és mtsai. [49] azt is kimutatta, hogy mind a PPI-k, mind a H2RA-k befolyásolhatják az UBT érzékenységét, egyértelmű vagy 61% -os hamis negatív eredménnyel.
Az endoszkóposan jóindulatúan megjelenő GU-k 5% -a rosszindulatú [60,61]. A gyomor pre-rosszindulatú állapotának endoszkópos megfigyelése hasznos volt a korai stádiumú rosszindulatú daganatok azonosításában 3-6 hónapos utólátogatások alkalmával, amelyek a GU gyógyulásának megerősítésére voltak tervezve [62,63]. Bár az endoszkópos megfigyelés optimális időintervallumát még meg kell határozni, az IPUD ésszerű megközelítése az endoszkópos biopsziák megismétlése, elegendő szövet előállítása submucosa bevonásával vagy célzott optikai biopszia képjavított endoszkópiával [64].
Gyomorfekély esete a gyomorrák kimaradt diagnózisával. (A) Egy gyógyító gyomorfekélyt láthattunk az alsó test kisebb görbületénél. Egy biopszia csak krónikus inflammációt mutatott. (B) A fekély az endoszkópia után 3 hónapon keresztül jelen volt a folyamatos protonpumpa-gátló kezelés ellenére. Az ismételt biopszia jól differenciált adenokarcinómát mutatott. (C) A daganat szélének képe nyilakkal körvonalazva kromoendoszkópia alatt indigókarminnal permetezve az endoszkópos reszekció előtt. (D) Az en bloc reszektált példány képe.
Kivéve a ritka etiológiákat
A PUD ritka etiológiája szokatlan szisztémás betegségeket és szokatlan fertőző kórokozókat tartalmazhat. Nem gyakori szisztémás betegségek, például Crohn-betegség (3. ábra), mastocytosis, amyloidosis, sarcoidosis, vasculitis, eozinofil gastroenteritis és Zollinger-Ellison-szindróma (4. ábra) a PUD felső gyomor-bélrendszeri megnyilvánulásainak lehetséges forrásai. Az alsó gyomor-bél traktus szűrése Crohn-betegség szempontjából, valamint specifikus laboratóriumi és radiológiai vizsgálatok (például a szérum éhomi gasztrin ismételt mérése, szekretin stimulációs teszt, a gyomorsav-szekréció mennyiségi meghatározása, a szérum kromogranin A mérése, radiológiai vizsgálatok és endoszkópos ultrahangvizsgálat Zollinger- Ellison-szindróma) szükségesek e nem mindennapi betegségek kizárásához. A PUD ritka fertőző okai lehetnek Helicobacter heilmanii, tuberkulózis, szifilisz, citomegalovírus (5. ábra), herpes simplex vírus és gombás fertőzés (6. ábra).
Crohn-betegség esete a felső emésztőrendszeri megnyilvánulásokkal. (A) A szájpadláson egy szájüregi fekélyt találtak. (B) Egy gyomorfekélyt észleltek az antrum hátsó falán. (C) A kolonoszkópos vizsgálat során több vastagbélfekélyt láttak macskakő megjelenéssel a felszálló vastagbél felett és (D) leszálló vastagbél felett.
A gyomor túl savasságának esete Zollinger-Ellison szindróma miatt. (A) Az ismételt felső endoszkópia gyengén gyógyult nyombélfekélyt és (B) reflux eróziós nyelőcsőgyulladást mutatott, ami gyomorsav-túltermelésre utal. (C) A hasi szonográfia során hasnyálmirigy daganatot figyeltek meg, amely a hasnyálmirigy uncinate folyamatából származott. (D) A hasnyálmirigydaganat mintáját neuroendokrin tumorként (kör) igazolták.
Gyomor- és nyombélfekély esete citomegalovírus fertőzés következtében. Negatív Helicobacter pylori teszttel az erythema több területét találták a gyomor alsó testén (A) és a gyomor antrumán (B). (C) Vérző fekélyt észleltek a gyomor antrumának hátsó falán. (D) Diffúz fekélyek a jejunumban, amelyet ballonos asszisztált enteroszkópiával találtak. A biopszia pozitív volt a citomegalovírus zárványtestek esetében.
A mucormycosis okozta gyomorfekély esete. (A) A felső endoszkópia során zöldes bevonatú gyomorfekélyt észleltek a középső test nagyobb görbületében. (B) A patológia számos derékszögű, pauci-szeptált és szalagszerű hifát (nyilak) mutatott, ami gombás fertőzésre utal (H&E, × 100).
Összefoglalva, a klasszikus IPUD pontos diagnosztizálása szisztematikus megközelítést igényel, a 2. táblázatban leírtak szerint. A hamis-negatív eredmény kockázatának csökkentése érdekében ajánlott a gyomor és a duodenum H. pylori fertőzésének állapotának megerősítése legalább három párhuzamos vizsgálattal. A gyógyszeres előzmények alapos áttekintése fontos a potenciális ulcerogén gyógyszerek alkalmazásának azonosításához. Ezenkívül a jóindulatúan megjelenő fekélyes elváltozás teljes szövettani vizsgálata elengedhetetlen a rosszindulatú daganat lehetőségének kizárása érdekében. Ismételt endoszkópos biopsziák, optikai célzott biopszia vagy a nyálkahártya rétegénél mélyebb szövetek megszerzése javíthatja a diagnosztikai pontosságot. A Zollinger-Ellison szindrómát mindig szem előtt kell tartani, ha rosszul gyógyuló peptikus fekélyekkel találkozunk. Végül, a differenciáldiagnózis során figyelembe kell venni a ritka fertőző ágenseket, különösen immunhiányos betegeknél.
2. táblázat.
Az idiopátiás peptikus fekély diagnosztizálása előtt áttekintendő szempontok
| A Helicobacter pylori fertőzés kizárása |
| A fekélyes gyógyszerek kórtörténete |
| A hisztopatológia teljessége az okkult rosszindulatú daganat, a gyulladásos bélbetegség vagy a vasculitis kizárására |
| A Zollinger-Ellison-szindróma kizárása, ideértve az éhomi gasztrin és a kromogranin A szérumszintjének mérését, a bazális és maximális gyomorsav-szekréció, a szekretin-teszt és a radiológiai vizsgálatok |
| Egyéb fertőző kórokozók kizárása |
KOCKÁZATTÉNYEZŐK ÉS A KLASSZIKUS IPUD KLINIKAI FOLYAMATA
A klasszikus IPUD kockázati tényezői lehetnek demográfiai kockázati tényezők, pszichoaktív szerek használata, genetikai kockázati tényezők, társbetegségek, krónikus mesenterialis ischaemia és magasabb pszichés stressz (1. táblázat, alsó panel).
Egy alacsony diagram az idiopátiás peptikus fekélybetegség diagnosztizálásához és kezeléséhez. H. pylori, Helicobacter pylori; NSAID, nem szteroid gyulladáscsökkentő gyógyszer; ASA, acetilszalicilsav (aszpirin); H2RA, hisztamin-2 receptor antagonisták; PPI, protonpumpa inhibitor. Quan és mtsai. [45], a Nature Publishing Group engedélyével.
KÖVETKEZTETÉSEK
Az idiopátiás fekélyek arányának növekedése világszerte beigazolódott, és a peptikus fekély, amelyet egykor H. pylori felfedezése után fertőző betegségnek tekintettek, fokozatosan visszatért az eredeti „nincs sav, nincs fekély” elmélethez. Tekintettel arra, hogy az IPUD prognózisa gyengébb, mint a H. pylori vagy NSAID-okhoz kapcsolódó PUD prognózisa, a H. pylori fertőzés gondos párhuzamos teszteléssel történő gondos értékelése, a gyógyszeres előzmények részletes áttekintése és más lehetséges okok alapos kizárása kiemelt fontosságú az IPUD diagnózisának felállítása. További jól megtervezett klinikai vizsgálatokra van szükség az IPUD természetes kórtörténetének tisztázásához és a kialakulóban lévő betegség kezelési stratégiájának optimalizálásához.
Lábjegyzetek
A cikk szempontjából releváns esetleges összeférhetetlenségről nem számoltak be.
- Bakteriális diszbiózis - tünetek, diagnózis és kezelés
- Allergiás vastagbélgyulladás diagnózisa; Kezelés Boston Gyermekek; s Kórház
- Konzervatív megközelítés a fogak eróziójának kezeléséről
- Vakbélgyulladás gyermekeknél - okok, tünetek, diagnózis, kezelés és megelőzés
- A törött kar tünetei, okai, diagnózisa, kezelése