Mozgásszervi kulcs
A leggyorsabb mozgásszervi betekintési motor
- itthon
- Belépés
- Regisztráció
- Kategóriák
- MANUÁLIS terapeuta
- MUSKULOSZKELETI ORVOS
- ORTOPÉDIAI
- FIZIKAI GYÓGYSZER ÉS REHABILITÁCIÓ
- REUMATOLÓGIA
- SPORTGYÓGYSZER
- Ról ről
- Arany tagság
- Kapcsolatba lépni
68 Táplálkozás és reumatikus betegségek
Az antigént bemutató sejteken (APC) expresszált MHC-molekulák száma fontos meghatározója a T-sejt antigénre adott válaszának. Az RA-ban szenvedő betegek magas szintű MHC II osztályú expresszióval rendelkeznek a T-sejteken és a szinoviális béléssejteken. 5 In vitro vizsgálatok azt mutatják, hogy az EPA és/vagy DHA csökkenti a HLA-DR és HLA-DP molekulák monocita expresszióját és csökkenti a monociták azon képességét, hogy antigént jelenítsenek meg autológ limfocitákban. 6 Így az n-3 zsírsavak gyulladáscsökkentő hatást fejthetnek ki a patogén T-sejtek aktivációjának elnyomásán keresztül az APC funkció gátlásán keresztül.
Az endothelsejteken és a leukocitákon expresszált tapadási molekulák közvetítik a sejtek keringéséből a szövetekbe jutását. Az intercelluláris adhéziós molekula-1 (ICAM-1) és rokon receptora, a leukocita funkcióval összefüggő antigén (LFA) -1 fontosnak bizonyult a leukociták gyulladt szinoviumba történő migrációjában állatmodellekben. 7 Az ICAM-1 blokádról szintén beszámoltak arról, hogy csökkenti a betegség aktivitását RA-ban. 8 Az in vitro n-3 zsírsavak csökkentik az emberi monocita ICAM-1 és LFA-1 expresszióját. 6 Ezenkívül az étrendi n-3 zsírsav-kiegészítés csökkenti az oldható ICAM-1 és a vaszkuláris sejtadhéziós molekula-1 (VCAM-1) plazmakoncentrációit, 9 bár nem számoltak be arról, hogy ezen adhéziós molekulák sejtfelszíni expressziója is csökken.
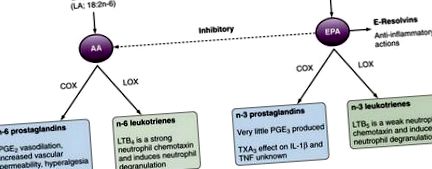
Az AA és az EPA egyensúlya az étrendi zsírsavbevitel révén megváltoztatható. Emberben az étrendi ALA átalakulása szöveti EPA -vá nem hatékony, és a hal/halolajok hatékonyabb módszerek az EPA és a DHA növelésére a szövetekben. A szövetekben az AA/EPA arány változásai az eikozanoid termelésre és az ebből eredő gyulladáscsökkentő/gyulladáscsökkentő környezetre hatással vannak. Az emberi étrend-kiegészítés halolajjal a PGE 2, 12 TXA 2, 12 és LTB 4 13 termelésének csökkenését eredményezi, a TXA 3 14 és az LTB 5 termelésének növekedésével. Ezek az adatok mechanikus alapot nyújtanak az étrendi n-3 zsírsav-kiegészítés jótékony hatásainak a gyulladásos betegségek kezelésében. Az étrendi halolaj-kiegészítők kimutatták, hogy növelik a prosztaciklin (PGI 2) értermelését. 16 Bár a PGI 2 szerepe a gyulladásban nincs pontosan meghatározva, erős értágító és gátolja a vérlemezkék aggregációját, valamint lebontja a vérlemezkéket. Ezek a hatások valószínűleg hozzájárulnak az étrendi halak és halolajok trombotikus érrendszeri események elleni védőhatásaihoz. Fontos, hogy a főbb reumás betegségekben (pl. RA, szisztémás lupus erythematosus [SLE] és köszvény) szenvedő betegeknél nagy a kockázata a súlyos kardiovaszkuláris eseményeknek és a halálozásnak, amelyekhez nem szteroid gyulladáscsökkentők (NSAID) társított COX-2 a gátlás is hozzájárulhat.
A DC-knek központi szerepük van az immunrendszer aktiválásában és az önmagukra adott válaszban. Az 1,25 (OH) 2 D 3 gátolja a monocita prekurzorok érett DC-ként való differenciálódását, csökkenti az MHC II osztályú molekulák expresszióját DC-ken, gátolja az IL-12 termelését és elősegíti a DC apoptózist, ezáltal gátolja a DC-depenens T-sejtek aktiválódását. 17, 18 Ezenkívül az 1,25 (OH) 2D3 elősegítheti a toleráns funkciók DC expresszióját, amelyek a T szabályozó (Treg) sejteket utasítják, ami viszont gátolhatja az autoimmunitás kialakulását. A D-vitamin gátolja a monocita/makrofág proinflammatorikus citokin termelést, beleértve a TNF-et, az IL-6-ot és az IL-1α-t. 20 A D-vitamin közvetlen hatással van a T-sejtekre, különösen gátolja a proliferációt és a citokintermelést a Th1 sejtek által, és fokozhatja a Th2 citokintermelést. 21 1,25 (OH) 2 D3 szintén kimutatták, hogy csökkenti a Th17 sejtek differenciálódását a DC-kre gyakorolt hatása, valamint a Th17 sejtekre gyakorolt közvetlen hatások révén, amelyek csökkent IL-17A termeléshez vezetnek. 19, 22 1,25 (OH) 2 D 3 gátolja az aktivált B-sejtek szaporodását, aktivált B-sejtek apoptózisát indukálja, és gátolja a plazma sejtek differenciálódását és az immunglobulin szekrécióját. 23 A D-vitamin-hiánynak tehát szerepe lehet a B-sejtek által közvetített autoimmun rendellenességek etiológiájában, míg a D-vitamin-kiegészítés jótékony hatással lehet a B-sejtek által közvetített autoimmun betegségekre, például SLE-re és RA-ra.
DC, dendritikus sejt; ICAM, intercelluláris adhéziós molekula; IL, interleukin; LFA, leukocita funkcióval társult antigén; LTB, leukotrién B; PGE, prosztaglandin E; RANK/OPG, a κB/osteoprotegerin nukleáris faktor receptoraktivátora; Th, T segítő; TNF, tumor nekrózis faktor; TXA, tromboxán A; VCAM, vaszkuláris sejtadhéziós molekula.
A hosszú láncú n-3 zsírokat, az EPA-t és a DHA-t a halakban és a halolajokban van a legtöbb. A halbevitel RA elleni védőhatásáról számoltak be. Például a seattle-i női egészségügyi tanulmány kimutatta az RA kialakulásának kockázatát azoknál az alanyoknál, akik hetente két vagy több hallisztet fogyasztottak, 0,57-es (95% -os konfidenciaintervallum [CI], 0,35–0,93) korrigált esélyhányadossal (OR). heti egynél kevesebb halliszt fogyasztása. 27 Egy újabb populációalapú, esetekkel kontrollált tanulmány az RA kockázatának szerény csökkenéséről számolt be azoknál az egyéneknél, akik olajos halat fogyasztanak hetente egy-hét alkalommal azokhoz képest, akik ritkán vagy soha nem fogyasztottak halat (OR, 0,8; 95% CI, 0,6 és 1,0 között), amely még az RF és az anticiklusos citrullinált fehérje (CCP) antitest státusát sem tette lehetővé. 28.
A vörös hús magas fogyasztása a gyulladásos polyarthritis fokozott kockázatával jár (OR, 1,9; 95% CI, 0,9–4,0). Bár egy tanulmány arról számolt be, hogy a húshoz és a belsőségekhez az RA kialakulásának fokozott kockázata társult, 30 ezt más vizsgálatok nem erősítették meg. 31, 32 nem világos, hogy a vörös húsfogyasztás és a gyulladásos ízületi gyulladás összefüggése ok-e, bár a vörös húsban jelentős mennyiségű AA jelenléte magyarázatot adhat az összefüggésre.
A teát és a kávét az RA kialakulásának lehetséges kockázati tényezőjeként azonosították. A finn Nemzeti Egészségügyi Tanulmányban napi négy vagy több csésze kávé fogyasztása az RF-pozitív, de nem RF-negatív RA megnövekedett kockázatával járt együtt a potenciális zavarók, például életkor, dohányzás és nem (relatív kockázat [RR], 2,2; 95% CI 1,13–4,27). 33 Ezzel szemben az Iowa Women's Health Study nem számolt be összefüggésről a napi koffeinbevitel és az RA kockázata között. Azoknál a nőknél azonban, akik naponta négy vagy több csésze koffeinmentes kávét fogyasztottak, nagyobb volt az RA kockázata a nem kávét fogyasztókkal szemben (RR, 2,58; 95% CI, 1,63–4,06). Továbbá azoknál a nőknél, akik naponta három vagy több csésze teát fogyasztottak, csökkent az RA kockázata (RR, 0,39; 95% CI, 0,16–0,97). 34 Újabb tanulmányok nem mutattak összefüggést a tea/kávé és az RA között. 31, 35
Az alkoholfogyasztás csökkentheti az RA kialakulásának kockázatát. 515 RA-ban szenvedő beteg esettanulmányos vizsgálatában az alkoholfogyasztás az anti-CCP pozitív RA kockázatának csökkenésével járt. 37 Az alkoholfogyasztás és az RA kockázata közötti dózistól függő inverz összefüggést két független eset-kontroll vizsgálat (svéd EIRA és dán CACORA) is bizonyított. 38 Az RA kockázatának csökkenése kifejezettebb volt a megosztott epitóppal rendelkezõ betegeknél, összehasonlítva a közös epitóp nélküli betegekét, és a leginkább a dohányzóknál a közös epitóppal. 38
Az RA kockázatának feltételezett csökkentésére vonatkozó jelölt mechanizmusokról kimutatták, hogy az alkohol csökkenti a gyulladásgátló citokinek termelését, és szabályozza az IL-10 gyulladásgátló citokin termelését. 39, 40 Továbbá az egér ízületi gyulladásos modelljében az etanol szinte teljesen megakadályozta a kollagén által kiváltott ízületi gyulladás kialakulását, és azoknál az egereknél, amelyeknél ízületi gyulladás alakult ki, a betegség kevésbé volt súlyos. Az etanol ezen gyulladáscsökkentő hatásai a csökkent leukocita migrációval, az NFκB visszaszorításával és a gyulladásgátló IL-6 és TNF citokinek termelésének csökkenésével jártak együtt, de az IL-10 gyulladáscsökkentő citokin nem. 41
Az iowai női egészségügyi tanulmány arról számolt be, hogy a magasabb D-vitamin bevitel az RA csökkent kockázatával (RR, 0,67; 95% CI, 0,44–1,00, P = 0,05) jár együtt az 55–69 éves nőknél. 44 Ugyanakkor egy nemrégiben végzett, 22 éven át követett, 186 389 nő által végzett vizsgálatban nem volt összefüggés az étrendi D-vitamin bevitele és az RA kialakulásának kockázata között. 45 A kiegészítők kivételével azonban a D-vitamin fő forrása a bőrben történő de novo szintézis, és a becsült étrendi bevitel rossz előre jelezheti a szérum D-vitamin-koncentrációját. Egy 79 RA-ban szenvedő beteg vizsgálata során nem találtak összefüggést a korábbi szérum D-vitamin-koncentrációk és az RA későbbi kialakulása között. 46 Ugyanakkor figyelemre méltó, hogy ebben a vizsgálatban mindkét eset és kontroll geometriai átlaga csak a fele volt az alacsonyabb 60 nmol/l referenciaszintnek, amelyet később úgy állítottak be, hogy tükrözze azt a szintet, amely elnyomja a D-vitamin-elégtelenség miatti másodlagos hiperparatireoidizmust.
Az oxigén szabad gyökök (például nitrogén-oxid, szuperoxid, hidroxil gyök) szerepet játszanak az RA-ban megfigyelt szövetkárosodásban. Az antioxidánsoknak, köztük az E-vitaminnak (α-tokoferol), a C-vitaminnak (aszkorbinsav), a β-karotinnak és a szelénnek védő szerepük lehet az ezen oxigén szabad gyökök által okozott szövetkárosodásokkal szemben. Ez annak bizonyítékával együtt, hogy az antioxidáns táplálkozási státus markerei alacsonyabbak a megállapított RA-ban szenvedő betegeknél a normál kontrollokhoz képest 48, ahhoz a hipotézishez vezetett, hogy az antioxidánsok védekezhetnek az RA kialakulása ellen. E biológiai elfogadhatóság ellenére a rendelkezésre álló adatok nem nyújtanak egyértelmű bizonyítékot az antioxidánsok étrend-kiegészítőként kifejtett védőhatására az RA kialakulásával kapcsolatban.
A béta-kriptoxantin (a gyümölcsökben és zöldségekben található karotinoid) és a cink magasabb étrendi bevitele megvédheti az RA kialakulását. 52, 53 Az alacsony C-vitamin-bevitel a gyulladásos polyarthritis megnövekedett kockázatával is összefüggésben van a legalacsonyabb C-vitamin-bevitel (94,9 mg/nap) 3,3 (95% CI, 1,4-7,9) korrigált OR-val. 54 Egy másik tanulmány azonban nem talált összefüggést a C-vitamin, az E-vitamin, a cink vagy a szelén bevitele és az RA kialakulása között. 31
Két tanulmány arról számolt be, hogy az elhízás növeli az RA kockázatát, 56, 57, míg két másik tanulmány szerint nincs összefüggés. 58 - 60 Az adipokinek, a leptin, az adiponektin és a visfatin megnövekedett plazmakoncentrációit figyelték meg RA-ban az egészséges kontrollokhoz képest. Ezenkívül a visfatin és a leptin fokozott, illetve csökkent radiológiai ízületi károsodással járt. Ezek az adatok az elhízásban megfigyelt gyulladásos állapotokkal együtt azt sugallják, hogy a BMI befolyásolhatja a betegség aktivitását és kimenetelét RA-ban, míg paradox módon talán a megnövekedett BMI kevesebb radiográfiai károsodáshoz társult. 58, 62 Alternatív magyarázat az, hogy az aktívabb gyulladásos betegségben szenvedő betegeknél, akik hajlamosak több radiográfiai erózió kialakulására, alacsonyabb a BMI és a reumatoid cachexia.
- Táplálkozás és krónikus gyulladásos reumatikus betegség - ScienceDirect
- Táplálkozás hasnyálmirigy betegségekben - ScienceDirect
- Az osteoarthritis táplálkozási kockázati tényezői A reumatikus betegségek évkönyvei
- SP0063 TÁPLÁLKOZÁSI ÉS REUMAI BETEGSÉGEK A reumatikus betegségek évkönyvei
- A reumatikus betegségek diétákkal és kiegészítőkkel működnek Reumatikus betegségek központja - a mindennapi egészség