Thaiföldön és hasmenés nélkül társuló emberi enterovírusok Thaiföldön 2010 és 2016 között
Jira Chansaenroj
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Supansa Tuanthap
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Thanundorn Thanusuwannasak
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Ausanee Duang-in
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Sirapa Klinfueng
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Napha Thaneskongtong
2 Chum Phae kórház, Chum Phae, Khon Kaen, Thaiföld
Viboonsuk Vutithanachot
2 Chum Phae kórház, Chum Phae, Khon Kaen, Thaiföld
Sompong Vongpunsawad
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Yong Poovorawan
1 Klinikai Virológiai Kiválósági Központ, Orvostudományi Kar, Chulalongkorn Egyetem, Bangkok, Thaiföld
Társított adatok
Minden releváns adat megtalálható a dokumentumban és a kiegészítő információkat tartalmazó fájlokban.
Absztrakt
Bevezetés
Filogenetikai elemzés
A VP4-VP2 régió nukleotidszekvenciáit egymáshoz igazítottuk, és filogenetikai fa rekonstrukciónak vetettük alá őket a szomszédos csatlakozási módszer és a MEGA 5.0 szoftverben megvalósított maximális összetett valószínűségű modell alkalmazásával [34]. A hiányzó adatokhoz páronkénti törléseket alkalmaztunk, és a fa robusztusságát 1000 ál-replikátummal történő bootolással határoztuk meg. A 70% feletti bootstrap értékeket szignifikánsnak tekintették.
Statisztikai analízis
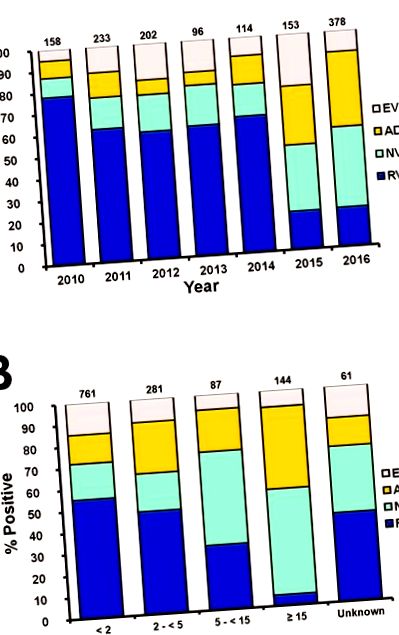
A statisztikai elemzést az IBM SPSS V21.0 csomag (SPSS Institute, Chicago, IL) segítségével végeztük. A khi-négyzetet használták az EV-fertőzés korcsoportok közötti különbségeinek mérésére. A p érték 1. táblázat). 2010 és 2016 között a minták pozitív eredményt mutattak RV (22,7%, 611/2692), NV (11,4%, 306/2692) és ADV (9,3%, 249/2692) szempontjából. Az RV volt a fő vírus, amelyet 2010 és 2014 között a hasmenéssel összefüggésben találtak (1A. Ábra). Az elterjedt RV genotípusok a G3P [8] (46,2%) és a G1P [8] (38,1%) voltak (2A. Ábra). Az RV-pozitív mintákat leggyakrabban kisgyermekeknél találták (1B ábra). Az azonosított NV genotípus többsége GII.4 (52,6%) volt (2B. Ábra). Ebben a vizsgálatban az NV és az ADV egyaránt fő enterális vírus volt, amelyet 2015 és 2016 között találtak. Az F41 genotípus tartalmazta a mintákban talált ADV nagy részét (30,5%), majd C2 (18,1%) és C1 (17,3%) következett (2C ábra ).
Az EV, ADV, NV és RV aránya azonosítva év (A) és korcsoport (B) szerint. A vírus-pozitív minták számát az oszlopdiagramok mutatják. A színek kékek a lakóautóhoz, zöldek az NV-hez, sárga az ADV-hez és a rózsaszínű, EV.
Az (A) RV VP7 és VP4 gének, (B) NV az RdRp/VP1 régió alapján és (C) ADV a hexon gén alapján.
Asztal 1
| Nem | ||
| Férfi | 1 465 (54,4) | 673 (51,4) |
| Női | 1 227 (45,6) | 507 (38,7) |
| N/I | 0 (0) | 130 (9,9) |
| Életkor (év) | ||
| 3. ábra). 5,4% (9/168) EV-A, 37,5% (63/168) EV-B, 23,8% (40/168) EV-C és 0,6% (1/168) EV-D volt (4A ábra). . Az EV-A CV-A4, CV-A5, CV-A8 és CV-A10 genotípusokat tartalmazott. Az EV-B fajok mutatták a legnagyobb változatosságot (18 genotípus), amelyek közül a legtöbb CV-A9 és echovírus E6 volt (mindegyiknél 8/63) (4B. Ábra). Az azonosított 9 EV-C típus közül 26 Sabin vakcinatörzs volt (8 1. típusú, 10 2. típusú és 8. 3. típusú) (S2 ábra). Egy 3 éves gyermek székletmintája pozitív eredményt adott a B2 osztály EV-D68 szempontjából (S3, S4 és S5 ábra). Végül rhinovírust mutattak ki a minták 32,7% -ában (55/168) (24 A faj, 9 B faj és 22 C faj), amelyek közül 27 nem volt együttfertőzve semmilyen RV, NV vagy ADV. |
A filogenetikai fát a MEGA-ban (5. verzió) megvalósított szomszédos csatlakozási módszerrel állítottuk össze. A csomópontokon a rendszerindító elem újramintavételi értékei> 70> vannak feltüntetve. A skála mutatja a helyenkénti helyettesítések számát. Fekete pontok jelzik a több vírust tartalmazó mintákból nyert EV-t. Kék, EV-A; piros, EV-B; zöld, EV-C; lila, EV-D; sárga, rhinovírus.
(A) Az AGE-betegek székletmintáiban található EV-A-D és rhinovírus kördiagramja. (B) Az EV genotípusai és azok százalékos aránya (a sávdiagramok felett számokkal jelölve). Kék, EV-A; piros, EV-B; zöld, EV-C; lila, EV-D; sárga, rhinovírus.
Ezzel szemben a HFMD mintákban azonosított EV elemzése azt mutatta, hogy elsöprő többség (92,6%, 757/817) az A fajhoz tartozik (5A. Ábra). Nyolc EV-A volt azonosítva: CV-A2, CV-A4, CV-A5, CV-A6, CV-A8, CV-A10, CV-A16 és EV71, amelyek közül a legelterjedtebb a CV-A6 (54,8%, 448/817) (5B. Ábra). Érdekes módon a CV-A5, a CV-A9, az E18 echovírus és a rhinovírus A vírusok egy része volt az AGE és a HFMD kohorszok többszörös mintáiban.
(A) A HFMD betegek székletmintáiban található EV-A-C és rhinovírus kördiagramja. (B) Az EV genotípusai és azok százalékos aránya (a sávdiagramok felett számokkal jelölve). Kék, EV-A; piros, EV-B; zöld, EV-C; sárga, rhinovírus.
Vita
A vírusos gasztroenteritis jelentős problémát jelent, különösen az alulforrásokkal rendelkező és a fejlődő régiók gyermekei körében. Az életminőség befolyásolása mellett az AGE jelentős orvosi és társadalmi-gazdasági terhet ró. Az RV, NV és ADV által okozott fertőzések továbbra is jelentősen alul diagnosztizáltak, és felelősek a hasmenés jelentős előfordulásáért, amint ezt a tanulmány és mások megmutatták [7, 28–30, 35–38]. Számos EV-t azonban egyre inkább felismernek a tartós hasmenés egy részével, és gyakran vizsgálják, amikor a széklet negatív a gyakran érintett enterális vírusok esetében [14, 19, 35, 39].
Ebben a tanulmányban számos korlátozás volt. Bár ideális lett volna összehasonlítani az AGE mintákban talált EV-t az életkornak megfelelő egészséges kontrollok székletmintáival, amelyek nem mutattak AGE tüneteket, egy előzetes vizsgálat, amelyet 200, legfeljebb 5 éves gyermekek egészséges székletmintáján végeztünk, nem mutatott kimutatható EV (S1 ábra). Nem tudtuk kizárni annak lehetőségét, hogy egyes AGE-epizódokat baktériumok vagy más kevésbé gyakori enterális vírusok okoztak, mint például asztrovírus, szapovírus és bocavírus. Noha a vírusos nukleinsavat közvetlenül a klinikai mintákból amplifikáltuk, nem végeztünk megerősítést a vírusok sejttenyészet alkalmazásával történő izolálásával, ahogy ezt néhány tanulmány elvégezte. Ugyanakkor azonosítani tudtunk egy vagy több vírust a székletmintákban, és mindegyiket nukleotidszekvenciával igazoltuk. Az egészséges és az AGE-epizódok során a széklet prospektív szekvenciális mintavételével kapcsolatos jövőbeni tanulmányok a születéstől a felnőttkorig jobban tisztázhatják az EV terhelését hasmenéses betegségben. Összefoglalva, a tanulmány adatai összefüggést sugallnak több EV genotípus és Thaiföldön az AGE esetek aránya között, ami aláhúzza az EV által biztosított klinikai megnyilvánulások sokféleségét.
Segítő információ
S1 ábra
Az EV és más vírusos kórokozók (RV, NV és ADV) jelenlétét AGE-vel rendelkező és anélküli egyedek székletmintáiban vizsgálták. Az AGE mintákban azonosított EV fajokat ezt követően összehasonlítottuk az azonos időszakban gyűjtött HFMD mintákban azonosítottakkal.
- A hiszton-dezacetiláz 6 kölcsönhatásba lép a mikrotubulusokhoz társított tau fehérjével - Ding - 2008 - Journal
- 2016. július Let; s Beszélgetés
- Karnivore Kurt - A húsevő étrend Az ősök visszaállítása az optimális emberi egészségre
- A chia mag hosszú távú étrendi bevitele a megnövekedett csont ásványianyag-tartalommal és
- Az ultrafeldolgozott élelmiszerek növekvő fogyasztása és az emberi egészségre vonatkozó bizonyítékok várható hatása