In vitro új Schiff-alapú ligandum-lantanid-komplexek citotoxicitási aktivitása
Tárgyak
Absztrakt
Schiff-alapú ligandumot (SBL), N2, N3-bisz (antracen-9-il-metilén) -piridin-2,3-diamint szintetizáltunk 2,6-diaminopiridin és antracén-9-karbaldehid kondenzációján keresztül 1: 2 arány. Az 1H-NMR-spektrumok megerősítették az SBL-ben nem érintett aromás karbonsav-proton megfigyelését. A lanthanid (azaz praseodymium (Pr), erbium (Er) és ytterbium (Yb)) alapú SBL fémkomplexumok új sorozatát sikeresen szintetizálták, és funkcionális csoportjaikat részletesen bemutatták UV-látható, Fourier-transzformációs infravörös (FT) alkalmazásával. -IR), és fluoreszcencia spektroszkópia elemzéseket. Az FT-IR spektrális vizsgálatok azt mutatták, hogy az SBL kétirányú ligandumként viselkedett, és a két azometin-nitrogén fémionokkal strukturálódott. A szintetizált SBL-alapú fémkomplexumokat részletesen elvégeztük a citotoxicitás aktivitása szempontjából a Vero, az emberi emlőrák (MCF7) és a nyaki (HeLa) rákellenes sejtvonalakhoz képest.
Bevezetés
A ciszplatin, mint orvosilag elismert daganatellenes gyógyszer innovatív sikere után a gyógyszerkémikusok interdiszciplináris kutatásba kezdtek a DNS/RNS-szel, biomolekulákkal és fehérjékkel, mint tumorellenes gyógyszerekkel való kölcsönhatásra szolgáló fémkomplexek 1,2-vel. Másrészt a platina (Pt) fémalapú ciszplatin gyógyszer alkalmazása gyógyászati célokra számos mellékhatást okoz, és ez továbbra is kihívást jelent a hatékony rákellenes gyógyszerek 3,4,5 előállításához. A gyógyászati szervetlen kémia széles körű lehetőséget kínál új gyógyszerek tervezésére, amelyek a rák elleni küzdelemben a fémkomplexek koordinációján és redox tulajdonságain alapulnak. Jelenleg a különböző fémkomplexeket, beleértve a réz, lantán és ruténium komplexeket, a klasszikus ciszplatin típusú gyógyszerek leginkább képes helyettesítőinek tekinteni. 7,8,9,10,11,12,13,14,15,16,17 .
Jelen vizsgálat során egy kétágú SBL-t és újszerű lantanid-fém (III) komplexeit (praseodymium, erbium és ytterbium) egyszerű, egycserépes kémiai szintézissel sikeresen szintetizáltak, és hihetően analitikai módszerekkel jellemezték, beleértve az UV-látható (UV-vis), Fourier transzformációs infravörös (FT-IR) és fluoreszcencia spektroszkópia. Ezenkívül citotoxicitásuk a Vero, HeLa és MCF7 rákos sejtvonalakra is in vitro részletesen bemutatták.
Eredmények és vita
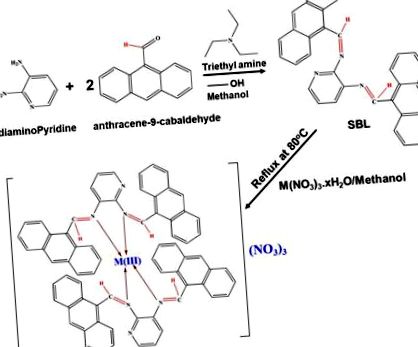
SBL, N2, N3-bisz (antracen-9-il-metilén) -piridin-2,3-diamint szintetizáltunk 2,6-diaminopiridin és antracén-9-karbaldehid kondenzációján keresztül 1: 2 arányban. Az SBL-szintézis sematikus ábrázolását az 1. ábra mutatja. Az S1 (a) ábra az SBL-komplex 1H-NMR-spektrumát mutatja, amely 12,23 ppm-nél specifikus jelet mutat az NH protonok hatására, és a jelet a 8,0–2 8,7 ppm az azometin protonoknak tulajdonítható. A 6,63–8,29 ppm régióban jel is megfigyelhető a 40,41 aromás protonok miatt. 13 C-os NMR-spektrumból (S1b ábra) az SBL specifikus jelet mutat 165,37 ppm-nél az azometin-szén 42,43 miatt. Ezenkívül 126–132 ppm tartományban jelet mutat, amely megfelel a 44,45 aromás szénatomoknak. A megfigyelt NMR eredmények megerősítették az SBL komplex sikeres kialakulását. Ezenkívül a lanthanid (azaz praseodymium (Pr), erbium (Er) és ytterbium (Yb)) alapú SBL fémkomplexumok új sorozatát egyszerű, egykannás kémiai szintézissel sikeresen szintetizálták. Az SBL alapú fémkomplexek előállításához használt részletes kísérleti eljárásokat a kísérleti részben dolgozzuk fel. A Schiff-alap ligand – Pr (SBLPr), a Schiff-alap ligand – Er (SBLEr) és a Schiff-alap ligand – Yb (SBLYb) fémkomplexumok előkészítési sémáját az 1. ábra mutatja.
Az SBL és annak fémkomplexumának sematikus módszertana.
Az SBL és fémkomplexumainak funkcionális tulajdonságainak elemzése
Az SBL és fémkomplexumainak UV-vis spektrumai 250–800 nm tartományban.
Az SBL és fémkomplexumainak FT-IR spektrumai. (a) Azometin-csoport (ν-HC = N) régió, (b) -M-N-régió ésc) Piridin-gyűrű N-régiója.
Az SBL fémkomplexumok fluoreszcencia spektrumai (Inset: az SBL fluoreszcencia spektruma). Az SBLEr és SBLPr fémkomplexek dekonvolúciós spektrumai kombinált széles spektrális csúcsuknak köszönhetők.
(a) TG és (b) Az SBL és fémkomplexumainak DTA-görbéi.
SEM mikrográfiák (a) SBL és (b) SBLPr, (c) SBLEr és (d) SBLYb komplexek.
Citotoxicitás Vero, MCF7 és HeLa rákos sejtvonalakkal szemben, SBLPr és SBLEr fémkomplexekkel
Az SBL-alapú fémkomplexumok (SBLPr és SBLEr) hasznosak lehetnek rákellenes gyógyszerekként, stabilitásuk, citokompatibilitása és a biomolekulákkal való rugalmas kötődése miatt 64. A közelmúltban a gyógyszeradagoló rendszerek fejlesztésével széles körben megkísérelték előállítani a várt gyógyító hatást olyan betegeknél, akiknek alacsony az ellentétes reakciója 65. Ebben a munkában az SBLPr és az SBLEr antiproliferatív hatásait három különböző rákos sejtvonalban (azaz Vero, HeLa és MCF7 sejtekben) vizsgáltuk és MTT assay-vel értékeltük.
A szintetizált SBLPr és SBLEr különböző koncentrációkban (azaz 5, 10, 25, 50, 75 és 100 μg/ml komplexekben) a Vero, MCF7 és HeLa sejtek életképességére gyakorolt hatását 24 órán belül megfigyeltük. A megfigyelt eredmények a sejtek életképességét 85–90% -on fejtették ki 5 μg/ml-ig terjedő koncentrációk esetén, amint azt a 7. (a, b) ábra mutatja. Amint a 7. ábrán látható, az SBLPr és az SBLEr hatékonyan indukálta az apoptózist Vero, MCF7 és HeLa sejtekben dózisfüggő módon. Az SBLPr-tesztelt Vero sejtek jó biokompatibilitást mutattak az SBLEr komplexhez képest, amint azt a 7. ábra mutatja. A sejtek életképességének tényleges csökkenését kezelt koncentrációkban figyeltük meg a kontroll sejtekhez képest. Egy korábbi jelentésből kiderült, hogy a Vero sejtvonalak magasabb fémkomplex koncentrációban jelentős sejthalált tettek ki, 66,67. Ezenkívül az arany nanorészecskék (AuNP) biokompatibilitási jellemzőit végül a Vero, HeLa, MCF7 és HeP-G2cell vonalakkal hajtották végre 68. A 24 órán át kezelt Vero sejtek az SBLPr és az SBLEr megfelelő IC50 koncentrációjával lekerekedtek, zsugorodni kezdtek, és elveszítették kölcsönhatásukat a közeli sejtekkel. A 8. (a – c) ábrán látható morfológiai képek megerősítették az SBLPr és az SBLEr (@ 25 μg/ml) minták toxikus hatását a Vero sejtekkel szemben a kontroll sejtekkel.
A rákos sejtvonalak (azaz MCF7, HeLa és Vero) sejtéletképessége a a) SBLPr és b) SBLEr fémkomplexumok.
Az SBLPr és SBLEr fémkomplexek által kiváltott morfológiai változások 25 μg/ml felhasználással a kontroll rákos sejtvonalakhoz képest.
42–51%. Az SBLPr-rel és az SBLEr-vel kezelt sejtek sejtek zsugorodásán mentek keresztül, amit a 8. ábra is bizonyít. Sőt, szintetizált fémkomplexeink jobb gátló tulajdonságokat mutattak az MCF7 rákos sejtvonalakkal szemben. Ezenkívül megmutatták, hogy az apoptotikus testek sejthalálhoz vezetnek, amit olyan variációk bizonyítanak, mint a sejtnövekedés korlátozása, a citoplazmatikus kondenzáció és a membrán integritásának elvesztése 70 .
A DNS-fragmentáció és az apoptózis elemzése MCF7 és HeLa rákos sejtvonalakkal szemben SBLPr és SBLEr fémkomplexekkel
A DNS-fragmentáltságot széles körben feltételezzük a 68,71 apoptózis megkülönböztető képességének. Az apoptózis megindulása a sejtek méretének szabálytalan hiányával, amelyben a sejtek kondenzálódnak, és a DNS-fragmentáció 72-vel hozható létre. Az apoptózis elsődleges része az oligonukleoszomális alakú törmelék megfigyelése a kromoszómális DNS hasításából. Kifinomult biokémiai munka felismerte az apoptotikus endonukleázokat vezető DNS fragmentációs faktorát a DNS elpusztításában in vitro. Számos jelentés áll rendelkezésre a fémkomplexek képességéről a DNS 70 hasításának katalizálására. Ezért megvizsgáltuk a DNS-hasító aktivitásokat elektroforézis vizsgálattal SBLPr és SBLEr komplex által vizsgált MCF7 és HeLa sejtek felhasználásával. Jelen tanulmányban a HeLa és MCF7 IC50 sejteket 24 órán át SBLPr-rel és SBLEr-rel kezeltük, ami a DNS-fragmentáció beépítésével a sejtek túlélésének csökkenését mutatta. A 9. ábra (a, b) az apoptózis indukcióját mutatja a köztes kenetekben. A teljes hosszúságú elektroforézis képeket az S2 kiegészítő ábra mutatja be. Összehasonlításképpen kezeletlen kontrollkamrákat biztosítunk a DNS-fragmentáció hiányának megfigyeléséhez.
(a) 24 órán át SBLPr komplexszel kezelt MCF7 és HeLa IC50 sejtek DNS-fragmentációja. 1. sáv: 1 kb DNS létra, 2. sáv: MCF7 kontroll DNS, 3. sáv: SBLPr-kezelt MCF7 sejt (25 μg/ml), 4. sáv: SBLPr-kezelt HeLa sejt (25 μg/ml), 5. sáv: HeLa kontroll DNS. (b) 24 órán át SBLEr komplexszel kezelt MCF7 és HeLa IC50 sejtek DNS-fragmentációja. 1. sáv: 1 kb DNS létra, 2. sáv: MCF7 kontroll DNS, 3. sáv: SBLEr-kezelt MCF7 sejt (25 μg/ml), 4. sáv: HeLa kontroll DNS, 5. sáv: SBLEr-vel kezelt HeLa sejt (25 μg/ml ).
Az AO/EB kettős festésű MCF7 és HeLa sejtek, valamint SBLPr- és SBLEr-vel kezelt sejtjeinek morfológiai variációi 25 μg/ml alkalmazásával 24 órán át.
- Vas-ftalocianin-szenzibilizált mágneses katalizátorok a BPA fotodegradációjához Scientific Reports
- Az étkezés nagysága a súlygyarapodás kritikus mozgatórugója a kisgyermekkori tudományos jelentésekben
- IJMS Free Full-Text Chemerin izoformák és aktivitás az elhízásban HTML
- A horrorfilmek szakszerűen manipulálják az agytevékenységet az izgalom fokozása érdekében - ScienceDaily
- In vitro és in vivo bizonyíték a kékből nyert halfehérje-hidrolizátum kielégítő hatására