A vörös répa (Beta vulgaris L.) levélpótlás javítja az antioxidáns státuszt a magas zsírtartalmú, magas koleszterinszintű étrendben lévő C57BL/6J egerekben
Jeung Hee Lee
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Chan Wook Son
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Mi Yeon Kim
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Min Hee Kim
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Hye Ran Kim
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Eun Shil Kwak
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Sena Kim
2 Egészségügyi és funkcionális élelmiszerek osztálya, Koreai Élelmiszerkutatási Osztály a globalizációért, Nemzeti Agrártudományi Akadémia, Vidékfejlesztési Igazgatóság, Suwon, Kyunggi 441-853, Korea.
Mee Ree Kim
1 Élelmiszer- és táplálkozási tanszék, Chungnam Nemzeti Egyetem, Gung-dong, Yuseong-gu, Daejeon 305-764, Korea.
Absztrakt
Bevezetés
A reaktív oxigénfajok (ROS) rendkívül reaktív molekulák, mivel párosulatlan vegyértékű héj-elektronjaik vannak, és reagálnak a biológiai molekulák minden osztályával, ami oxidatív stresszt eredményez (Aviram, 2000; Parthasarathy et al., 1999; Stehbens, 1999). Az emberi és állati testekben a ROS antioxidáns védelmi rendszerekkel semlegesíthető, beleértve az antioxidáns enzimeket (Fang et al., 2002) és antioxidáns vegyületeket (Catapano et al., 2000; Duthie & Bellizzi, 1999). A túlzott ROS-termelés és a kimerült antioxidáns védekezés azonban oxidatív stresszhez vezet és oxidatív károsodást okoz, kóros diszfunkciókat okozva a szervezetben (Urso & Clarkson, 2003). Továbbá az oxidatív stressz szerepet játszik a krónikus betegségek, például a neurodegeneratív betegség és a szívkoszorúér-betegség (CHD) patogenezisében (Nishimura és mtsai., 2000; Urso és Clarkson, 2003). A kohorszvizsgálatok bizonyítékai alátámasztották azt a nézetet, hogy a gyümölcsök és zöldségek elegendő bevitele fordítottan összefügg a krónikus betegségek kockázatával (Dauchet et al., 2006; Dyun & Pivonka, 2000), és számos lehetséges mechanizmust javasoltak antioxidánsokkal. tápanyagok az oxidatív stressz csökkentésével (Ames et al., 1995). Ezért nagy figyelmet fordítottak a gyümölcsökben és zöldségekben található természetes antioxidánsokra (Ames et al., 1995).
A vörös répa (Beta vulgaris L.) levél jó természetes antioxidáns forrás, például betalainok, flavonoidok, polifenolok, vitaminok és folsav. A vörös répa összes fenoltartalma a vizsgált 23 zöldség között a legmagasabb (Vinson és mtsai, 1998). A betalainok tartalmazzák a betacianinokat (vörös-ibolya pigmenteket) és a betazantinokat (sárga pigmenteket). A vörös répalevélben a ROS a betacyanin szintézisét indukálta, amely ROS-megkötőként működhet, korlátozva a bakteriális fertőzés és sebesülés okozta károkat (Sepúlveda-Jiménez et al., 2004). A betanin, a fő betacianin, erős antioxidáns hatást mutatott a membránok lipidperoxidációjában és az LDL oxidáció gátlásában, amelyben az oxidációs sebesség jobb volt, mint a katechiné (Kanner et al., 2001).
A vörös répa jótékony hatását felmérő legtöbb tanulmány a gyökérre korlátozódott. A vörös répalevelet salátában fogyasztják más zöldségekkel világszerte. Koreában a leveles zöldségeket, beleértve a vörös répaleveleket is, általában főtt rizs vagy hús csomagolására szolgálják, és egy ilyen étrend népszerű a húst tartalmazó menüben. A 8% -os leveles növényi por hozzáadása atherogén étrendben a lipidperoxidáció megelőzését és az antioxidáns védekező rendszer növekedését mutatta az egerek plazmájában és májában (Lee és mtsai, 2009). A vörös répalevél biokémiai hatásáról azonban keveset tudunk. Ezért a jelen tanulmányban a C57BL/6J egereket magas zsírtartalmú, magas koleszterinszintű étrenddel táplálták piros répalevéllel (fagyasztva szárított, a diéta 8% -a) 4 héten keresztül, és oxidatív károsodások elleni védőhatását antioxidáns biomarkerek értékelték vér- és májszövet.
Anyagok és metódusok
Anyagok
A vörös répalevelet (Beta vulgaris L.) egy biogazdaságból (Gongju, Korea) nyerték és fagyasztva szárították. A fagyasztva szárított vörös répalevelekben az összes fenolos vegyület és a β-karotin tartalmát Teow és munkatársai által leírt módszerekkel határoztuk meg. (2007). A betanin- és a-tokoferol-tartalmat Sepúlveda-Jiménez és mtsai által leírt módszerekkel elemeztük. (2004) és Lee és mtsai. (2006), ill. A Sigma cégtől megvásárolták a glutation-reduktázt (III. Típusú pékélesztő), redukált glutationt, oxidált glutationt, tetrametoxipropánt, 5,5'-ditio-2-nitrobenzoesavat (DTNB), NADP, NADPH, tiobarbitursavat (TBA) és szarvasmarha szérum albumint -Aldrich Chemical Co. (St. Louis, MO). Az összes alkalmazott reagens analitikai minőségű volt.
Állatkísérletek
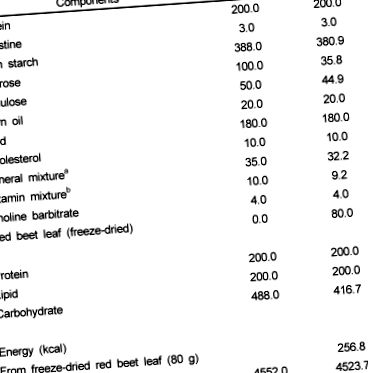
25-30 g tömegű hím C57BL/6J egereket (6-8 hetes korban, Damul Science Co. Deajeon) kontrollált hőmérsékletű (23 ± 3 ℃) és páratartalmú (55 ° C) polikarbonát ketrecekben (füldugó módszerrel azonosítva) tartottunk. ± 10%) 12 órás fény alatt: sötét ciklus. Az egereket az első héten pelletált kereskedelmi táplálékkal etették (Samyang Co., Szöul, Korea). Az akklimatizálás után az egereket véletlenszerűen két, egyenként 8 egérből álló kezelési csoportba osztottuk, és 4 héten keresztül szabad hozzáférést biztosítottak a vízhez és a hozzá rendelt étrendekhez. A kontroll étrend magas zsírtartalmat (20% zsír és 1% koleszterin) és AIN 93 ásványi és vitamin keverékeket tartalmazott (1. táblázat). A kísérleti étrendet (RBL) 8% fagyasztva szárított vörös répalevéllel egészítettük ki, és a keményítő, szacharóz, cellulóz, ásványi anyag keverék és vitamin keverék étrendi összetételét a kontroll étrenddel isoenergetikussá alakítottuk (1. táblázat). A jelen vizsgálatban alkalmazott vörös répalevél (szárazanyagban) kémiai összetételét az 1. táblázatban mutatjuk be .
Asztal 1
A kísérleti étrendek összetétele
AIN 93 ásványi keverék (g/kg): Kalcium-karbonát 357,00, kálium-foszfát (egybázisú) 196,00, kálium-citrát H2O 70,78, nátrium-klorid 74,00, kálium-szulfát 46,60, magnézium-oxid 24,00, vas-citrát, U.S.P. 6,06, cink-karbonát 1,65, Mangán-karbonát 0,63, rézszulfát-karbonát 0,30, kálium-jodát 0,01, nátrium-szelenát 0,01025, Ammónium Paramolybdate 4H2O 0,00795, nátrium-metaszilikát 9H2O 1,45, króm kálium-szulfát 12H2O 0,275, lítium-klorid 0,0174, bórsav 0,0815, Nátrium-fluorid 0,0635, Nikkel-karbonát 0,0318, ammónium-vanadát 0,0066, szacharóz finom porban 221,026
b AIN 93 vitamin-keverék (g/kg): niacin 3,00, kalcium-pantotenát 1,60, piridoxin-HCl 0,70, tiamin-HCl 0,60, riboflavin 0,60, folsav 0,20, biotin 0,02, E-vitamin-acetát (500 NE/g) 15,00, B12-vitamin ( 0,1%) 2,50, A-vitamin-palmitát (500 000 NE/g) 0,80, D3-vitamin (400 000 NE/g) 0,25, K1-vitamin/Dextrose keverék (10 mg/g) 7,50, Szacharóz 967,23
c Vörös répalevelek összetétele (száraz tömegben): energia 321 kcal/100 g, rost 34,3%, β-karotin 69,27 mg/100 g, α-tokoferol 5,17 mg/100 g, összes fenol 1,292 mg/100 g, betanin 106,4 mg/100 g
Az egerek testtömegét és a táplálékfelvételt naponta mértük, és a takarmány-hatékonysági arányt (FER) kiszámítottuk a kísérlet során. Az ürüléket 3 napig gyűjtöttük az áldozatkészítés előtt. Az állatkísérleteket az Országos Egészségügyi Intézet Iránymutatásainak (Laboratóriumi állatok gondozásának és felhasználásának útmutatója) betartásával végezték (NIH, 1996). 4 hét elteltével az egereket 12 órán át éheztettük, majd érzéstelenítettük az abszorpciós periódus alatt 08: 00-10: 00 között. A kiválasztott szerveket (azaz a szívet, a vesét, az agyat és a májat) gyorsan eltávolítottuk és sóoldatban puffereltük, lemértük, és azonnal folyékony nitrogénben tároljuk a lipidperoxidáció és az antioxidáns marker vizsgálatok céljából. A zsírpárnákat (R, retroperitoneális; M, mesentericus; E, epididymal; I, inguinalis; S, lépi) szintén összegyűjtöttük és lemértük. Vért vettünk a vena cava-ból heparin csövekbe, és centrifugáltuk 2500 fordulat/perc sebességgel és 4 ° C-on, majd a plazmát folyékony nitrogénben tároltuk a további vizsgálatokhoz.
Plazma és széklet lipid profilok
A plazma teljes koleszterin, HDL-koleszterin és triglicerid koncentrációját Hitachi 7020 automatikus vérelemzővel határoztuk meg. A széklet lipideket Folch és munkatársai által leírt módszerekkel extraháltuk. (1957), és koleszterin-koncentrációjukat a Yeongdong Pharmaceutical Co.-tól (Szöul, Korea) vásárolt készlet segítségével határozták meg. Az optikai sűrűséget spektrofotométerrel mértük (Pharmacia Biotech, Cambridge, Anglia).
A lipidperoxidáció meghatározása 2-tiobarbitursav-reaktív anyagokkal (TBARS)
A májat, a szívet és a vesét jégre helyeztük, és szöveti homogenizátor alkalmazásával 50 mM nátrium-foszfát-pufferrel homogenizáltuk. Minden 1 ml szövethomogenátumot és plazmamintát összekevertünk 8,1% nátrium-dodecil-szulfáttal (SDS, 1 ml), 20% ecetsavval (2 ml) és 0,75% TBA-val (1 ml). Az elegyet 30 percig forraljuk, és 10 percig 14 000 fordulat/perc sebességgel centrifugáljuk. A képződött malondialdehid (MDA) -TBA addukt abszorbanciáját kolorimetriásan mértük 533 nm-en spektrofotométerrel (Bidlack & Tappel, 1973). Standard görbét készítettünk tetrametoxi-propánnal és TBA-val, majd kiszámítottuk az MDA értékeket és TBARS értékként fejeztük ki.
A teljes glutationszint meghatározása
A teljes glutation (GSH) tartalmat enzimatikusan határoztuk meg Floreani és mtsai. (1997), enyhe módosítással. A májszövetet (0,2 g) lehűtött kerámia ütőmotorban 6% metafoszforsavval porítottuk fel, és az elegyet 4 ° C-on centrifugáltuk (25 000 fordulat/perc és 20 perc). A felülúszót (50 µl) összekevertük 100 mM foszfátpufferrel (pH 7,4, 39 µL), amely 5 mM etilén-diamin-tetraecetsavat (EDTA), 10 mM 5,5'-ditiobisz (2-nitro-benzoesavat) (DTNB, 25 µL) tartalmazott. és 5 mM NADPH (80 ul). 3 percen át 25 ° C-on történő egyensúlyozás után a reakciót glutation-reduktáz (két egység) hozzáadásával indítottuk el. A DTNB képződését folyamatosan rögzítettük ultraibolya/látható (UV/VIS) spektrofotométerrel 412 nm-en. A máj teljes GSH-tartalmát egy standard görbéből számítottuk, amelyet a GSH ismert mennyiségének és az abszorbancia változásának sebességével 412 nm-en ábrázoltuk.
Az antioxidáns enzimaktivitások meghatározása a májban és a plazmában
A májszöveteket 20 mM foszfátpufferben homogenizáltuk, amely 0,1 M KCl-ot, 1 mM EDTA-t és 0,5% Triton X-100-at (pH 7,4) tartalmazott. A homogenátumokat 30 percig centrifugáltuk 25 000 fordulat/perc sebességgel és 4 ° C-on, és a felülúszót használtuk a következő enzimvizsgálatokhoz. A glutation-S-transzferáz (GST) aktivitását a korábban leírtak szerint határoztuk meg (Habig és mtsai., 1974), 1-klór-2,4-dinitrobenzol (CDNB, szubsztrát) alkalmazásával 0,1 mM GSH jelenlétében. A dinitrofenil-tioéter képződését GST-vel 37 ° C-on 3 percen keresztül UV/VIS spektrofotométerrel vizsgáltuk abszorbanciában 340 nm-en. A GST aktivitást a négyszeres elemzés átlag ± szórásaként fejeztük ki. A glutation-reduktáz (GR) aktivitásának meghatározásához a felülúszót 1 M glutation-diszulfiddal (GSSG) és 5 mM NADPH-val kevertük 0,1 M foszfát/0,5 mM EDTA pufferben (pH 7,0), és figyeltük a NADP + képződését. UV/VIS spektrofotométerrel 340 nm-en (Floreani et al., 1997; Pinto et al., 1984).
A glutation-peroxidáz (GPx) aktivitását úgy határoztuk meg, hogy a felülúszót 1 mM EDTA-val, 100 mM GSH-val, 5 mM NADPH-val és egy egység glutation-reduktázzal összekevertük 0,1 M foszfátpufferben (pH 7,0). 3 percig tartó inkubálás után 10 mM kumén-hidroperoxidot adunk hozzá, és a NADPH NADP + -vá történő oxidációját spektrofotometriásan monitorozzuk 340 nm-en, ahol a GPx egy egysége 1 µmol NADP + képződését eredményezi percenként (Tappel és mtsai, 1978). . A szuperoxid-diszmutáz (SOD) vizsgálatához a felülúszót 1 mM xantinnal, 0,2 mM citokrómmal és 0,05 M kálium-cianiddal kevertük 0,05 M kálium-foszfát/0,1 mM EDTA pufferben. A reakcióelegyhez xantin-oxidázt adunk, és a SOD aktivitást spektrofotometriásan (550 nm) határozzuk meg, mint a citokróm szuperoxid gyök redukciójának gátlási sebességét (McCord és Fridovich, 1969). A GR, GPx és SOD aktivitását nemzetközi egység/mg májszövetben fejeztük ki. A plazma paraoxonáz (PON) vizsgálatához az egerek plazmáját (5 ul) 20 mmol Tris/HCl és 1 mM CaCl2 tartalmú pufferbe helyeztük. 0,2 M fenil-acetát hozzáadása után a PON aktivitását a fenol képződésének sebességével határoztuk meg, a növekedés 270 nm-nél történő figyelemmel kísérésével. A PON-aktivitás egy egysége 1 µM fenol/perc (Gan et al., 1991).
A plazma β-karotintartalmának meghatározása
Az egerek plazmáját (100 ui) összekevertük 500 ul etanollal és butilezett hidroxi-toluollal (BHT) metanolban (91 mmol, 25 ul) egy kémcsőben. 3 ml hexánt adunk a reakcióelegyhez, és 30 másodpercig vortexeljük. A β-karotint tartalmazó szerves fázist desztillált vízzel elválasztottuk és 1500 fordulat/perc sebességgel 2 percig centrifugáltuk. A felső fázist összegyűjtjük, és a hexánt nitrogénáramban bepároljuk. A maradékot izopropanol/acetonitrilben (50:50, v/v) oldjuk, és 450 nm-en beállított UV-detektorral ellátott nagy teljesítményű folyadékkromatográfiába (HPLC) injektáljuk. A szétválasztáshoz Nova-Pak C18 oszlopot (4 um, 150 × 3,9 mm belső átmérőjű, Waters, Milford, MA) használtunk. Az eluálást acetonitril/izopropanol/metanol (68:20:12, v/v/v) izokratikus mozgófázissal végeztük 0,02% ammónium-acetáttal, és az áramlási sebességet 1,0 ml/perc-re állítottuk be. A β-karotin mennyiségét kalibrációs görbével határoztuk meg. Belső standardként β-apo-8'-karotenalt alkalmaztunk, és három ismétlést végeztünk.
A hepatocita és a limfocita DNS károsodásának meghatározása
A májszövetet 600 rpm-en homogenizáltuk 50 mM Hank kiegyensúlyozott sóoldatával, 1 mM EDTA-val (pH 7,4). A sejteket kétszer mostuk a gélelektroforézis előtt. A limfociták és a hepatociták endogén DNS károsodását alkalikus egysejtű gélelektroforézissel (Comet assay) elemeztük, enyhe módosítással (Singh et al., 1988).
- Természetesen édes citromos gyömbéres répalé recept
- Tesztoszteron Undecanoate Környező béta-amiloid, kulcs Alzheimer-kór; s Andriol tablettákat vásároljon -
- Sült répa zöldek fokhagymával és olívaolajjal - NYT főzés
- Vöröskáposzta és répa saláta recept - Spry Living
- Recept édesburgonya fehérje palacsintához - Egészséges répa