A békákon található bőrmikrobák megakadályozzák a halálos bőrgomba okozta morbiditást és mortalitást
Absztrakt
Bevezetés
A fertőző betegségek egyre nagyobb arányban jelennek meg (Daszak et al., 2000). E betegségek egy része közvetlen fenyegetést jelent az emberekre, például a HIV, míg a vadon élő állatok betegségei veszélyeztetik a globális biológiai sokféleséget, és ezért közvetett módon befolyásolják az emberi jólétet. Az egyik oka annak, hogy a fertőző betegségek gyorsabban jelentkeznek, az, hogy az ökológiai kapcsolatokat megváltoztatták a betegség átterjedését elősegítő módon (Daszak et al., 2000; Keesing et al., 2006). Például a kórokozók és a gazdaszervezetek földrajzi eloszlásában bekövetkező változások betegségkitörésekhez vezethetnek, amint az a nyugat-nílusi vírus esetében történt (Allan et al., 2009). A közösségek ökológiai szerkezetének megváltoztatása a betegség járványaiban is szerepet játszik. Például a bakteriálisan okozott Lyme-kór előfordulása az emberi populációban nőtt, amikor az alternatív gazdaszervezetek relatív bősége csökkent (LoGiudice et al., 2003), és ez függhet a kullancsvektorokon belüli kompetitív mikrobák közösségi struktúrájától (Clay et al. ., 2006).
A gazdákon és azokon belül található mikrobák közösségi szerkezete összefügg a betegségekkel szembeni rezisztenciával (Dethlefsen et al., 2007). Például a gombaellenes mikrobák fontos szerepet játszhatnak a betegségekkel szembeni ellenállóságban különféle fajokban (Gil-Turnes et al., 1989; Gil-Turnes és Fenical, 1992; Currie és mtsai, 1999; Kaltenpoth és mtsai, 2005; Scarborough és mtsai. al., 2005; Scott és mtsai, 2008). A gombaellenes mikrobaközösségek felbomlása valószínűleg a hasznos mikrobák védőhatásainak lebomlásához vezet, és betegség kialakulásához vezethet (Dethlefsen et al., 2007; Belden és Harris, 2007). Pozitívum, hogy a védő mikrobaközösségek helyreállítására szolgáló módszerek módot kínálhatnak a vadon élő állatok betegségeinek kezelésére a természetben.
A kialakulóban lévő fertőző betegség, a chytridiomycosis a kétéltű fajok kihalásáért felelős fő tényező, amelyek egyharmadát kihalás fenyegeti (Stuart et al., 2004; Lips et al., 2006; Skerratt et al., 2007). A chytrid fajok okozzák Batrachochytrium dendrobatidis (Bd), ez a bőrbetegség több mint 200 kétéltű faj populációjának csökkenésével és kihalásával függ össze az élőhelyek elvesztése által nem érintett területeken (Longcore és mtsai, 1999; Skerratt és mtsai, 2007). Az 1999-es leírás óta jelentős mennyiségű információt megtudtunk a kórokozó élettörténetéről, fiziológiájáról, populációgenetikájáról, a gazdaszervezet immunitására adott válaszairól és arról, hogy ez hogyan okoz halált (Morehouse et al., 2003; Piotrowski et al., 2004; Berger et et. al., 2005; Rollins-Smith és Conlon, 2005; Morgan és mtsai, 2007; Voyles és mtsai, 2007; Woodhams és mtsai, 2007a, 2007b, 2008). Sokkal kevesebbet tudunk arról, hogyan lehet a betegséget a természetben kezelni vagy kezelni. Javasoljuk, hogy a kétéltűek bőrmikrobái és a Bd közötti közösségi kölcsönhatások manipulálhatók legyenek a betegségekkel szembeni ellenálló képesség fokozása céljából, a betegség hatásának csökkentése céljából.
Anyagok és metódusok
Harmincegy R. muscosa fiatalkorúakat egy laboratóriumi kolóniából nyertek, amelyet szántóföldi tojásokból neveltek ki a Kaliforniai Egyetemen, Berkeley-ben. Mindegyik békát saját autoklávozott műanyag tartályába helyeztük, amely körülbelül 200 ml Provosoli táptalajt tartalmazott (Wyngaard és Chinnappa, 1982), és véletlenszerűen a fém állványokhoz helyeztük el a pozíciót a fém állványokon egy 17 ° C-ra beállított, szabályozott hőmérsékletű helyiségben, 12 órás fényciklussal. . A tartályokat 10% -os fehérítővel megtisztítottuk, és hetente kétszer autoklávoztuk. Minden békát hetente öt tücsökkel etettek. Az állatgondozási protokollokat a Kaliforniai Egyetem, a Berkeley's és a James Madison Egyetem Állatgondozási és Felhasználási Bizottsága hagyta jóvá.
Három csoporttal hajtottunk végre ismételt, randomizált kísérletet R. muscosa: (1) Bd, Bd zoosporáknak való kitettség; (2) baktériumok, kitettség J. lividum és (3) baktériumok + Bd, mindkettőnek való kitettség J. lividum és Bd állatkórók. Tizennyolc békát használtunk ebben a kísérletben, a mintaméret minden kezelési csoport esetében hat béka volt, mindegyik béka külön tartályban volt. A kísérlet kezdetén nem volt különbség a három kezelési csoport között (varianciaanalízis (ANOVA): d.f. = 2.15, F = 0.943, P= 0,411). Előzetes kísérlet további 10 fiatalkorúval R. muscosa a növekedési sebesség elérése érdekében standard laboratóriumi körülmények között végeztük. Ezt a becslést használták összehasonlításként a három manipulált kezelési csoport 18 békájából becsült növekedési sebességhez. Három másik fiatalkorú segítségével becsülték meg az violacein koncentrációját azokon az egyéneken, akiket nem végeztek semmilyen kísérleti manipulációval.
Ebben az időben a Bd és a Bacteria + Bd kezelések egyedeit Bd zoosporáknak tették ki. Ezt a napot a kísérlet 1. napjának tekintették. Közvetlenül az expozíció előtt minden békát lemértek. A békákat egyenként 120 ml-es GladWare tartályokba helyeztük, 300 zoosporát szuszpendálva 15 ml Provosoli táptalajban 24 órán át. Alternatív megoldásként a baktériumok kezelésében lévő békákat csak táptalajnak tették ki. A BEL JEL 215 törzs izolálva R. muscosa expozícióhoz használták. Az izolátum tenyészeteit 1% triptonban tartottuk fenn, és hetente vittük át. A békák beoltására használt zoospórás oldatot úgy állítottuk elő, hogy 1% triptont és 1% agart tartalmazó lemezeken tenyésztettünk zoospórákat. Körülbelül 72 óra elteltével a lemezeket 6 ml Provosoli táptalajjal öntöttük el. 20 perc elteltével a maradék oldatot pipettával eltávolítottuk. A zoospore koncentrációt hemacitométerrel határoztuk meg, és 20 zoosporára hígítottuk ml-enként.
Az átlagok különbségeit ANOVA-val tesztelték, hacsak az adatok nem voltak normálisan elosztva, ebben az esetben nemparametrikus Wilcoxon-tesztet alkalmaztak. Ismételt mértékű ANOVA-t alkalmaztunk a zoosporák számának időbeli eltéréseinek tesztelésére a kezelés függvényében. A baktériumok kezelésében a zoospore ekvivalensek egyik értéke szélsőségesen szélsőségesebb volt (Dixon tesztje: r10 = 1,0, n= 6, P
Eredmények
Anti-Bd baktériumok alkalmazása nem fertőzött békákon
Békák oldatba helyezése J. lividum a bőr sikeres kolonizációjához vezetett. Alapozók, amelyek specifikusak J. lividum jelezte, hogy a kísérletben részt vevő összes személy rendelkezik J. lividum bőrükön, függetlenül attól, hogy ennek a baktériumfajnak a fürdője volt-e kitéve. Azonban a metabolit által termelt J. lividum, violacein, csak a békában fürdött J. lividum oldat (lásd alább), míg a nem kezelt békák bőrén nem volt kimutatható violacein. Ez az eredmény arra utal, hogy a fürdés J. lividum megnövekedett a népsűrűség addig a pontig, ahol a vizelin másodlagos metabolit termelődik.
Túlélés
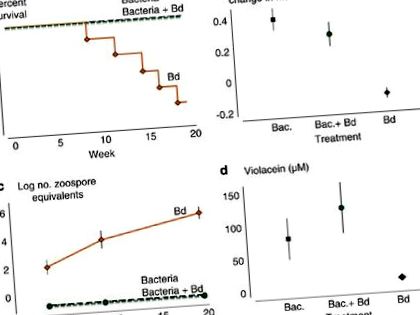
Hozzáadás J. lividum a nem fertőzött békákra megakadályozták a betegség halálos hatásait (1a. ábra). A Bd kezelés során hat békából öt meghalt, a hatodik békánál az előrehaladott stádiumú chytridiomycosis tünetei voltak. Nem történt mortalitás a Bacteria és a Bacteria + Bd kezelések során (Mantel – Cox log-rank teszt: d.f. = 2, χ 2 = 15.877, P= 0,0004).
A kezelési csoport hatása a (a) túlélés, (b) a békák arányos növekedése, (c) zoospore ekvivalenseinek átlagos száma B. dendrobatidis és (d) violacein koncentráció a béka bőrén. A hibasávok + 1 s.e. (fekete, Baktériumok kezelése; zöld, Baktériumok + Bd kezelés; narancs, Bd kezelés). A ábra teljes színes változata a következő címen érhető el: Az ISME folyóirat online.
Súlyváltozás
A Bd-kezelés során a békák nem nőttek és átlagosan csökkentek a súlyukból (1b. Ábra). Békák, amelyekkel oltottak J. lividum vagy azzal oltották be J. lividum mielőtt a Bd expozíció növekedett és a testtömeg mintegy 33% -át megnövelte (ANOVA: d.f. = 2.15, F = 17.71, P= 0,0001). A későbbi két kezelés során a békák napi növekedési sebessége megegyezett egy előzetes kísérletben 10 nem manipulált béka növekedési sebességével (lásd Anyagok és módszerek, ANOVA: d.f. = 2.19, F = 0.81, P= 0,461), ami arra utal, hogy a baktériumok hozzáadása önmagában nem befolyásolta a növekedési sebességet, és hogy a Bd-nek való kitettség előtti baktérium-adagolás megakadályozta a Bd-fertőzéssel járó súlycsökkenést.
Bd bőség
A qPCR által mért zoospore-ekvivalensek száma a Bd-bőség indexe. A Bd-kezelés során a békák Zoospore-ekvivalensei a kísérlet előrehaladtával exponenciálisan növekedtek (1c. Ábra). A baktériumok és a baktériumok + Bd kezelések során a békák bőrén nem volt kimutatható zoospore-ekvivalens az első minta napjától (19. nap) az utolsó mintánkig (139. nap), ami drámai különbség volt a Bd-kezeléstől (ismételt - méri az ANOVA-t a kezelés × idő interakció esetén: df = 4,28, Wilks 'λ = 0,179, P= 0,0001). Ezenkívül a Béka + Bd kezelés során a békahéjhoz adott baktériumok megakadályozták a Bd zoosporák általi sikeres megtelepedést (Kruskal – Wallis teszt - 19. nap: d.f. = 2, χ 2 = 12.645, P= 0,013; 62. nap: d.f. = 2, χ 2 = 16.129, P= 0,0003 és 139. nap: d.f. = 2, χ 2 = 16.129, P= 0,0003).
Violacein
A békák túlélése szorosan összefügg az violacein jelenlétével, amely az anti-Bd metabolit J. lividum (1d. Ábra). A Bd-kezelés során elhullott öt béka bőrén nem volt kimutatható violacein-koncentráció. A Bd-kezelés során túlélő békában nem volt kimutatható mennyiségű violacein (M); súlycsökkenése, zoospóraterhelése és letargikus viselkedése azonban súlyos Bd-fertőzést jelzett. Az átlagos violacein koncentráció sokkal magasabb volt a béka bőrén a baktériumok és a baktériumok + Bd kezeléseknél, mint a Bd kezelésnél (1d. Ábra; Kruskal – Wallis teszt: d.f. = 2, χ 2 = 8.727, P= 0,018). A három fiatalkorú, akiknek nem volt kitéve J. lividum vagy Bd bőrén nem volt kimutatható violacein koncentráció.
Vita
Megállapítottuk, hogy a Bd által okozott morbiditást és mortalitást megakadályozták a békabőrök biológiai felmérésével J. lividum és arra a következtetésre jutottak, hogy a rezidens mikrobák és a gyarmatosító kórokozók közötti ökológiai kölcsönhatások a veleszületett immunitásuk fontos elemei. Egyre jobban tudatában van annak, hogy számos fajnál a befogadó egyed mikrobiális közösségének összetétele meghatározhatja a betegség kimenetelét, ha egy kórokozó megtelepedik (Belden és Harris, 2007; Dethlefsen és mtsai, 2007; Ostfeld és mtsai, 2008). Ezenkívül a betegség vektorokban a mikrobiális kölcsönhatások befolyásolhatják a kórokozók prevalenciáját és betegségét (Clay és mtsai, 2006). Egyértelművé válik, hogy a betegség dinamikájának megértéséhez jellemezni kell a gazda, annak rezidens mikrobái és a gyarmatosító kórokozók közötti kölcsönhatásokat.
Ebben a kísérletben a fiatalkorú békákat alacsony Bd zoosporák koncentrációjának tettük ki a legtöbb más vizsgálathoz képest (Rachowicz et al., 2006; Retallick és Miera, 2007; Woodhams et al., 2007a). Az általunk használt állatkerti koncentráció azonban magasabb volt, mint amit a természetben lévő tó vizéből becsülünk (Kirshtein et al., 2007; Walker et al., 2007). Például Kirshtein és mtsai, 2007 és Walker és mtsai, 2007 becslései szerint a tavakban a zoospórasűrűség 0,5 és 454 között változott zoospóránként literenként, míg az expozíciós protokollunk 20 000 állatkert/liter volt 24 órán át. A legújabb kísérleti tanulmányokból vett mintavétel azt mutatja, hogy az egyes kétéltűek kísérleti tartályaikban Bd-sűrűségnek voltak kitéve, amely literenként 25 000 állatkerttől (Rachowicz és Vredenburg, 2004) és literenként 10 5–10 6 állatkóráig terjedt (Rachowicz és mtsai, 2006).; Retallick és Miera, 2007; Woodhams et al., 2007a). További kísérletekre van szükség, amelyek a Bd zoospóráknak való kitettség szintjét és időtartamát az anti-Bd baktériumok populációsűrűségéhez viszonyítva változtatják meg annak meghatározásához, hogy a bőr mikrobiota milyen körülmények között védő.
Kísérletünkkel azt teszteltük, hogy az egyik faj bakteriális lakói képesek-e hatékonyan gyarmatosítani egy másik fajt. Használtuk J. lividum szalamandrafajból izolálva a kísérletben használt fiatalkorú békák beoltására. Találtunk J. lividum tovább R. muscosa, arra utalva J. lividum rezidens mikroba és az J. lividum egy másik kétéltű fajból felhasználható sűrűségének növelésére (Woodhams et al., 2007b). Ezenkívül befejeztük az ezen törzs által termelt anti-Bd metabolitok vizsgálatát, így a Bd okozta morbiditás és mortalitás csökkenése összekapcsolható metabolitjaival (Brucker et al., 2008b). Eredményeink azt sugallják, hogy lehetőségünk nyílik a szélesebb körű fogékony kétéltű közösség megcélozására, ha a biológiai felmérés, mint a Bd ellenőrzésének módja a laboratóriumból a terepi környezetbe kerül.
Az violacein metabolit alacsony koncentrációban gátolja a Bd-t in vitro (Brucker és mtsai., 2008b) és gyártja J. lividum és nem kétéltűek. Ezt a metabolitot más baktériumfajok is előállítják, és védő funkcióval rendelkezik (Yang et al., 2007; Matz et al., 2008). Az violacein elemzése vadon kifogott szalamandrákon elég magas bőrkoncentrációkat mutatott a Bd gátlásához (Brucker et al., 2008b). Mivel a baktériumok általában nem termelnek gombaellenes szekunder metabolitokat, például violaceint, amíg a populáció sűrűsége nem magas, javasoljuk, hogy kísérletünkben J. lividum nagy népsűrűséggel volt jelen a béka bőrén. A kétéltűek képesek lehetnek szabályozni a mikrobiális közösség szerkezetét a bőrükön az antimikrobiális peptidek szekréciójával, amelyek szemcsés mirigyekben termelődnek (Rollins-Smith és Conlon, 2005). A jövőbeli kutatás kérdése annak meghatározása, hogy ez a szabályozás bekövetkezik-e, és vajon olyan módon működik-e, hogy szelektíven fokozza az antibiotikum metabolitokat termelő bőr baktérium törzsek növekedését, amikor a kétéltű bőrpatogéneknek van kitéve.
Eredményeink arra utalnak, hogy megfelelő anti-Bd baktériumokkal végzett biológiai felmérés felhasználható a kétéltű fajok túlélés biztosításában vagy fogságban tartó tenyésztelepein a Bd fertőzések megelőzésére. Ezek a telepek a védelmi erőfeszítések fontos elemét képezik, különösen, ha az egyedeket újra be lehet hozni a vadonba. A visszatelepülés gátja, hogy változatlanul egy vagy több kétéltű faj természetes élőhelyükön ellenáll a Bd-nek és tározóként szolgál (Mendelson et al., 2006; Young et al., 2007). A fogékony kétéltű fajok gombaellenes bőrbaktériumokkal történő kezelése lehetővé teheti az újra beillesztett egyedek együttélését a Bd-vel őshonos élőhelyeken. Ebben az összefüggésben fontos megbecsülni, mennyi ideig hatnak a bakteriális kezelések a kezelt kétéltűek vadonba engedése után. A kísérlet végén 20 héttel a baktériumok beoltása után a békákon találtunk violaceint, ami arra utal, hogy a bioagmentáció hatása legalább ilyen hosszú ideig tart.
A kétéltűek, mint csoport, nagyszámú népességcsökkenéssel és kihalással néznek szembe a chytridiomycosis miatt, ami a kétéltűek természetvédelmi biológusainak kiemelt prioritásává teszi a kezelést és a megelőzést. Eredményeink azt mutatják, hogy a kétéltűek közösségi ökológiájának megértése kulcsfontosságú alkotóeleme ennek a kialakulóban lévő fertőző betegségnek a kezelésében. A kétéltűek bőrmikrobiális közösségének egyszerű kezelése ígéretes kezelési eszköz a fertőzött személyek kezelésében. Ezenkívül a korábbi munka kimutatta, hogy a R. muscosa hogy a Bd-vel egyidejűleg nagyobb arányban voltak azok az egyének, akiknek legalább egy Bd-ellenes bőr baktérium izolátuma volt (Woodhams et al., 2007b; nem publikált adatok). Az egyes békák kezelése lehetővé teheti a populációk számára a védő baktériumokkal rendelkező egyedek nagyobb arányának elérését, és ezáltal lehetővé teszi a kórokozóval való együttélést.
- Háború utáni prevenció A kábítószer-használat megelőzésének kialakulóban lévő keretei a kábítószer-háború után
- Burgonya, főtt, főtt bőr, hús, só nélkül Táplálkozási adatok és kalória
- Makacs narancsbőr A fogyás segíthet megszabadulni ettől a narancsbőrtől, mint a bőr Egészségügyi tippek
- N95 Mask Eco Solutions Megelőzhetik-e a műtéti maszkok a coronavírus Jackson Parish kórházát
- Lenyűgöző test, lenyűgöző bőr átalakítási és formázási eljárások - működnek-e