A bél dysbiosisának elnyomása megfordítja a nyugati étrend által kiváltott érrendszeri diszfunkciót
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Élelmiszertudományi és emberi táplálkozási tanszék, Colorado Állami Egyetem, Fort Collins, Colorado
Az újranyomtatási kérelmek és egyéb levelezések címe: C. L. Gentile, Élelmiszertudományi és emberi táplálkozási osztály, Colorado State Univ., Fort Collins, CO 80524 (e-mail: [email protected]).
Absztrakt
Mikrobiota jellemzés.
A széklet anyagát a befejezéskor összegyűjtöttük, és a DNS-t a PureLink Microbiome DNS Purification Kit (A29790, Invitrogen, Carlsbad, CA) alkalmazásával extraháltuk. Kvantitatív PCR-t használtunk a mikrobiota szuppressziójának igazolására Abx-kezelt állatokban. A reakciókat optimalizáltuk a 16s rRNS-génre univerzális baktérium-primerek (előre 5'-AAACTCAAAKGAATTGACGG-3 ', fordított 5'-CTCACRRACACGAGCTGA-3') felhasználásával (2). A kerékpáros körülmények a Bio-Rad CFX96 hőkerékpárral a következők voltak: 95 ° C 3 percig, majd 40 ciklus 95 ° C 15 s, 61 ° C 15 s, 72 ° C 10 s, 85 ° C 5 s, majd fluoreszcencia detektálás.
A páros végű szekvenáló könyvtárakat az Illumina 16s protokoll követésével állítottuk össze, amely magában foglalja a 16s rRNS gén V3 – V4 régióinak amplifikálását, amplikonok tisztítását AmPure gyöngyökkel, ligálást Illumina adapterekkel és kettős indexekkel, majd egy újabb kör AmPure gyöngyöt tisztítás, mennyiségi meghatározás, denaturálás és könyvtárgyűjtés, valamint szekvenálás egy Illumina MiSeq-en. A párosított fastq fájlokat az alapértelmezett myPhyloDB ver használatával állítottuk össze és dolgoztuk fel. 1.2.0 szekvenáló pipeline (45), amely a mothur bioinformatikai szoftvert használja a szekvencia feldolgozásához (57). Röviden, a szekvenciákat átvilágítottuk (maxhomop = 0, maxambig = 1), kimérákat távolítottunk el, és a Green-Genes ver-ben a K-mer alapú legközelebbi szomszédhoz (KNN) soroltuk. 13_5 referencia adatbázis. A feldolgozás befejezése után az adatokat ritkítással normalizáltuk, a minimális mintaméret 165 872 olvasás alapján. Ötszáz független normalizálási futtatást hajtottak végre, és a további elemzések során az összes normalizálási futtatás átlagos bőségét használtuk.
Keringő analitok.
Az inzulin, a leptin és a gyulladásos citokinek, az interleukin-6 (IL-6), a monocita kemoattraktáns protein-1 (MCP-1) és a plazminogén aktivátor inhibitor-1 (PAI-1) plazmaszintjét multiplex vizsgálat (MADKMAG- 71K, EMD Millipore, Billerica, MA). Vizsgálaton belüli variabilitás (3 (UVP, Upland, CA) képalkotó rendszerek, és az adatok az SD-hez viszonyított változásokként vannak feltüntetve.
Glükóz tolerancia teszt.
Nál nél 5. hónap étrenden és 1 hét múlva a kísérlet befejezése előtt az egereket 6 órán keresztül éheztettük, és a vércukorszintet farok-vénás vérből határoztuk meg AlphaTRAK 2 glükózmérővel (Abbott Laboratories, Chicago, IL). Az egerek intraperitoneális injekciót kaptak 2 g/kg dextrózról, és a vércukorszintet 0., 15., 30., 60. és 120. percben értékeltük az injekció beadása után.
Statisztika.
Az adatokat átlag ± SE-ként fejezzük ki. A statisztikai elemzést egyirányú ANOVA alkalmazásával, Tukey post hoc tesztjével végeztük (SPSS for Windows, 11.5.0 kiadás; SPSS, Chicago, IL). Vegyes modellű ANOVA-t (faktoron, időn vagy dózison belül; faktor, kezelési csoport között) használtunk az aPWV, valamint az EDD és az EID dózis-válasz görbékhez. Amikor jelentős fő hatást észleltek, Tukey post hoc tesztjét végezték el a specifikus páros különbségek meghatározására. A P értéke 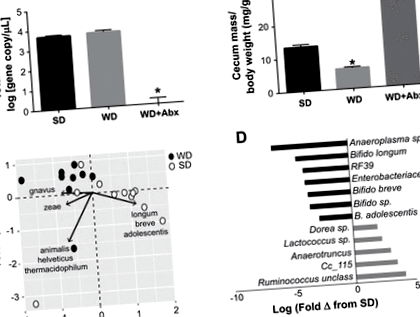
1. ábra.Az antibiotikum-kezelés elnyomja a bél mikrobiotáját a nyugati étrend által kiváltott dysbiosis után. A: a baktériumok számának változásai a standard étrend (SD), a nyugati étrend (WD) és a WD után antibiotikummal (Abx). B: vakbéltömeg WD és antibiotikus kezelést követően. C: fő komponens-analízis (PCA) egér bélsár mikrobiális közösségének táplálékkal színezett (zárt körök = WD; nyitott körök = SD) színezése, és az egyes kvadránsokban a variabilitást előidéző baktériumfajok feltüntetése. D: szignifikánsan differenciálisan bőséges baktérium taxonok hisztogramma WD-ben az SD-hez képest (q = 0,05) log log-változásként jelenik meg. A statisztikai elemzést egyirányú ANOVA alkalmazásával, Tukey post hoc tesztjével végeztük. Az adatokat átlag ± SE-ként fejezzük ki; n = 10–12/csoport. *P
A nyugati étrend jelentős változásokat eredményezett a bél mikrobiotájában. Például az SD-hez képest a WD-n lévő állatok szignifikánsan megnövelt Firmicutes értéket mutatnak (SD = 49,755; WD = 109,454; P = 0,0002) és csökkent Bacteroidetes (SD = 21 907; WD = 11 205; P = 0,016) és az aktinobaktériumok (SD = 94,082; WD = 45,210; P = 0,003). A PCA-elemzés kimutatta a minta csoportosítását étrendtípusonként a PC1 mentén, a szétválasztást az vezérelte Ruminococcus gnavus WD-hez és többhez Bifidobacterium spp. SD-re (1. ábraC). Az étrend számos baktérium taxon bőségét változtatta meg; különösen, Bifidobacterium spp. szignifikánsan nagyobb mennyiségben voltak SD állatokban a WD-vel összehasonlítva (1. ábraD).
Az artériás merevség fokozatosan nőtt a WD egerekben a 7 hónapos beavatkozás során. Antibiotikum-kezelésben részesített, WD-vel táplált egerekben (WD + Abx) az artériás merevség teljesen normalizálódott SD-szintre (2. ábraA). Hasonlóképpen, az aorta közeg vastagsága megnőtt a WD-ben az SD egerekhez képest, és normalizálódott a WD + Abx-ben (2. ábraB). Nem figyeltünk meg csoportkülönbségeket a passzív luminal átmérőnél (SD 161,7 ± 7,4, WD 170,8 ± 6,7, WD + Abx 174,9 ± 8,5 µm) vagy a fenilefrin által kiváltott preconstrikciónál (SD 56,6 ± 5,5, WD 59,0 ± 4,3, WD + Abx 59,9 ± 4,4) %) izolált mesenterialis artériákban. Az artériás merevséghez hasonlóan az endothelium-függő dilatáció (EDD) jelentősen károsodott a WD egerekben, és az antibiotikum-kezelés megfordította ezt a diszfunkciót (3. ábra, A és B). A nitrogén-oxid szintáz gátlása l-NAME-vel csökkentette az EDD-t minden csoportban, így a maximális acetilkolin által közvetített dilatáció minden csoportban hasonló volt (3. ábraC). Az l -NAME által gátolt dilatáció csökkent volt WD egerekben, és helyreállt antibiotikum-kezeléssel (3. ábraD). Az endothelium-független dilatációt diéta vagy antibiotikum-kezelés nem változtatta meg (3. ábra, E és F).
2. ábra.Az antibiotikumok megfordítják a nyugati étrend által kiváltott artériás merevséget. A: az artériás merevséget sorozatosan mértük az aorta pulzus hullám sebességével (aPWV). Az antibiotikus kezelést a WD egerek egy részében 5 hónapos WD etetés után kezdtük meg, az indikációnak megfelelően. B: a közeg vastagságát a proximális mellkasi aorta szegmensében határoztuk meg. A statisztikai elemzést ismételt ANOVA (aPWV) és egyirányú ANOVA (tápközeg vastagság) alkalmazásával, Tukey post hoc tesztjével végeztük. Az adatokat átlag ± SEM-ben fejezzük ki; n = 10–12/csoport. *P
3. ábra.Az antibiotikumok visszafordítják a nyugati étrend által kiváltott endotheliális diszfunkciót és helyreállítják az l -NAME által gátolt dilatációt. Az endothelium-függő dilatáció (EDD) önmagában acetilkolinra (ACh) (A és B) és nitrogén-oxid szintáz inhibitor l -NAME (C) mesenterialis artériákban határoztuk meg. D: az l -NAME által gátolt dilatációt, az NO-függő dilatáció mértékét kiszámítottuk a maximális EDD százalékos csökkenésének hiányában, szemben az l -NAME jelenlétével. E és F: endothelium-függő dilatáció (EID) nátrium-nitroprussziddá (SNP). A statisztikai elemzést ismételt ANOVA (EDD és EID dózisválaszok) és egyirányú ANOVA (összes többi eredmény) alkalmazásával végeztük. Amikor jelentős fő hatást észleltek, Tukey post hoc tesztjét végezték el a specifikus páros különbségek meghatározására. Az adatokat átlag ± SE-ként fejezzük ki; n = 8–12/csoport. *P
A testtömeg, valamint az epididymális és a szubkután zsírtömeg jelentősen megnőtt a WD által, és az antibiotikum-kezelés nem befolyásolta őket (4. ábra, A-C). A plazma leptin és inzulin szintje szintén megemelkedett WD-ben, és nem csökkent jelentősen az antibiotikum-kezeléssel (4. ábra, D és E). Hasonlóképpen, a WD szignifikánsan rontotta a glükóz toleranciát, az antibiotikum-kezelésnek nincs hatása (4. ábraF).
4. ábra.Az antibiotikum-kezelés nem változtatja meg a testösszetételt vagy a glükóz toleranciát. Testsúly (A), epididymális zsírtömeg (B) és a szubkután zsírtömeg (C) WD etetés és antibiotikus kezelés után. Plazma leptin (D) és inzulin (E) multiplex ELISA-val határoztuk meg. F: a görbe alatti terület (AUC) az ip glükóz tolerancia teszthez (GTT). A statisztikai elemzést egyirányú ANOVA alkalmazásával, Tukey post hoc tesztjével végeztük. Az adatokat átlag ± SE-ként fejezzük ki; n = 10–12/csoport. *P
Annak a lehetséges mechanizmusnak a feltárása érdekében, amellyel a bél dysbiosis szuppressziója megfordította az érrendszeri diszfunkciót, megvizsgáltuk az LPS-kötő fehérje (LBP) és az oldható klaszter-differenciálódás-14 (sCD14) plazmaszintjét, a kardiovaszkuláris kimenetelekhez társuló két LPS-jelzőt (35). ). LBP (5. ábraA) és az LBP: sCD-14 arány (5. ábraB) növekedtek WD-ben, és szignifikánsan csökkentek WD + Abx-ben. Ezen adatok fényében legközelebb több proinflammatorikus mediátor plazmaszintjét mértük, amelyet LPS indukált. Az IL-6 és a PAI-1 szignifikánsan növekedett WD-ben, de nem WD + Abx; míg az MCP-1 szignifikánsan csökkent a WD + Abx-ben (5. ábra, C-E). A vaszkuláris diszfunkcióhoz hozzájáruló potenciális mechanizmusok további vizsgálatához megvizsgáltuk a fehérje expresszióját az aortában és a környező PVAT-ban. Az NF-κB foszforilációja, amely szintén az LPS szignalizáció után történik, jelentősen megnőtt a WD egerek aortájában, és az antibiotikum-kezelést követően normalizálódott (6. ábraA). A p67phox, a NADPH-oxidáz (NOX) 2 szabályozó alegységének PVAT-expressziója nőtt WD-ben, de nem WD + Abx, összehasonlítva a kontrolltáplált egerekkel (6. ábraB). Ezzel szemben a PVAT NOX4 expressziója nem volt különbözõ a csoportok között (6. ábraC). Végül a PVAT AGE általában magasabb volt WD-ben (P = 0,053 vs. SD), és szignifikánsan csökkentek a WD + Abx-ben a WD-vel összehasonlítva (6. ábraD).
5. ábra.Az antibiotikum-kezelés gyengíti a nyugati étrend által kiváltott emelkedést az endotoxémia és a gyulladás keringő markereiben. Forgó LBP (A), LBP/sCD14 (B), IL-6 (C), PAI-1 (D) és az MCP-1 (E) plazmában határoztuk meg ELISA-val. A statisztikai elemzést egyirányú ANOVA alkalmazásával, Tukey post hoc tesztjével végeztük. Az adatokat átlag ± SE-ként fejezzük ki; n = 5–12/csoport. *P
6. ábra.Az antibiotikum-kezelés gyengíti a nyugati étrend által kiváltott fehérje-növekedést a gyulladás és az oxidatív stressz miatt. A: a foszforilezett és az összes NF-κB arányát az aortában határoztuk meg Western-blot segítségével. A NADPH-oxidáz (NOX) 2 p67phox alegység bősége (B), NOX4 (C), valamint a fejlett glikációs végtermékek (AGE) (D) perivaszkuláris zsírszövetben (PVAT) határoztuk meg Western-blot segítségével. GAPDH expressziót alkalmaztunk a fehérjetöltési különbségek elszámolásához. Reprezentatív blotokat mutatunk be az egyes grafikonok alatt. A statisztikai elemzést egyirányú ANOVA alkalmazásával, Tukey post hoc tesztjével végeztük. Az adatokat átlag ± SE-ként fejezzük ki; n = 7–12/csoport. *P
Végül számos korrelációs elemzést futtattunk, hogy betekintést nyerjünk a baktériumfajok változásai, a gyulladás és az érrendszer működésének összefüggéseibe. Számos baktériumfaj kapcsolódott az elsődleges eredményekhez; különösen három törzs Bifidobaktériumok fordítottan korreláltak a testtömeggel, az LBP-vel és az érrendszeri funkcióval (lásd 1. kiegészítő ábraA, elérhető a cikk online változatával és az 1. táblázattal). Ezenkívül az LBP szignifikánsan korrelált az érfunkció mindkét indexével, az l -NAME által gátolt dilatációval, valamint a szisztémás és érrendszeri gyulladással (1. kiegészítő ábra, B-E). Ezek az eredmények együttesen olyan eseménysorozatot támogatnak, amelyben a WD által kiváltott redukció Bifidobaktériumok fokozza az LPS transzlokációját és a szisztémás szignalizációt, ami viszont gyulladásos választ terjeszt, amely az érrendszeri diszfunkciókat vezérli.
1. táblázat: Összefüggések a baktériumok mennyisége és a fiziológiai eredmények között standard és nyugati táplálékkal táplált egerekben
A korrelációkhoz a standard étrend (SD) és a nyugati étrend (WD) csoportok vegyes adatait használtuk. B., Bifidobacterium; EDD, endothelium-függő dilatáció; aPWV, az aorta impulzus-hullám sebessége; LBP, LPS-kötő fehérje; BW, testtömeg. n = 9–12/csoport.
* P l -NAME által gátolt dilatáció. Végül az étrend okozta érrendszeri diszfunkció korrelált számos baktérium taxon, nevezetesen számos Bifidobacterium. Ezek az eredmények együttesen azt jelzik, hogy a béldiszbiózis ok-okozati tényező lehet az érrendszeri diszfunkció kialakulásában, és arra utalnak, hogy a bakteriális eredetű LPS potenciálisan szerepet játszik ezeknek az eseményeknek a közvetítésében. Ezek az eredmények kiterjesztik a bél dysbiosisát más kardiovaszkuláris rendellenességek, köztük az érelmeszesedés és a magas vérnyomás kialakulásával kapcsolatos legújabb adatokat (60), és további támogatást nyújtanak annak a gondolatnak, hogy a bél mikrobiota a jövőben terápiás célpontot jelent a szív- és érrendszeri betegségek számára (30).
A nyugati étrend által kiváltott elhízás rágcsálómodelljei hasonló mikrobiális összetételű változásokat mutatnak mikrobiális összetételüknél, mint az elhízottak esetében, beleértve a megnövekedett Firmicutes: Bacteroidetes arányt (40, 62), és ezeket a változásokat metabolikus zavarok kísérik (8) . A bél mikrobiota antibiotikumokkal történő elnyomását számos állatmodellben alkalmazták a bél mikrobiota ok-okozati szerepének megállapítására a betegség kockázatában vagy a progresszióban (11, 37, 52, 61). Például antibiotikumokat használtak a bél mikrobiota kötelező szerepének megállapítására a proimetogén trimetilamin vegyület előállításában N-oxid (TMAO) (65).
Tudomásul vesszük, hogy egy további kontrollcsoport hiánya, amely normál étrenddel (SD) táplálkozik és antibiotikumot kap, a jelen tanulmány jelentős korlátja. Korábbi kutatások nem figyelték meg az alacsony zsírtartalmú étrendtel táplált egerekben az antibiotikum-kezelés hatását az endotoxémia markereire vagy az anyagcsere-paraméterekre (8, 11). Tekintettel arra, hogy az SD-vel táplált egerek normális vaszkuláris funkciót mutatnak, nem számítottunk arra, hogy az SD + Abx csoport felvétele bármilyen jelentős betekintést nyújt a bél dysbiosis szerepébe az érrendszeri diszfunkció közvetítésében. Megfigyeltük azonban az aPWV enyhe, életkorral összefüggő növekedését SD csoportunkban. Tehát, ha ez a növekedés a mikrobiális összetétel változásához kapcsolódott, akkor az antibiotikum-kezelés gyengíthette ezt a növekedést. E korlátozástól függetlenül eredményeink azt mutatják, hogy a nyugati étrend által kiváltott dysbiosis fontos tényező az érrendszeri diszfunkció kialakulásában.
Összefoglalva, a jelen munka megerősíti azokat a korábbi kutatásokat, amelyek a bél dysbiosisát összekapcsolják az endotheliális diszfunkcióval, és elsőként bizonyítja, hogy a bél dysbiosisának elnyomása megfordítja a nyugati étrend által kiváltott artériás merevséget. Az adatok mechanisztikus betekintést nyújtanak a diszfunkció downstream mediátoraiba, és további támogatást nyújtanak a mikrobiotára célzott terápiák kifejlesztéséhez a szív- és érrendszeri betegségek kezelésében és megelőzésében.
Ezt a tanulmányt a Boettcher Alapítvány Webb-Waring orvosbiológiai kutatási programja (C. L. Gentile) támogatta.
A szerzők nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
- Orvos BMI és Súlytanácsadó Journal of Ethics American Medical Association
- A túlsúly és az elhízás elterjedtsége az amerikai kollégiumi játékosoknál, a Journal Journal szerint
- Strukturális és funkcionális változások a magas zsírtartalmú étrend okozta elhízott egerek veseiben Amerikai
- Szexuálisan dimorf myeloid gyulladásos és metabolikus válaszok az étrend okozta elhízásra
- A furoszemid kálium-megtakarító hatása egerekben magas káliumtartalmú étrenden American Journal of