Szexuálisan dimorf myeloid gyulladásos és metabolikus válaszok az étrend okozta elhízásra
A Michigan Egyetem Orvostudományi Karának Gyermekgyógyászati Endokrinológiai Osztálya, Gyermekgyógyászati és Fertőző Betegségek Tanszék, Ann Arbor, Michigan
A Michigan Egyetem Orvostudományi Karának Gyermekgyógyászati Endokrinológiai Osztálya, Gyermekgyógyászati és Fertőző Betegségek Tanszék, Ann Arbor, Michigan
A Michigan Egyetem Orvostudományi Karának Gyermekgyógyászati Endokrinológiai Osztálya, Gyermekgyógyászati és Fertőző Betegségek Tanszék, Ann Arbor, Michigan
A Michigan Egyetem Orvostudományi Karának Gyermekgyógyászati Endokrinológiai Osztálya, Gyermekgyógyászati és Fertőző Betegségek Tanszék, Ann Arbor, Michigan
Az újranyomtatási kérelmek és egyéb levelezések címe: K. Singer, Gyermekgyógyászati Osztály, Gyermek endokrinológiai osztály, Univ. of Michigan Medical School, D1205 MPB, 1500 E. Medical Center Dr., Ann Arbor, MI 48109 (e-mail: [e-mail védett]).
Absztrakt
Klinikai és állatkísérletek során jól ismert, hogy a nőknek és a férfiaknak különböző a betegség kockázata, valamint a betegség élettana eltérő. A reproduktív korú nők védettek a metabolikus és a szív- és érrendszeri betegségektől a posztmenopauzás nőkhöz és férfiakhoz képest. A legtöbb egérvizsgálat ferde a hím egerek alkalmazásában az elhízás okozta metabolikus diszfunkció tanulmányozására, a nőstény egerek hasonló védelme miatt. Megvizsgáltuk az étrendi elhízást egérmodellben, és közvetlenül összehasonlítottuk a gyulladásos reakciókat férfiaknál és nőknél. Ebben az áttekintésben összefoglaljuk, mi ismert az étrend által kiváltott gyulladás nemi különbségeiről, és összefoglaljuk a témával kapcsolatos adatainkat. Nyilvánvaló, hogy a magas zsírtartalmú étrend által kiváltott gyulladásos aktiváció nemi különbségei az obesogén jelekre adott hematopoietikus válaszok belső intrinsic különbségéből adódnak, de további kutatásokra van szükség annak megértéséhez, hogy mi vezet szexuálisan dimorf válaszokhoz.
a globális elhízás aránya az elmúlt évtizedekben drasztikusan emelkedett, jelenleg minden harmadik egyént elhízottnak minősítenek (34). Az elhízással összefüggő betegségek, mint például a cukorbetegség és a szív- és érrendszeri betegségek (CVD), általános előfordulása szintén növekszik ennek eredményeként (3a). Az elhízás a kalóriabevitel és az energiafelhasználás egyensúlyhiányának eredményeként nyilvánul meg. Az elhízási arány növekedésének egyik fő tényezője a telített zsírsavakban gazdag kalóriasűrűségű ételek fogyasztásának növekedése (4). A magas zsírtartalmú ételek fokozott fogyasztásával az egyének felhalmozódnak a testzsírban, és ezáltal fokozott a kockázata az elhízással kapcsolatos betegségek kialakulásának. Ebben a rövid áttekintésben a diéta okozta elhízás hatásait fogjuk hangsúlyozni, elsősorban az immunrendszer magas zsírtartalmú étrendjének (HFD) alapozásának szexuálisan dimorf válaszaira összpontosítva.
Az egyén reakciója a HFD-re számos tényezőtől függ, beleértve a nemet, az életkort és az etnikumot. Ami egyre szembetűnőbb, hogy az elhízásban és a cukorbetegségben egyértelmű a szexuális dimorfizmus. Míg a nőknél az elhízás aránya magasabb (34), a férfiaknál magasabb a szív- és érrendszeri betegségek (CVD) és a 2-es típusú cukorbetegség (30, 36), ami arra utal, hogy a nők védettek az elhízás káros hatásaitól (30). Ez különös jelentőséggel bír, mert a cukorbetegség és a CVD vizsgálatakor sok preklinikai vizsgálatot végeztek egyedül férfiakon, így hiányosságok maradtak az elhízásra adott szexuálisan dimorf válaszokról (45). Ezért iránymutatásokat és terápiákat hoznak létre a férfiakon végzett vizsgálatok alapján, de férfiaknál és nőknél alkalmazzák őket (13).
Fontos a hímek és a nők vizsgálata annak érdekében, hogy megértsük ezeket a nemspecifikus különbségeket elősegítő tényezőket. Korábbi tanulmányok a megváltozott hormonkörnyezetre, az anatómiai zsíreloszlásra (17, 19) és az energiafelhasználási különbségekre összpontosítottak. Megállapították, hogy a nők teljes testzsírtartalma 10% -kal magasabb az azonos testtömeg-indexű (BMI) férfiakhoz képest (15). Ez a dimorfizmus különösen mély a rossz társadalmi-gazdasági körülmények között, míg a gazdagabb környezet kisebb eltérést mutat a nemek közötti adipozitásban (11). Ez azt sugallja, hogy az ösztrogén társadalmi-gazdasági státusztól függetlenül nagymértékben befolyásolja a zsír felhalmozódását (11). Ezenkívül, ha az adipozitás megegyezik, a nők nagyobb mennyiségű szubkután zsírt mutatnak, mint a férfiak, míg a hímeknél nagyobb az intraabdominális vagy a zsigeri zsír (5, 9). Ismeretes, hogy a nőknél magasabb az energiafelhasználás aránya (47, 49). Korlátozott adatok állnak rendelkezésre ennek megmagyarázására, de jelzik a barna zsírszövet (BAT) növekedését a nőknél (17), és a legújabb tanulmányok kimutatták az ösztrogén szerepét az izomanyagcserében a nemi különbségek között (40). Megállapították azt is, hogy az ösztradiol befolyásolhatja az agyat az ételfogyasztás csökkentésében és stimulálhatja az önkéntes testmozgást, függetlenül annak metabolikus hatásaitól (51).
A metabolikus szindróma előfordulása az életkor előrehaladtával növekszik, mivel a nők magasabb BMI-vel néznek szembe (1), ami az eredendő védelem elvesztését bizonyítja. Az egyik tényező, amely ehhez hozzájárul, a menopauza. Klinikailag a menopauza idején elmozdulás következik be a keringő ösztradiol szintben, és megnő az androgének aránya, ami a nőknél fokozottabb kockázatot jelent a CVD és a 2-es típusú cukorbetegség szempontjából (36, 42). Konkrétan a nemi hormonkötő globulin (SHBG) alacsony szintje, a magas szabad androgénszint és az alacsony ösztradiolszint szerepet játszik a perimenopauzás nők CVD-kockázatában (48). Egérmodellekben a menopauza kezdetét utánzó petefészek-elégtelenség alkalmazása megfelel az inzulinrezisztencia növekedésének (42). Ebben az egérmodellben megakadályozták az inzulinrezisztencia kialakulását a petefészek elégtelenségét követően ösztrogénpótló (17-β ösztradiol) terápiával, ezáltal még jobban bizonyítva a nemi hormonok jelentőségét az anyagcsere-betegség megnyilvánulásában (42).
Míg a nemi hormonok logikus magyarázatot jelentenek az elhízásra adott férfi és női válaszreakciókra, az ösztrogénpótló terápiákat alkalmazó klinikai vizsgálatok nem jártak sikerrel a szív- és érrendszeri betegségek megelőzésében (26 Ezért további feltárásokra van szükség az új vizsgálati területeken annak érdekében, hogy megszüntessük a hiányosságokat annak megértésében, hogy mi kapcsolja össze az elhízást a férfiak és a nők betegségeivel.
Az elhízás krónikus gyulladással jár
Az elhízás során felvett ATM-ek elősegítik az inzulinrezisztenciát
A makrofágok egyre inkább szerepet játszanak az anyagcsere-betegségek kialakulásában. Az immunrendszer kulcsfontosságú közvetítőiként a makrofágok számos szerepet játszanak mind a veleszületett, mind az adaptív immunitás terén: felismerik és végrehajtják a mikrobák, paraziták és idegen anyagok fagocitózisát; felszabadító citokinek; szekretál kemoattraktánsokat más immunsejtek toborzásához; és idegen antigéneket mutat be a limfociták számára (10). A makrofágok szinte az összes szövetben megtalálhatók, és a populációjuk és a környezetük által meghatározott tulajdonságokkal rendelkezik (53). A normál homeosztatikus állapotban vannak rezidens szöveti makrofágok, amelyek a sovány viscerális zsírszövet összes sejtjének 10-15% -át képviselik (53). Az elhízás során azonban nő a proinflammatorikus szöveti makrofágok száma, ami oda vezethet, hogy a zsigeri zsírszövet összes sejtjének 45-60% -át képviselik (53).
Az ATM-eknek két megkülönböztethető típusát különböztetik meg: toborzott ATM-eket, amelyek főleg elhízott egyénekben találhatók és klasszikus M1 aktiválási mintázatot mutatnak, és rezidens ATM-eket, főleg sovány egyéneknél, amelyek alternatív aktiválást mutatnak, mint az M2 makrofágok ( 23.). A felvett ATM-eket az MGL1, egy sejtfelszíni receptor szabályozza, amely ellenőrzi a monocita/makrofág aktivációt és a Ly6c hi monociták zsírszövetbe történő kereskedelmét (54). Ezek az ATM-ek túlexpresszálják a makrofág-migrációban és a fagocitózisban fontos géneket, és megkülönböztethetők a CD11c sejtfelszíni markerrel, amelyet a rezidens ATM-ek nem tartalmaznak (23). Az aktivált ATM-ek koronaszerű struktúrának (CLS) nevezett területeken gyűlnek össze, amelyek haldokló adipociták körül alakulnak ki. Az aktivált makrofágok ezeken a klasztereken belül számos gyulladásos citokint szabadítanak fel, amelyek káros hatással vannak az adipocita működésére, például csökkent inzulin-közvetített glükózfelvétel és csökkent adipogenezis (23).
Nagy zsírtartalmú környezetben a toborzott makrofágok kitágulnak a zsírszövetben, és további helyeken halmozódnak fel, beleértve az agyat (21), a májat (16), az izmot és a hasnyálmirigyet (31), ami szisztémás gyulladáshoz és betegséghez vezet. Nemrégiben bizonyítékokat találtunk arra vonatkozóan, hogy alapvető változások következnek be a hematopoietikus ős- és progenitor sejtekben (HSPC) a HFD-etetés után, ami a makrofágok termelésének növekedéséhez vezet. Ezek a változások a HSPC-kben a granulocita és a makrofág progenitorok megnövekedett termeléséhez vezetnek, és aktivált monocitákat generálnak, amelyeket aztán aktivált szöveti makrofágokká toboroznak (46).
A hematopoietikus őssejt (HSC) terjeszkedésének és a myeloid progenitor növekedésének ezen megállapításán keresztül arra a következtetésre juthattunk, hogy a hematopoietikus őssejtek étrendi alapozása zsírszöveti gyulladáshoz vezet, és hogy az obesogén jelek révén fokozódik a leukocita termelés (46). Más csoportok azt is megállapították, hogy rágcsálómodellekben az elhízás a csontvelő myeloid progenitorainak szaporodásának és terjeszkedésének mozgatórugója, az elhízott rágcsálóknál a monocitózis és a neutrophilia fokozódik sovány társaikhoz képest (33 Összességében az elhízott egyének ezen HSC-aktivációjának mozgatórugói továbbra sem megoldottak.
Szexuálisan dimorf válaszok magas zsírtartalmú étrendben
Mint korábban említettük, a fenti vizsgálatokat, amelyeket a diéta okozta elhízás során bekövetkező gyulladásos változások jellemzésére végeztek, férfiaknál végeztek. Kimutatták, hogy a nőstény egerek védettek az inzulinrezisztenciától, és a laboratóriumban összességében csillapítják a HFD-re adott válaszokat. Számos mechanizmust vizsgáltak annak megértésére, hogy mi védi a nőstényeket a hímeknél tapasztalt ugyanazokkal az anyagcserezavarokkal szemben. Az eddigi kutatások ezen a területen azt mutatják, hogy a hím és nőstény egerek mély különbségeket mutatnak az anatómiai zsírszövet eloszlásában és terjeszkedésében. Tanulmányok kimutatták, hogy még az étrend és más környezeti feltételek kontrollálásakor is a hím egerek az összes testtömeg jelentősen nagyobb kiterjedését mutatják, beleértve a szubkután zsírszövetet (SAT), a zsigeri zsírszövetet és a májat, mint nőstény társaik (12, 14).
A férfiak és a nők közötti mechanisztikus különbségek megértése érdekében a vizsgálatok különféle hormonmodellekre összpontosítottak. Ezek közül azt találták, hogy az ösztrogén receptor α (ERα) kritikus fontosságú a nőstény egereknél megfigyelt szövetgyulladás elleni védelemben (41.
Szexuálisan dimorf makrofág válaszok a magas zsírtartalmú étrendre
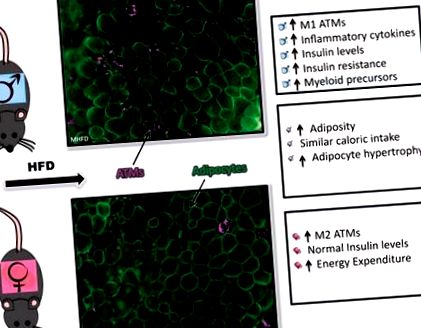
A szexuálisan dimorf változatosság mögött rejlő mechanizmus rejtélyes marad, különösen a myeloid gyulladás szabályozása szempontjából. A HFD-re adott különböző gyulladásos válaszok megértése érdekében megvizsgáltuk az ATM-eket és a HSC/csontvelő (BM) populációkat HFD-n lévő hím és nőstény állatokban (47). 60% zsíros alapú HFD chow alkalmazásával mind a hímek, mind a nők képesek voltak hízni és zsírosodni, bár a hímek nagyobb testtömeget nyertek a nőkhöz képest. Míg a nőstények súlyt, zsírosságot és adipocita hipertrófiát tapasztaltak a HFD-n, normális glükóz tolerancia és alacsonyabb inzulinszint volt a hím egerekhez képest. Amikor legközelebb a zsírszövet gyulladásos változásait vizsgáltuk a férfiaknál 16 hét HFD után, egyértelmű makrofágok terjeszkedése következett be, különösen a CLS-t képező CD11c + ATM-ek. A nőstények a makrofágok terjeszkedését is kimutatták, de elsősorban a CD11c típusúakat. A zsírszövetben kialakuló gyulladásos környezet megértése érdekében megvizsgáltuk a gyulladásos citokinek zsírszöveti génexpresszióját, és azt láttuk, hogy a HFD-n lévő nőknél az expresszió csökkent volt, összehasonlítva a HFD-vel rendelkező férfiakkal (47).
Korábbi megállapításainkkal, miszerint az elhízott férfiaknál a HSC-k és a myeloid progenitorok terjeszkednek, ebben a modellben értékeltük a monocitákat és a hematopoietikus progenitorokat. Megállapítottuk, hogy bár a nőknél a kiinduláskor normális mieloid progenitorok voltak, ezek a sejtek nem tágultak HFD-vel, mint azt a férfiaknál láttuk. Ex vivo vizsgálva a csontvelőt, azt tapasztaltuk, hogy a női BM a palmitinsav (telített zsírsav) stimuláció után kevesebb granulocita és makrofág kolóniát produkált, mint a férfiak, és alacsonyabb citokin választ adott lipopoliszacharidokra (LPS) (47).
Figyelembe véve a belső BM változásokat, valamint a férfiak és a nők különbözõ súlygyarapodása és energiafelhasználása iránti aggodalmat, ezt követõen versenyképes BM transzplantációt (BMT) hajtottunk végre, ahol a hím és nõi csontvelõt akár hím, akár nõstény recipiens állatban értékelni lehetett. A BMT után kihívtuk a befogadó állatokat HFD-re, és megállapítottuk, hogy a fogadó nemtől függetlenül a hím BM-sejtek több ATM-t, konkrétan több CD11c + ATM-t termelve reagáltak az étrend okozta elhízásra. Ez arra utal, hogy a nemek között sejt-belső különbség van az elhízásra adott hematopoietikus válaszokban. Ez azt is jelezheti, hogy a HSC progenitor populációjában állandó, egész életen át tartó változás következik be a HFD-nek való kitettség után (47).
Az elmúlt évtizedekben jobban megértették az étrend okozta elhízás gyulladásra és inzulinrezisztenciára gyakorolt hatását, de továbbra is jelentős hiányosságok vannak a szexuálisan dimorf gyulladásos válaszokkal kapcsolatos ismereteinkben. Férfi és női versenyképes BMT-k segítségével arra a következtetésre juthattunk, hogy az étrend által kiváltott elhízásra reagálva a csontvelő HSC- és progenitorpopulációiban van egy belső szexuális dimorfizmus, amely független a súlygyarapodástól és az energiafogyasztástól, bár ennek a dimorfizmusnak a hajtóereje még mindig nem világos (1. ábra).
1. ábra.Szexuálisan dimorf gyulladásos válaszok az étrend okozta elhízásra. A gonadális fehér zsírszövet immunfluoreszcenciája (caveolin, zöld; Mac2, bíbor festés) és a férfi válaszok összefoglalása (tetejére), női válaszok (alsó) és szexuálisan hasonló válaszok (középső) az étrend okozta elhízásig. HFD, magas zsírtartalmú étrend; ATM, zsírszöveti makrofág.
Az ezen a területen végzett kutatások kimutatták, hogy a nemi hormonok, az adipocita tulajdonságok és a genetika kulcsfontosságú mozgatórugók a férfiak és a nők közötti elhízás, cukorbetegség és szív- és érrendszeri betegségek közötti különbségekre. Az ösztrogén szisztémás szerepet játszik, javítja az energiaegyensúlyt az idegsejtek szignáljain keresztül, a hasnyálmirigy β sejtjeinek túlélésén, javítja a lipid anyagcserét és az inzulinérzékenységet a májban és az izomban (28). Kimutatták, hogy az ERα hatásai az adipocitákban való aktiválódása révén jelentkeznek, különösen férfiaknál. A szív- és érrendszeri betegségek összefüggésében a mieloid-specifikus ERα-delécióról kiderült, hogy inzulinrezisztenciát és érelmeszesedést indukál (39). Amint azt korábban említettük, az ovariectomizált egerek a zsírszövet gyulladásának és az inzulinrezisztenciának a növekedését mutatják (50), valószínűleg az MCP1 változásai és az ovariectomia után a reaktív oxigénfajok (ROS) növekedése révén (18).
Perspektívák és jelentőség
Évszázadok óta egyértelmű, hogy vannak nemi különbségek a testösszetételben és a HFD-re adott válaszokban, de csak nemrégiben vált nyilvánvalóvá, hogy a nemek között gyulladásos különbségek vannak az étrend okozta gyulladás tekintetében. Vizsgálataink és mások eredményei hangsúlyozzák, hogy nem egyszerűen a hormonok befolyásolják közvetlenül az inzulinrezisztenciát, sokkal inkább a testösszetétel, az energiaráfordítás, az étvágy, az inzulintermelésre gyakorolt hormonhatások és az étrendre adott gyulladásos reakciók kombinációja hozza létre a szexuálisan dimorf az elhízással kapcsolatos betegségek aránya. Folytatni kell ezen különbségek további vizsgálatát, hogy valóban jobban megértsük, mi vezet a nemi különbségek klinikai paradigmájához az elhízás hatására.
A szerző (k) nem jelentenek be pénzügyi vagy egyéb összeférhetetlenséget.
- Metabolikus szindróma a gyulladásos bélbetegség társulásában az elhízás genetikai markereivel és
- A fehér zsírszövet metabolikus átalakulása elhízásban American Journal of
- A testmozgás metabolikus hatása a gyermekkori elhízásra egy jelenlegi nézet - ScienceDirect
- Metabolikus szindróma, elhízás és belső nap
- Metabolikus paraméterek és OrexigenicAnorexigenikus elhízási tényezők a Prader-Willi-szindróma Insight-ban