Journal of Childhood Obesity
Elena Bogova *, Natalya Volevodz, Valentina Peterkova és Ilin Alexander
Endokrinológiai Kutatóközpont, Gyermekgyógyászati Endokrinológiai Intézet, Moszkva, Orosz Föderáció
* Levelező szerző: Elena Bogova
Endokrinológiai Kutatóközpont, Gyermek Endokrinológiai Intézet
Moszkva, Orosz Föderáció
Tel: +7-925-882-05-48
Email: [e-mail védett]
Kapott dátum: 2017. június 10 .; Elfogadott dátum: 2017. július 31 .; Közzététel dátuma: 2017. augusztus 03
Idézet: Elena Bogova, Natalya Volevodz, Valentina Peterkova, Ilin Alexander (2017) Metabolikus paraméterek és az elhízás orrexigén/anorexigén tényezői Prader-Willi-szindrómában. J Child Obes 2. kötet 2. szám: 3:13 doi: 10.21767/2572-5394.100034
Absztrakt
A Prader-Willi-szindróma (PWS) egy komplex multisystem genetikai rendellenesség, amely az apai örökölt lenyomatok gének expressziójának hiányából adódik a 15. kromoszómán [1]. A PWS a szindrómás elhízás leggyakoribb oka, amely 10000–30 000 élveszületésből 1 esetben fordul elő [2]. Ez egy neurodevelopmentális rendellenesség, amelyet újszülöttkori hipotónia és sikertelenség jellemez, majd gyors súlygyarapodás 1-6 éves kor között, ami a legtöbb PWS-alanyra kóros elhízást és ennélfogva idő előtti halálozást okoz a szövődményei miatt. A PWS fenotípus több jellemzőt tartalmaz, amelyek többsége központi eredetű (hőmérsékleti diszreguláció, magas fájdalomküszöb, viselkedési rendellenességek, hipotalamusz hipogonadizmus, növekedési hormon hiány, központi hipotireózis, központi mellékvese elégtelenség). Az elhízás, főként a telhetetlen étvágy miatt, a PWS egyik legsúlyosabb tünete, ami idő előtti halálozáshoz vezet a szövődményei miatt. Ezért az elhízás és az étvágyszabályozás mélyebben megkülönböztető vonásait próbáltuk megvizsgálni PWS betegeknél.
Bevezetés
A Prader-Willi-szindróma (PWS) egy komplex multisystem genetikai rendellenesség, amely az apai örökölt lenyomatok gének expressziójának hiányából adódik a 15. kromoszómán [1]. A PWS a leggyakoribb oka a szindrómás elhízásnak, amely 10000–30 000 élveszületésből 1 esetben fordul elő [2]. Ez egy neurodevelopmentális rendellenesség, amelyet újszülöttkori hipotónia és sikertelenség jellemez, majd gyors súlygyarapodás 1-6 éves kor között, ami a legtöbb PWS-alanyra kóros elhízást és ennélfogva idő előtti halálozást okoz a szövődményei miatt. A PWS fenotípus több jellemzőt tartalmaz, amelyek többsége központi eredetű (hőmérsékleti diszreguláció, magas fájdalomküszöb, viselkedési rendellenességek, hipotalamusz hipogonadizmus, növekedési hormon hiány, központi hipotireózis, központi mellékvese elégtelenség). Az elhízás, főként a telhetetlen étvágy miatt, a PWS egyik legsúlyosabb tünete, ami idő előtti halálozáshoz vezet a szövődményei miatt. Ezért az elhízás és az étvágyszabályozás mélyebben megkülönböztető vonásait próbáltuk megvizsgálni PWS betegeknél.
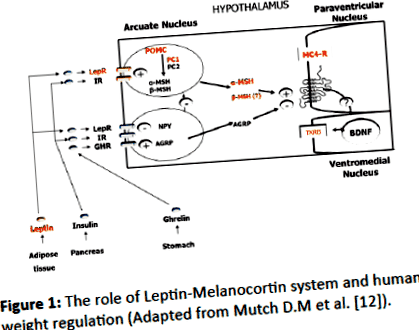
Értékeltük az elhízott, genetikailag igazolt PWS-ben szenvedő gyermekek metabolikus paramétereit, akiket nem kezeltek növekedési hormonral (GH), és összehasonlítottuk az adatokat az életkor, a nem és a BMI-vel nem egyező, nem PWS elhízott kontrollokkal (OC). Megmértük az orexigén (növekvő étvágy) és az anorexigén faktorokat (csökkenő étvágy) is, hogy megértsük a PWS-ben betöltött szerepüket. Feltételezzük, hogy a „PWS régió” (15q11-q13) olyan géneket tartalmaz, amelyek túlzottan expresszálódnak a hipotalamuszban, és kódolják az agy fejlődésének, működésének és az étvágyszabályozás szempontjából kritikus fehérjéket. A jóllakottság/éhség mechanizmusa a központi és perifériás peptidek neuroendokrin kontrollja alatt áll (1.ábra).
1.ábra: A Leptin-Melanocortin rendszer és az emberi súly szabályozásának szerepe (adaptálva Mutch D.M et al. [12]).
Tantárgyak és módszerek
17 elhízottat (BMI SDS = 3,66 [2,99 ÷ 4,57]) nem kezeltek PWS-ben szenvedő GH-s gyermekekkel (6 fiú, 11 lány) 9,9 éves medián életkorban [6,5 ÷ 13,9] 15 hasonló korú (9,8 [6,5 ÷ 12,0] éves), nemű (4 fiú, 11 lány) és BMI (3,21 [2,76 ÷ 3,62] SDS) elhízott gyermekek (OC). A vizsgálatba bevont összes gyermek pubertás előtti volt (Tanner 1. stádium).
A PWS betegeket genetikailag igazolták (metiláció-specifikus PCR). Krónikus másodlagos betegségben szenvedő alanyokat, például cukorbetegséget, máj- vagy vesebetegséget vagy aktív rosszindulatú daganatot, illetve azokat, akik vizsgálati gyógyszereket szedtek, kizárták. A tantárgyi jellemzőket és összehasonlításokat a Asztal 1.
| Életkor (év) | 9,9 [6,5 ÷ 13,9] | 9,8 [6,5 ÷ 12,0] | p = 0,82 |
| Hímek/nőstények | 06-nov | 04-nov | p = 0,85 |
| Tanner színpad | 1 | 1 | p = 0,4 |
| SDS BMI | 3,66 [2,99 ÷ 4,57] | 3,21 [2,76 ÷ 3,62] | p = 0,2 |
| SDS magasság | -0,02 [-1,29 ÷ 0,49] | 1,74 [1,06 ÷ 2,65] | p = 0,0001 * |
| Zsírtömeg (%) | 53,05 [48,75 ÷ 56,5] | 42,2 [40,5 ÷ 45,0] | Ã ? â ? Ã ? â ? ¬ = 0,04 * |
| Sovány tömeg (%) | 46,95 [43,5 ÷ 51,25] | 57,8 [55,0 ÷ 59,5] | Ã ? â ? Ã ? â ? ¬ = 0,04 * |
Asztal 1: A PWS és az OC jellemzői.
A fizikai vizsgálat magában foglalta a magasság és a súly meghatározását. Az álló magasságot Harpenden Stadiometer (Holtain Limited, Crymych, Dyfed, Egyesült Királyság) határozta meg.
A testtömeg mérése 0,1 kg pontossággal történt, standard berendezés alkalmazásával. A BMI-t úgy határoztuk meg, hogy kilogrammban elosztott súlyt osztottunk a magasság négyzetméterével. A kor- és nemspecifikus magasságra (Tanner JM, Whitehouse RH, 1976) és a BMI-percentilisekre (Cole TJ, 2000) vonatkozó normákat alkalmazták a standard deviációs pontszám (SDS) kiszámításához, valamint a gyermekek nem elhízottként történő osztályozásához ( BMI 2.0 SDS).
Az összes vérmintát reggel 12 órás éjszakai böjt után vettük össze. A laboratóriumi mérések között szerepelt a szérum glükóz, leptin, inzulin, inzulinszerű növekedési faktor 1 (IGF-1), lipidek (összkoleszterin, nagy sűrűségű lipoprotein (HDL), alacsony sűrűségű lipoprotein (LDL), trigliceridek), aszpartát-aminotranszferáz (AST) ), alanin-aminotranszferáz (ALT), éhomi és étkezés utáni szérum agyi eredetű neurotróf faktor (BDNF) és plazma ghrelin. Az inzulin és az IGF-1 koncentrációt kemilumineszcens immunometriás vizsgálattal, Cobas 6000 (Roche) és Liaison (Dia Sorin) analizátorok alkalmazásával mértük. A leptinszinteket enzim immunvizsgálattal határoztuk meg. A homeosztázis modell inzulinrezisztencia indexét (HOMA-IR) az éhomi inzulin és a glükóz koncentrációinak felhasználásával (éhomi glükóz x éhomi inzulin/22,5) használtuk. Az éhgyomri és étkezés utáni (60 perc és 120 perc) plazma teljes ghrelin és szérum BDNF szintjét vegyes étkezési tesztek során mértük (370 kcal: 20% fehérje, 50% szénhidrát és 30% zsír), kereskedelmi enzim immunoassay készletekkel (Phoenix Pharmaceuticals inc és K + F rendszerek). A ghrelin értékeléséhez szükséges vérmintákat EDTA-tartalmú vakutainer csövekbe vettük aprotininnel, és 70 C-on tároltuk 1 hónapig.
A testösszetételt kettős energiájú röntgenabszorpciós módszerrel (DEXA) értékeltük.
A statisztikai elemzéseket a Statistica for Windows v.8.0 alkalmazásával végeztük. Az adatokat medián és interkvartilis tartományként mutatjuk be. Manne-Whitney-tesztet használtunk 2 csoport összehasonlítására. A statisztikai szignifikancia meghatározásához a standard 0,05 szintű P értékeket használtuk.
Eredmények
A betegek méréseinek részleteit a 2. táblázat.
| Leptin (ng/ml) | 85,05 [43,7 ÷ 117,45] | 37,2 [27,7 ÷ 44,90] | Ã ? â ? Ã ? â ? ¬ = 0,02 * |
| IGF-1 (ng/ml) | 84,5 [52,7 ÷ 173,3] | 238,2 [221,9 ÷ 323,8] | p = 0,0003 * |
| Inzulin (U/l) | 9,7 [5,4 ÷ 15,45] | 12,6 [8,2 ÷ 18,5] | p = 0,38 |
| Glükóz (mmol/l) | 4,55 [4,0 ÷ 5,0] | 4,75 [4,2 ÷ 5,1] | p = 0,37 |
| HOMA-IR | 1,44 [1,04–2,05] | 2,74 [1,9 ÷ 3,95] | p = 0,01 * |
| Koleszterin összesen (mmol/l) | 4,9 [4,3 ÷ 5,6] | 4,06 [3,7 ÷ 5,1] | p = 0,08 |
| LDL (mmol/l) | 3,18 [2,45 ÷ 4,0] | 2,8 [2,0 ÷ 3,1] | p = 0,13 |
| HDL (mmol/l) | 1,1 [0,87 ÷ 1,5] | 0,97 [0,88 ÷ 1,2] | p = 0,42 |
| Trigliceridek (mmol/l) | 0,8 [0,7–1,1] | 1,05 [0,95 ÷ 1,25] | p = 0,07 |
| LT (U/l) | 25,75 [18,0 ÷ 42,7] | 18.15 [18.0 ÷ 22.0] | p = 0,1 |
| ST (U/l) | 27,0 [24,5 ÷ 36,15] | 23,5 [21,0 ÷ 25,0] | p = 0,05 |
2. táblázat: A PWS és az OC mérései.
Az OC-vel összehasonlítva a hasonló korú, nemű és BMI-s PWS gyermekek alacsonyabb SDS-vel (-0,02 [0,49 ÷ 1,78] vs. 1,74 [1,06 ÷ 2,65], p = 0,0001) és IGF-1-szinttel (84,5 [52,7 ÷ 173,30) ]) vs. (238,2 [221,9 ÷ 323,8], p = 0,0003). A testösszetétel-vizsgálatok azt mutatták, hogy a PWS gyermekeknél nőtt a testzsír, összehasonlítva az OC kontrollcsoportjával (53,05 [48,75 ÷ 56,5] vs. 42,2 [40,5 ÷ 45,0]%, Ã ? â ? Ã ? â ? ¬ = 0,04, ill. Csökkent sovány tömeg (46,35 [42,7 ÷ 49,85] vs. 57,80 [55,0 ÷ 59,5]%, Ã ? â ? Ã ? â? ¬ = 0,04). Az OC-hez képest a leptin szintje majdnem kétszer magasabb volt a PWS-ben (85,05 [43,7 ÷ 117,45] vs. 37,2 [27,7 ÷ 44,9] ng/ml, Ã ? â ? Ã ? â ? ¬ = 0,02 ); ezzel szemben két csoport között nem volt szignifikáns különbség a teljes koleszterin, a nagy sűrűségű lipoprotein (HDL), az alacsony sűrűségű lipoprotein (LDL), a trigliceridek, az AST és az ALT szintjeiben. A HOMA-IR alacsonyabb volt a PWS-ben az OC-vel összehasonlítva (1,44 [1,04 ÷ 2,05] vs. 2,74 [1,9-3,95], p = 0,01), ami arra utal, hogy a PWS gyermekek inzulinérzékenyebbek.
Az éhomi éhgyomri ghrelin koncentráció (1,0 [0,5 ÷ 1,0] vs. 0,23 [0,13 ÷ 0,30] ng/ml, Ã ? â? Â? ¬ = 0,028) és az étkezés utáni ghrelin szint 60 és 120 percen ( 0,47 [0,4 ÷ 1,0] vs. 0,18 [0,11 ÷ 0,31], p = 0,00039 és 0,5 [0,37 ÷ 1,0] vs. 0,14 [0,11 ÷ 0,28] ng/ml, p = 0,000025) szignifikánsan magasabb volt a PWS gyermekeknél a OC (2. ábra).
2. ábra: Az éhomi és étkezés utáni ghrelinszintek (ng/ml) PWS-ben és OC-ban vegyes étkezési teszt során.
Nem voltak szignifikáns különbségek a bazális (22,8 [15,7 ÷ 29,19] és 18,42 [10,40 ÷ 28,50] ng/ml, p = 0,54) és az étkezés utáni anorexigén BDNF szintek között 60 és 120 perc között a PWS és az OC között (27,7 [21,4 ÷ 30,27 ] vs. 22,53 [13,02 ÷ 26,20], p = 0,43 és 24,62 [18,56 ÷ 27,75] vs. 17,53 [11,08 ÷ 25,50] ng/ml, p = 0,21) (3. ábra).
3. ábra: Az éhomi és étkezés utáni ghrelinszintek (ng/ml) PWS-ben és OC-ban vegyes étkezési teszt során.
Vita
Az anorexigén hormon leptin koncentrációja magasabb volt a PWS-ben szenvedő betegeknél az OC-vel összehasonlítva. Mint ismert, a leptin a zsírsejtekből (adipocitákból) a tárolt zsír mennyiségével egyenes arányban választódik ki. Ezért a megfigyelt hiperleptinémia a PWS-ben szenvedő betegek magas adipozitási szintjét tükrözi [10]. A testösszetétel-vizsgálat kimutatta a testzsír növekedését és a sovány tömeg csökkenését a PWS gyermekeknél az OC-vel összehasonlítva, ami alacsony termetű és alacsony IGF-1-vel kombinálva arra utal, hogy a PWS-betegek növekedési hormonhiányosak.
Különböző peptideket és hormonokat vizsgáltak PWS-ben szenvedő betegeknél, de még mindig nincsenek pontos aggodalmak a PWS hyperphagia mechanizmusával kapcsolatban. Valószínűleg nem egy, de sok tényező játszhat szerepet a PWS-betegek fokozott étvágyában.
Következtetések
A megfigyelt PWS gyermekek alacsony termetűek, alacsony IGF-1-szinttel és rendellenes testösszetétellel, megnövekedett testzsírral és csökkent sovány testtömeggel hasonlítanak, hasonlóan a növekedési hormonhiányos betegekhez. A PWS gyermekeknél a leptinszint magasabb, mint az OC-ben, tükrözve az adipozitás mértékét. A HOMA-IR alacsonyabb volt a PWS-ben az OC-vel összehasonlítva, ami arra utal, hogy a PWS-ben szenvedő gyermekek érzékenyebbek az inzulinra, mint az «egyszerű elhízással» rendelkező betegek. Ez az inzulin eltérő szerepét sugallhatja a PWS metabolikus elváltozásainak patogenezisében, mint az egyszerű elhízás. Az éhomi és az étkezés utáni orexigén ghrelinszintek szignifikánsan magasabbak a PWS gyermekeknél az elhízott kontrollokhoz képest, ami jelzi az intrinsic hyperphagia jelenlétét ebben a szindrómában szenvedő betegeknél. A PWS gyermekek és az OC között nincsenek szignifikáns különbségek a bazális és az étkezés utáni anorexigén BDNF-szintekben, azonban további kutatásokra van szükség annak tisztázásához, hogy a BDNF és receptora milyen szerepet játszik a testsúlycsökkentésben, az energiafogyasztásban és az étvágyszabályozásban a PWS-ben.
- Metabolikus szindróma, adipokinek és hormonális faktorok farmakológiailag kezeletlen felnőtt időseknél
- Az elhízás paraméterei policisztás petefészek szindrómában
- Molekulák különszámú cukorhelyettesítők és elhízás, cukorbetegség és metabolikus szindróma
- A szív- és érrendszeri betegségek megelőzése Az elhízás, a cukorbetegség és a metabolikus szindróma
- Elhízás és metabolikus szindróma gyermekkori pikkelysömörben - ScienceDirect