A béta-adrenerg receptorok kritikus fontosságúak a fogyás szempontjából, de nem fontosak más metabolikus adaptációk a hím egerek ketogén étrendjének fogyasztásához.
Nicholas Douris
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Bhavna N. Desai
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
ffolliott M. Fisher
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Theodore Cisu
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Alan J. Fowler
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Eleen Zarebidaki
2 Biológiai Tanszék és Elhízás Megfordítási Központ, Georgia State University, Atlanta, GA 30302-4010, USA
Ngoc Ly T. Nguyen
2 Biológiai Tanszék és Elhízás Megfordítási Központ, Georgia State University, Atlanta, GA 30302-4010, USA
Donald A. Morgan
3 Farmakológiai Tanszék, University of Iowa, Carver College of Medicine, Iowa City, IA 52242, USA
Timothy J. Bartness
2 Biológiai Tanszék és Elhízás Megfordítási Központ, Georgia State University, Atlanta, GA 30302-4010, USA
Kamal Rahmouni
3 Farmakológiai Tanszék, University of Iowa, Carver College of Medicine, Iowa City, IA 52242, USA
Jeffrey S. Flier
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Eleftheria Maratos-Flier
1 Orvostudományi Tanszék, Beth Israel Deaconess Medical Center, Harvard Medical School, Boston, MA 02215, USA
Társított adatok
Absztrakt
Célkitűzés
Korábban kimutattuk, hogy az alacsony szénhidráttartalmú ketogén étrend (KD) egerek általi fogyasztása egyértelmű fiziológiai állapothoz vezet, amely a fogyáshoz, a megnövekedett anyagcseréhez és a jobb inzulinérzékenységhez kapcsolódik [1]. Ezenkívül a fibroblaszt 21-es növekedési faktort (FGF21) azonosítottuk a változások szükséges közvetítőjeként, mivel az FGF21 hiányában szenvedő egerek KD növekedést tápláltak, nem pedig lefogytak [2]. Az FGF21 aktiválja a szimpatikus idegrendszert (SNS) [3], amely az anyagcsere sebességének egyik legfontosabb szabályozója. Így úgy véltük, hogy az SNS szerepet játszhat a ketózis metabolikus adaptációjának közvetítésében.
Mód
Ennek a hipotézisnek a teszteléséhez megmértük mindhárom β-adrenerg receptor nélkül (β nélküli egerek) hiányzó egerek válaszát a KD táplálására.
Eredmények
A vad típusú (WT) kontrollokkal ellentétben a β-nélküli egerek híztak, megnőtt a zsírszövet-raktárak tömege, és nem növelték az energiafelhasználást a KD fogyasztása során. Figyelemre méltó, hogy a súlygyarapodás ellenére a β-nélküli egerek inzulinérzékenyek voltak. A β-nélküli egerek májdaganat-expressziójának KD-indukálta változásai hasonlóak voltak a KD-t fogyasztó WT kontrolloknál tapasztaltakkal. Az FGF21 mRNS expressziója 60-szorosára emelkedett mind KD-vel táplált WT, mind β-nélküli egerekben, és a megfelelő keringő FGF21 szint 12,5 ng/ml volt KD-vel táplált vad típusú kontrollokban és 35,5 ng/ml volt KD-vel táplált β-nélküli egerekben.
Következtetések
A β-mentes egerek válasza a fiziológiai hatások legalább két külön kategóriáját különbözteti meg KD-t fogyasztó egerekben. A májban a KD az SNS-től és a béta-adrenerg receptoroktól független FGF21 hatása révén szabályozza a peroxiszóma proliferátor által aktivált alfa (PPARα) -függő utakat. Éles ellentétben az interscapularis barna zsírszövet (BAT) indukciója és a megnövekedett energiafelhasználás feltétlenül szükségessé teszi az SNS jeleket, amelyek egy vagy több β-adrenerg receptoron hatnak. Ily módon az FGF21 KD-re reagáló kulcsfontosságú metabolikus hatásainak különböző effektormechanizmusai vannak.
1. Bemutatkozás
Emberben a magas zsírtartalmú, alacsony szénhidráttartalmú KD fogyasztása súlycsökkenéshez vezet és javítja a glükóz toleranciát, a lipidprofilra nincs káros hatással [4]. Egerekben korábban már kimutattuk, hogy a KD táplálkozás különálló anyagcsere-állapothoz vezet, amelyet súlycsökkenés, megnövekedett energiafelhasználás, a BAT aktiválása, fokozott szisztémás inzulinérzékenység és a máj gén expressziójának különös mintázata jellemez [1]. Ezt követően értékeltük a KD táplálás hosszú távú hatásait, és hosszú távú rezisztenciát találtunk a WT egerek súlygyarapodásával szemben ezen étrenden, a károsodás és a mortalitás káros hatása nélkül [5].
Az emberektől eltérően az FGF21 máj expressziója fokozódik a KD-t fogyasztó egerekben, és szükséges közvetítője az étrend fiziológiai adaptációinak. Az FGF21 knockout (KO) egerek inkább híznak, mint fogynak az étrenden [6]. Az FGF21 részben aktiválja a BAT-ot is az SNS meghajtó növelésével [3], [7]. Ezenkívül az ob/ob egér, a csökkent SNS kiáramlású modell [8], szintén részben ellenáll a KD teljes hatásának; a glükóz tolerancia javul, de fogyás nem figyelhető meg [6]. Mivel ismert, hogy mind az anyagcsere sebességét, mind a BAT termogén programját az SNS szabályozza [9], feltételeztük, hogy az SNS szerepet játszhat a ketogén étrendhez való alkalmazkodásban.
Ennek a hipotézisnek a teszteléséhez egérmodellt használtunk, amelyből hiányzik az összes β-adrenerg receptor (β nélküli egerek) [10], és megmértük a KD-re adott választ. A normál WT egerekben megfigyelt súlycsökkenéssel ellentétben a KD-t fogyasztó β-nélküli egereknek a fenotípusuk egyértelműen más volt, mint a fogyás. Ezt a súlygyarapodást annak ellenére figyelték meg, hogy a májban a ketotikus génexpresszió tipikus mintázata volt kimutatható. Érdekes, hogy a májtól eltérően a β-nélküli egerek zsírszövete nem mutatta meg a KD-hez való várható alkalmazkodást. Míg a WT BAT-ban megnövekedett szétkapcsolási protein 1 (UCP1) fehérjét figyeltek meg, ezt a növekedést a β-nélküli egereknél nem figyelték meg. Továbbá bebizonyítottuk, hogy a KD-t fogyasztó WT egerekben megfigyelt megnövekedett UCP1 expresszió a KD étrendre való áttérés után 24 órával a BAT-ra való fokozott SNS-hajtás révén közvetített. Ez az SNS kiáramlási profil hiányzott a β nélküli egerekből. Eredményeink megerősítik, hogy a β-adrenerg receptorokon keresztül közvetített SNS-aktivitás szükséges a fiziológiai válaszhoz és a ketogén étrendhez való alkalmazkodáshoz, amely végső soron fogyást eredményez.
2. Anyagok és módszerek
2.1. Egérfenntartás és diéták
Az összes kísérletet 8-16 hetes hím WT-vel (FVB/C57BL6/DBA/2/129SvJ) és β-nélküli egerekkel (a β1, β2 és β3 adrenoreceptorok megzavarására homozigóta egerek) végeztük. Ezeket az egereket használták a genetikai szimpatektómia vizsgálatokban [10], és különálló telepként tartják fenn: WT telep és β nélküli telep a Bradford Lowell Laboratórium Beth Israel Deaconess Orvosi Központjában 2002 óta. A β-less szülői törzsek az egerek a következő genotípussal rendelkeznek - a β1,2 receptor kettős kiütés (Ardb1,2 tm1Bkk FVB/C57BL6/DBA/2/129SvJ) és a β3 receptor kiütés (Ardb3 tm1Lowl FVB) tenyésztve hármas receptor kiütés.
Az egereknek ad libitum hozzáférést biztosítottak a vízhez és a két diéta egyikét; chow étrend és KD. A kontroll chow étrend összetétele 6,5% zsír, 23,5% fehérje és 56% szénhidrát (2,5% szacharóz) volt (LabDiet 5008 - Pharmaserv, Framingham, MA). A KD összetétele 78,9% zsír, 9,5% fehérje és 0,76% szénhidrát (0% szacharóz) volt (Bio-Serv F3666, Frenchtown, NJ). Kimutatták, hogy ez a készítmény rágcsálókban ketózist indukál [11], és korábban KD vizsgálatokhoz használtuk [1].
Az egereket 12 órás fény alatt tartottuk: 12 órás sötét ciklus és 22 ± 2 ° C környezeti hőmérséklet. Valamennyi eljárás összhangban volt az Állatok Egészségügyi Intézetének az állatok gondozására és felhasználására vonatkozó irányelveivel, és a Beth Israel Deaconess Medical Center (Boston MA) és az Iowa Egyetem (Iowa City, IA) intézményi állatgondozási és felhasználási bizottsága jóváhagyta.
2.2. Dinamikus fiziológiai tesztek
Glükóz tolerancia teszt: Az egereket 16 órán át éheztettük, mielőtt az intraperitoneális (IP) injekcióval d-glükózt (2 g/test WT testtömeg; Sigma, St. Louis, MO) adtunk be 4 órával a fényciklus megkezdése után, és a glükózt 0, 10, 20, 30, 60, 90 és 120 perccel mértük az injekció beadása után.
Inzulin tolerancia teszt: Ad libitum táplált egereknek 8 órával a fényciklus megkezdése után inzulint (0,75 E/kg; Lilly, Indianapolis, IN) injektáltunk, és a glükózt 0, 20, 40, 60, 80, 100, 120 és 140 perccel az injekció beadása után.
A glükózszinteket mindkét tesztnél OneTouch Ultra glükométerrel (Lifescan, Milpitas, CA) mértük.
2.3. Közvetett kalorimetria
Az egerek energiafogyasztását közvetett kalorimetriával mértük az átfogó laboratóriumi állatfigyelő rendszerrel (CLAMS; Columbus Instruments, Columbus, OH). Az egereket egyedileg helyezték el, ad libitum hozzáféréssel az élelemhez és a vízhez. Az elemzést 24 ° C-on, 12: 12 órás fény – sötét ciklus alatt végeztük (fényperiódus 0600–1800). Az egereket 48 órán át akklimatizáltuk a metabolikus kamrákban, mielőtt összegyűjtöttük az adatok elemzéséhez használt méréseket.
2.4. Szérumelemzés
2.5. RNS extrakció és kvantitatív valós idejű PCR
Az RNS-t folyékony nitrogénben flash-fagyasztott szövetekből izoláltuk Direct-zol RNS MiniPrep kit (Zymo Research, Irvine, CA) segítségével. A cDNS-t izolált RNS-ből készítettük oligo (dt) és random hexamer primerek és reverz transzkriptáz alkalmazásával (QuantiTech RT Kit; Qiagen, Germantown, MD). A kvantitatív PCR-t a 7800HT (Applied Biosystems, Foster City, CA) hőkerékpárral és a SYBR Green master keverékkel (Applied Biosystems, Foster City, CA) hajtottuk végre. Kiszámítottuk a relatív mRNS-bőséget és normalizáltuk a háztartási 36B4 gén szintjére. Az alapozókat az 1. kiegészítő táblázat tartalmazza.
2.6. Szimpatikus idegaktivitás (SNA) rögzítése
Az SNA-t BAT-ra többszálas rögzítéssel mértük. Boncoló mikroszkóppal azonosítottuk a BAT-t beidegző ideget, és gondosan szabadon boncoltuk, és egy bipoláris, 36-os méretű platina-irídium elektródra helyeztük (A-M Systems, Carlsborg WA). Az SNA optimális rögzítésének elérésekor az elektródát szilikon géllel borítottuk (Kwik-Sil; World Precision Instruments Inc., Sarasota FL).
Idegelektródákat erős impedanciájú szondához (HIP-511, Grass Instruments Co., Quincy, MA) csatlakoztattunk. Az idegjelet 10-szer 5-szer erősítettük fel Grass P5 AC előerősítővel, amelyet alacsony, illetve 100 Hz-es, illetve 1000 Hz-es alacsony frekvenciás határérték mellett szűrtünk. Az erősített, szűrt idegjelet a hangszórórendszerbe és egy oszcilloszkópba (54501A modell, Hewlett – Packard Co., Palo Alto, Kalifornia) irányítottuk az idegaktivitás hallási és vizuális monitorozására, végül egy visszaállító feszültségintegrátorra (B600C modell, University of Iowa Bioengineering), amely a teljes feszültséget 1 másodperc egységben összegzi, mielőtt nullára állítaná. Az újraindító feszültségintegrátort és az amplifikált, szűrt neurogrammokat folyamatosan egy MacLab analóg – digitális átalakítóhoz (8S modell, AD Instruments Castle Hill, Új-Dél-Wales, Ausztrália) irányítottuk állandó rögzítés és adatelemzés céljából. Annak biztosítása érdekében, hogy az integrált feszültség szimpatikus kiáramlásának értékelése során kizárják a háttér-elektromos zajt, az SNA-t korrigálták a mortem utáni háttéraktivitásra.
2.7. Adatelemzés
Az adatok átlagként ± az átlag standard hibájaként (SEM) jelennek meg. Az időbeli lefutású kísérleteket kétirányú ANOVA alkalmazásával elemeztük ismételt mérésekkel, amelyet Bonferonni post-hoc tesztje követett az egyes összehasonlításokhoz. A négyirányú vizsgálatok egypontos mértékeit egyirányú ANOVA alkalmazásával elemezték, amelyet Bonferonni post-hoc tesztje követett az egyes összehasonlításokhoz. A kétirányú vizsgálatok egypontos mértékeit kétfarkú párosítatlan T-teszt alkalmazásával elemezték.
3. Eredmények
3.1. A ketogén étrend hosszú távú fogyasztása fogyást okoz vad típusú egerekben, de nem béta nélküli egerekben
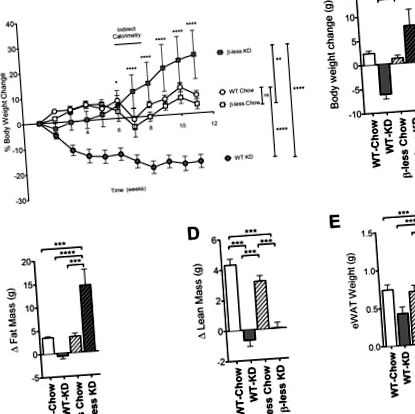
Korábban kimutattuk, hogy a WT C57BL/6 egerek által fogyasztott KD súlycsökkenéshez vezet [1]. Annak megvizsgálására, hogy szükségesek-e ép β-adrenerg receptorok a KD által kiváltott súlycsökkenéshez, krónikusan etettük a KD-t egerekkel, amelyekből mindhárom β-adrenerg receptor hiányzik (β-nélküli egerek). Korábban publikált tanulmányainkkal összhangban a 11 héten keresztül KD-t fogyasztó WT egerek elvesztették kezdeti testsúlyuk 19% -át (6 g). Ezzel szemben azt tapasztaltuk, hogy a 11 héten keresztül KD-t fogyasztó β-nélküli egerek jelentősen híztak, ahelyett, hogy fogyókúrásak lennének. 11 hétre 23% -os 7 g-os súlygyarapodás látható (1.A, B ábra). A kontroll chow étrenden lévő WT és β nélküli egerek szerény 1,4 g-ot nyertek ebben az intervallumban.
A β-nélküli egerek nem képesek lefogyni a ketogén diéta fogyasztása során. β-nélküli egerek ketogén étrendet tápláltak súlygyarapodással a chow táplált kontrollokhoz képest (P 1. ábra C). A sovány tömeg nőtt a chow-táplált kohorszokban, de nem a KD-vel táplált kohorszokban (1. D ábra). Az adipozitás növekedése részben az epididymális fehér zsírszövet zsírraktárának növekedésével magyarázható (1. E ábra).
3.2. A béta nélküli egerek nem képesek növelni az energiafelhasználást a ketogén étrend fogyasztása során
WT egerekben a KD fogyasztása megnövekedett energiafogyasztáshoz vezetett, amit a megnövekedett VO2 fogyasztás értékel. Ezzel szemben a β nélküli egerek nem mutatták a VO2-fogyasztás növekedését (2. ábra A, B). Mind a WT, mind a KD-t fogyasztó β-nélküli egereknél állandóan alacsony volt a légzéscsere aránya (RER) 0,70 és 0,75 között, ami napi ritmusának csökkenését mutatja, ami arra utal, hogy a zsírt üzemanyagként használják mind táplált, mind éheztetett állapotban (2. ábra C, D). Ezek a változások függetlenek a kalóriabeviteltől (2. E ábra).
A ketogén étrend által kiváltott fogyás az energiafelhasználás növekedésének köszönhető. A 11 héten keresztül KD-vel táplált vad típusú egereknél a VO2 (A) metabolikus sebessége magasabb, mint a szarvas táplálékú társaiké (P 3. A ábra), bár a hatás hangsúlyosabb volt a WT egerekben. A KD szintén javította az inzulinérzékenységet a WT és a β nélküli csoportokban, inzulin tolerancia teszt alapján. Annak ellenére, hogy a KD fogyasztása közben nem volt fogyás, a KD-vel táplált β-nélküli egerek inzulinérzékenyek voltak, a bazális keringő glükózszint 20% -kal csökkent (3. B ábra). Amint azt korábban bemutattuk [1], a KD-vel táplált WT egerek szintén figyelemre méltóan inzulinérzékenyek voltak, az alapszint 22% -ára csökkentek (3. B ábra). Az étrend következtében az inzulinérzékenységet figyelték meg, és független volt a genotípustól.
A ketogén diétás táplálás az SNS-től függetlenül javítja az inzulinérzékenységet. A KD-vel táplált vad típusú egereknél alacsonyabb az éhomi glükóz (A), és mind a KD-t fogyasztó WT, mind a β-nélküli egerek inzulinérzékenyek maradnak (P 4. ábra A, B). Közepes láncú hosszú és nagyon hosszú láncú acil-koenzim-A dehidrogenáz (MCAD, LCAD, VLCAD) és 3-hidroxi-acil-koenzim A-dehidrogenáz (Hadh) mind 2-3-szorosra emelkedett, amikor WT-t vagy β-nélküli egereket adagoltak KD (4. ábra C – E).
Keton testképződés: A keton test kialakulásában szerepet játszó gének mind megnövekedtek a KD táplálásakor, és ezt ismét a diéta és nem a genotípus függvényében figyelték meg. A ketogenezis első reakcióját katalizáló mitokondriális enzimet kódoló gén, a 3-hidroxi-3-metil-glutaril-koA-szintáz 2 (Hmgcs2) mind a WT-vel táplált KD-ben, mind a β-kevésbé táplált KD-ben, valamint a 3-hidroxi-butirát-dehidrogenázban (Bdh1 ), amely egy olyan fehérjét kódol, amely katalizálja az acetoacetát és a β-hidroxi-butirát közötti átalakulást (4. ábra H – J).
PPARα célgének: Az UCP2 és CD36 PPARα célgéneket szintén KD-táplálással (UCP2; 2-3-szoros, CD36; 7-8-szoros) szabályozták, míg a genotípusnak nincs további hatása (4. ábra K, L).
3.5. A ketogén étrendben lévő vad típusú egerek növelik az energiafogyasztást, a barnulástól függetlenül a szubkután inguinalis fehér zsírszövetben
Korábban megállapították, hogy a hidegnek kitett β-3-adrenoreceptor knockout egereknek fehér adipocitái vannak, amelyek nem expresszálják az UCP1-t, és redukált termogén markerekkel rendelkeznek, mint például a PGC-1a, CIDEA és C/EBPβ [12]. Ezzel szemben az inguinalis fehér zsírszövet (IWAT) megbarnulását figyeltük meg KD-vel táplált β-nélküli egerekben, ami arra utal, hogy a KD hatása erre a folyamatra független a β-adrenerg receptoroktól. Mind a WT egerek, mind a KD-n β-mentes egerek bizonyos termogén markerek növekedését mutatták, mint például az UCP1, Cox 7a1, C/EBPβ és CPT1b (5. ábra A, B, E, F) az inguinalis fehér zsírszövetben (IWAT) ). Ugyanakkor a β-nélküli egereknek tompult a Cox8b és a CIDEA szintje (5. ábra C, D) a WT egerekhez képest, és a KD nem indukálta ezen gének expresszióját.
- A béta-adrenerg receptorok kritikus fontosságúak a fogyás szempontjából, de a más anyagcsere-adaptációk szempontjából nem
- A legjobb fogyókúrás tabletták Kritikus áttekintés
- Avokádó és más magas kalóriatartalmú ételek, amelyek segíthetnek a fogyásban - Insider
- 10 anyagcsere mozog a feltöltő fogyáshoz
- A zsírleszívás 5 előnye, kivéve a fogyást Premier zsírleszívás