A BMI változása a radioaktív jód ablációja után súlyos betegségek esetén
Absztrakt
Háttér
Célunk volt meghatározni a kezelés utáni súlygyarapodás mértékét, amely gyermekgyógyászati betegeknél a Graves-betegség (GD) radioaktív jód (RAI) terápiáját követő első évben következik be, és annak kapcsolatát a klinikai jellemzőkkel.
Mód
1998 és 2015 között GD-ben RAI-terápiában részesülő betegek retrospektív diagramáttekintését végeztük. A BMI SDS (∆BMI SDS) változása a kiindulási értékről a kezelés meghatározása után egy évre. Azt is megvizsgáltuk, hogy ezeknél a betegeknél egyedi klinikai és/vagy biokémiai tényezők kapcsolódtak-e a súlypályához.
Eredmények
Százötven hét 12,7 ± 3 éves beteg (lányok 80% -a) került be az elemzésbe. Az átlagos ∆BMI SDS 0,70 ± 0,71 (o
Háttér
A pajzsmirigy autoimmun túlstimulációjával jellemzett Graves-kór (GD) a gyermekek és serdülők hyperthyreosisának leggyakoribb oka [1,2,3,4]. A gyermekpopulációban az összes előfordulás megközelítőleg egy 10 000-ből [5], a legmagasabb prevalenciát serdülő lányoknál tapasztalták [2]. Bár a GD hipermetabolikus állapota jellemzően fogyást eredményez, a megnövekedett kalóriabevitel miatt stabil súly vagy akár súlygyarapodás tapasztalható [5].
A GD kezelésének terápiás módjai közé tartozik a műtét, a radioaktív jód (RAI) ablációja és a pajzsmirigy-ellenes gyógyszerek (ATD). A műtétet és a RAI-t végleges terápiának tekintik, és állandó hypothyreosisot eredményeznek. A végleges terápiában részesülő betegek gyakran hipotireoidokká válnak egy ideig, mielőtt a megfelelő levotiroxinpótlás és biokémiai eutireózis eljutna. A GD kezelését követő súlygyarapodásról beszámoltak gyermekeknél és felnőtteknél egyaránt. A javasolt magyarázatok magukban foglalják a folyamatos megnövekedett kalóriafogyasztást a korábbi hipermetabolikus állapot [5] feloldásával, a premorbid testsúly visszatérését vagy túlzását [6], vagy a kezelés utáni hypothyreosis következményét [7]. Korábbi tanulmányok a gyermekek GD kezelését követő súlyváltozásról számoltak be, elsősorban azokra a betegekre összpontosítottak, akiket első vonalbeli terápiában ATD-vel kezeltek. Ezzel szemben a BMI RAI-kezelés utáni változását nem vizsgálták szisztematikusan. Nem ismert, hogy maga a kezelési mód befolyásolja-e a súlygyarapodás mértékét, vagy vannak-e olyan klinikai vagy biokémiai tényezők, amelyek módosíthatják a súlygyarapodás mértékét ezeknél a betegeknél [7,8,9].
Így vizsgálatunk célja a súlygyarapodás mértékének vizsgálata volt a GD RAI terápiáját követő első évben. Arra is törekedtünk, hogy megvizsgáljuk, vajon az egyedi jellemzők összefüggenek-e a pácienseink közötti súlygyarapodás különbségeivel.
Mód
Az Indianai Egyetemi Intézményi Felülvizsgálati Testület etikai felülvizsgálatát és a 1412088318. számú jegyzőkönyv jóváhagyását követően retrospektív diagram-áttekintést végeztek azokról a gyermekgyógyászati betegekről, akik 1998 és 2015 között a Riley Gyermekkórházban RAI-ablációban részesültek. négy hónappal a RAI-kezelés előtt, és egy utólagos látogatást, dokumentált magassággal és súlygal, 6 és 18 hónap között, a RAI dátumát követően. Függetlenül attól, hogy a betegeket kezelték-e GD-vel az intézményünkben végzett értékelés előtt, az összes beteg hyperthyreoid volt a RAI idején. Ha egy második RAI adagra volt szükség, akkor a sikeres ablációhoz vezető dózist (azaz a második dózist) használták fel érdeklődésként a kezelés előtti és utáni magasság és súly meghatározásához.
Az orvosi nyilvántartásokban olyan érdeklődésre számot tartó tényezőket kerestek meg, amelyek magukban foglalták az életkort, a nemet, a pubertás státuszt, a fogyás előzményeit, a DS-t (Down-szindróma), az ADHD kezelésére szolgáló gyógyszereket, az ATD-t legalább egy hónapig a RAI előtt, a levotiroxin-helyettesítés kezdő dátumát, valamint a dokumentált euthyreosis dátuma. A súlyt és a magasságot összegyűjtöttük a kiinduláskor (az utolsó találkozás a RAI előtt) és az egyéves utánkövetés időpontjában. A BMI-t a képlet segítségével számoltuk ki. A pubertás állapotát pubertás előtti (Tanner I) vagy pubertás (Tanner II-V) kategóriába sorolták. Az euthyreoidist TSH-nak és szabad T4-nek vagy teljes T4-nek vagy teljes T4-nek tekintették az elvégző laboratórium referencia-tartományán belül, vagy (az esetek kis részében) a laboratóriumi vizsgálatok dokumentált „normálisnak” értelmezését az elsődleges endokrinológus.
Valamennyi BMI-t a Centers for Disease Control (CDC) szabványai szerint alsúlyúnak (th percentilis), normál testsúlyúnak (5. percentilis), túlsúlyosnak (85. percentilis) vagy elhízottnak (≥95 th percentilis) osztályozták [10]. Az euthyreoidizmusig eltelt időt (TTE) úgy számítottuk ki, hogy meghatároztuk a levothyroxin-helyettesítés megkezdése és a dokumentált euthyroidismus dátuma közötti hetek közötti időt.
Statisztika
Az elemzéseket SPSS statisztikai szoftver (24. verzió; IBM Corp.) segítségével végeztük. A statisztikai módszerek megfelelőségének meghatározása érdekében az összes érdeklődésre számot tartó változó normalitását megvizsgáltuk, és normális eloszlásúnak találtuk. Leíró statisztikákat alkalmaztak az antropometriai adatok és az időintervallumok jelentésére. Khi-négyzet teszteket és Fisher pontos tesztjeit használták a súlyállapot-kategória eloszlásának különbségeinek elemzésére a RAI előtt és után. Páros t-teszteket alkalmaztunk a BMI kezelés előtti és utáni különbségek értékelésére. Párosítatlan t-teszteket használtunk a klinikai kockázati tényezők súlygyarapodásra gyakorolt hatásának elemzésére. Lineáris regressziót használtunk az összefüggés erősségének leírására a BMI SDS időbeli változásának (∆) és a hozzájáruló tényezőknek. A szignifikancia szintje α = 0,05 volt, az összes 0,05-nél alacsonyabb p-értéket statisztikailag szignifikánsnak tekintettük. Az eredményeket átlag ± SD értékként fejezzük ki a szövegben, a mediánokat és a tartományokat az 1. táblázatban is megadjuk.
Eredmények
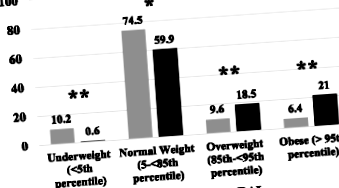
A GD-ben RAI-ban részesülő 247 beteg közül 157-nek (79,6% nő) teljes adatai voltak, és bekerültek az elemzésbe. Az átlagos kiindulási életkor 12,7 ± 3,0 év volt, az átlagos kiindulási BMI SDS pedig 0,003 ± 1,18 kg/m 2. Tíz betegnél (6,4%) volt DS (Down-szindróma), 33-nál (21,0%) pedig ATD-t kapott a RAI abláció előtt. A dokumentált pubertás státuszú 135 beteg közül 88 (65,2%) ≥ Tanner II stádiumú volt az alapértékelésnél. A kezelés utáni BMI-adatokat 50,65 ± 11,32 héttel a RAI után kaptuk.
Az átlagos ∆BMI SDS a kiindulási értéktől az egy évig 0,70 ± 0,71 (p 1. ábra
Alanalízist hajtottak végre 81 betegen (85,2% nő) a megfelelő megfelelés bizonyítékával, akiknél a pontos TTE rendelkezésre állt. Ezen a csoporton belül a TTE 24,16 ± 13,28 hét volt, és az ∆BMI SDS egy év alatt nem különbözött a csoport egészétől. A teljes kohorsznál tapasztaltaktól eltérően a súlycsökkenés anamnézisében 1 év alatt nem volt hatással a ∆BMI SDS-re (0,77 ± 0,62 vs. 0,55 ± 0,56, p = 0,12), míg a prepubertális betegeknél nagyobb volt a ∆BMI SDS, mint a pubertás betegeknél 1 év alatt (0,90 ±, 71 vs 0,57 ± 0,58, p = 0,037). Férfiaknál a hosszabb TTE korrelált a BMI z-pontszámának nagyobb növekedésével (R = 0,63, p = 0,029) (2. ábra), míg hasonló, bár gyengébb asszociációt észleltek a nőknél (R = 0,59, p ≤ 0,001).
Az ∆BMI SDS és az idő viszonya a fiúk eutireoidizmusához
Vita
A GD kezelés utáni súlygyarapodást felnőttek jól ismerik, de tudomásunk szerint gyermekkorú betegeknél csak két korábbi tanulmányt publikáltak [5, 11]. Ezek a vizsgálatok olyan betegeket vontak be, akiket szinte kizárólag ATD-kkel kezeltek, mint első vonalbeli terápiát, és nem vizsgálták szorosan annyi lehetséges módosító tényezőt. Az első évben 0,70 ± 0,71 ∆BMI SDS-t figyeltünk meg azon populációnkban, akik a GD végleges kezelésében részesültek RAI-terápiában. Egy korábbi tanulmány legfeljebb 3 évig követte a gyermekeket, és a BMI z-pontszámának hasonló növekedését figyelték meg a kezelés után -0,02 ± 1,05-ről 0,79 ± 0,81-re, a súly későbbi stabilizálásával, a legnagyobb súlygyarapodás a kezelés első 6 hónapjában volt megfigyelhető [ 5]. Egy második tanulmány, amely összehasonlította a súlyváltozásokat mind a hypothyreosis, mind a hyperthyreosis kezelésében, szintén súlygyarapodást jelentett a GD kezelése után a nyomon követés korai szakaszában, bár a pontos időkeretet nem határozták meg [11].
Nem meglepő, hogy a RAI előtti testsúlycsökkenés nagyobb súlygyarapodással járt együtt a populációnk nyomon követése során, bár ez az összefüggés nem volt jelen az alelemzésben. Az alanalízisünkben szereplő prepubertális betegeknél azonban nagyobb volt a ∆BMI SDS. Ez összhangban van egy másik vizsgálattal, amely szerint a GI kezelése után a BMI nagyobb növekedést figyelt meg 11 év alatti gyermekeknél az idősebb gyermekekhez képest [5]. Nem ismert, hogy ez a kapcsolat az életkor vagy a pubertás során bekövetkező anyagcsere-változások következménye. Nem találtak más tényezőket, amelyek egyértelműen meghatároznák a magasabb kockázatú csoportokat a súlygyarapodáshoz a populációnkban. A GD-ben RAI-ban részesülő összes beteget súlyosan megnövekedett kockázatnak kell tekinteni, és ennek megfelelően tanácsot kell adni.
Bár tanulmányunk a RAI terápia hatásaira összpontosított, a betegek 21% -a korábban kapott ATD-t, és egy év alatt nem tapasztalt különbséget a ∆BMI SDS-ben azokhoz képest, akik nem. A legtöbb ATD-vel kezelt beteget nem láttuk intézményünkben a GD-vel való első bemutatásukkor, így a kezelés előtti BMI-k nem voltak elérhetőek. Korábbi kutatások azonban azt sugallják, hogy a szekvenciális kezelési módok alkalmazása felnőtteknél folytonos súlygyarapodást eredményezhet a végleges kezeléshez képest, mint első vonalbeli megközelítést [8]. Ezt a kérdést érdekes lenne megvizsgálni gyermekgyógyászati betegeknél is. Ha ezt megerősítik, ez további ok lehet a korábbi végleges kezelés támogatására, nem pedig olyan orvosi terápia folytatására, amely csak ritkán vezet végleges remisszióhoz gyermekeknél és serdülőknél, és ritka, de súlyos mellékhatások lehetőségét hordozza magában [12].
Míg a subanalízis során a TTE negatívan korrelált az ∆BMI SDS-vel, ennek az összefüggésnek a gyengesége azt sugallja, hogy más tényezőket is figyelembe kell venni. Noha felnőtteknél végzett egyes tanulmányok a BMI kimenetelének különbségeit mutatják a kezelési módok szerint [8, 9], ezt nem bizonyították következetesen, és nem ismert, hogy ezek az elvárások kiterjeszthetők-e a gyermekekre. Hasonló eredményeket találtunk népességünkben, összehasonlítva más központok jelentéseivel [5].
Tudomásunk szerint tanulmányunk a legnagyobb gyermekcsoportot képviseli, akiknél a GD kezelését követő súlygyarapodást vizsgálják, és az egyetlen, amelyben az összes beteget RAI-val kezelték. A korlátozások közé tartozik annak retrospektív jellege, valamint az a tény, hogy a pontos TTE-t dokumentáló adatok csak 81 betegünknél voltak elérhetőek. További gyengeség, hogy a GD kialakulása előtt nem volt információnk pácienseink BMI-jéről. Betegeink közel 40% -a azonban túlsúlyos vagy elhízott volt egy év alatt, ez meghaladja az országos BMI SDS-adatokat 2–19 éves fiataloknál [13].
Következtetések
Összefoglalva, a BMI SDS szembetűnő és majdnem univerzális növekedését figyeltük meg egy évvel a GD RAI kezelése után, ami a túlsúly és az elhízott betegek számának megduplázódását eredményezte, ami nagyobb kockázatot jelent az egészségre gyakorolt káros következmények miatt idő. A jövőbeni vizsgálatoknak olyan célzott beavatkozásokra kell összpontosítaniuk, amelyek célja a súlygyarapodás mértékének csökkentése a GD kezelés alatt álló gyermekek és serdülők esetében.
- Az alacsony jódtartalmú étrend tapasztalatai a differenciált pajzsmirigyrák radioaktív kezelésében
- Krónikus suppuratív tüdőbetegség felnőtteknél - Metersky - Journal of Thoracic Disease
- A fizikai inaktivitás okoz-e alkoholmentes zsírmájbetegséget Journal of Applied Physiology
- Verseny a gyógyszeriparban A PAH Drugs esete
- Az alkoholmentes zsírmájbetegség fókuszos zsírtartalmának dinamikus változása a kezelés után